分泌性中耳炎大鼠咽鼓管鼓室β-防御素的表达
2010-09-09樊春笋黄一波李雯舒易来沈雁
樊春笋,黄一波,李雯,舒易来,沈雁
(复旦大学附属眼耳鼻喉科医院,上海 200031)
研究报告
分泌性中耳炎大鼠咽鼓管鼓室β-防御素的表达
樊春笋,黄一波,李雯,舒易来,沈雁
(复旦大学附属眼耳鼻喉科医院,上海 200031)
目的检测大鼠β防御素(rat β-defensin,rBD)在分泌性中耳炎大鼠咽鼓管鼓室的表达,探讨β防御素在分泌性中耳炎发病机制中的作用。方法排除中耳感染的清洁级SD大鼠48只,随机分为4组,前3组36只行颈部切口经右侧听泡注入脂多糖(lipopolysaccharide,LPS)溶液(1 mg/mL)30 μL制作分泌性中耳炎动物模型,造模后分别于第1、3、7天断头取咽鼓管鼓室黏膜;对照组12只右侧听泡注入生理盐水30 μL,左侧听泡作为正常组,3 d后断头取咽鼓管鼓室黏膜。逆转录聚合酶链反应(RT-PCR)检测咽鼓管鼓室rBD-1 mRNA和rBD-2 mRNA的表达。结果正常大鼠咽鼓管鼓室存在rBD-1和rBD-2的表达,且rBD-1的表达较rBD-2强,差异有统计学意义;造模后第1、3、7天,rBD-1表达变化不明显;rBD-2则在造模后第1、3天明显增加,差异有统计学意义,第7天渐回复到正常水平。结论在大鼠,rBD-1可能参与正常咽鼓管鼓室的防御功能,造模后rBD-2的表达增加可能与病原体入侵后的清除相关。
β-防御素;分泌性中耳炎;大鼠
分泌性中耳炎(otitis media with effusion,OME)是小儿耳鼻咽喉科的常见病,亦是导致儿童传导性耳聋的最常见原因。OME发病与细菌等病原体入侵,咽鼓管功能障碍,固有免疫及适应性免疫反应等因素相关,确切发病机制至今未完全阐明[1]。
β-防御素属于固有免疫抗微生物肽(antimicrobial peptides,APs),是一类富含半胱氨酸的小分子阳离子多肽,体外实验证实其能够杀伤包括革兰阴性和阳性菌、真菌、带包膜病毒及寄生虫在内的各种病原体[2]。β-防御素各个亚型广泛表达于哺乳动物呼吸道,包括中耳。在大鼠,目前研究较多的β-防御素主要有两种,分别为大鼠β防御素-1(rat β-defensin-1,rBD-1)和大鼠β防御素-2(rat β-defensin-2,rBD-2)。
本实验通过颈部入路听泡内注入脂多糖(lipopolysaccharide,LPS)溶液构建分泌性中耳炎大鼠模型,检测造模前后rBD-1及rBD-2的mRNA表达情况,探讨β-防御素在分泌性中耳炎发病机制中的可能作用。
1 材料和方法
1.1 实验动物
健康清洁级SD大鼠48只,雌性,体质量200~250 g之间,购自复旦大学医学院实验动物中心【SCXK(沪)2007-0002】。实验前所有大鼠在手术显微镜下根据鼓膜表现排除自发性中耳炎,实验期间饲养于复旦大学附属眼耳鼻喉科医院实验动物房,自由饮食。
1.2 造模试剂
LPS(from Escherichia coli 055:B5),产品号: L2880,规格10 mg,购自Sigma中国公司,无菌条件下溶于10 m L生理盐水,每50 μL分装,-30℃冻存。甲苯噻嗪购买自南京法姆化学厂,20 mg溶解于2 m L生理盐水中,过滤除菌后与2 mL(0.1 g)氯胺酮针剂混合成大鼠麻醉药,4℃保存。
1.3 造模过程
首先随机将48只SD大鼠等分为四组,第一组12只大鼠右耳为生理盐水对照组,左耳为空白对照组,另外三组共36只大鼠右耳为造模组。
SD大鼠麻醉采用氯胺酮+甲苯噻嗪(100 mg/ kg+20 mg/kg)混合溶液肌注,右颈前下颌下缘平行切口(图1,彩插6),结扎颈浅静脉(图2,彩插6),钝性分离颈部肌肉(图3,彩插6),暴露右侧听泡(图4,彩插6),用自制细钢针在听泡钻两小孔。造模组共36只大鼠自一孔注入脂多糖溶液30 μL,另一孔用作平衡中耳腔内压力。生理盐水对照组12只大鼠右侧听泡则自一孔注入无菌生理盐水30 μL。注药后骨蜡封闭小孔,表面覆盖肌骨膜瓣,5-0可吸收线间断缝合肌肉,4-0尼龙线缝合皮肤。大鼠自然苏醒后回动物房饲养,自由饮食。造模后第1、3、7天大鼠断头前手术显微镜下观察鼓膜变化以确定造模成功。
1.4 获取咽鼓管鼓室黏膜
SD大鼠麻醉(方法同上)后快速断头,沿中线切开头颅,找到咽鼓管鼻咽口,同时剥离听泡(包括咽鼓管全长),暴露咽鼓管鼓室口,眼科显微器械(经DEPC水处理)在手术显微镜下快速剥离咽鼓管鼓室黏膜,置入冻存管内,投入液氮罐速冻2 h,抽提总RNA前存于-80℃冰箱内。
1.5 RT-PCR过程
1.5.1 TRIzol试剂提取咽鼓管鼓室黏膜总RNA:在瓷研钵(经DEPC水处理)内同时加入液氮和TRIzol,研磨经速冻的咽鼓管鼓室黏膜,取两个黏膜标本同时研磨以保证总RNA质量,TRIzol试剂加入量为2 m L。提取总RNA后行琼脂糖电泳证实其完整性,紫外分光光度计测量RNA含量:A260/A280比值均>1.8。
1.5.2 逆转录过程:取模板RNA 1 μg,Oligo dT 4 μL,加DEPC水至11.5 μL,65℃5 m in后冰浴;再加入5×buffer 4 μL,RNA酶抑制剂0.5 μL,10 mmol/ L dNTP m ix 2 μL,莫洛尼鼠白血病病毒反转录酶(200 U/μL)2 μL,37℃1 h后,70℃10 m in。
1.5.3 引物设计:GeneID(RBD-1):83687,RBD-1正向引物:GACCCTGACTTCACCGACAT,反向引物: CCTGCAACAGTTGGGCTTAT,产物222 bp;GeneID (RBD-1):64389,RBD-2正向引物:CCTCACCAG GCTTCAGTCA,反向引物:AGTCCACAAGTG CCAATCT,产物179 bp;内参为β-actin,正向引物: TTTTGTGCCTTGATAGTTCGC,反向引物:GAGTC CTTCTGACCCATACCC产物:264 bp;引物由上海锐赛生物技术有限公司代为合成。
1.5.4 PCR扩增:扩增体系为10×buffer 2 μL,MgSO4(50 mmol/L)1 μL,dNTP(10 mmol/L,Takara) 1 μL,正向引物(10 μmol/L)1 μL,反向引物(10 μmol/L)1 μL,模板1 μL,Platinum Taq DNA聚合酶(5U/μL)0.2 μL,dd H2O 12.8 μL。循环条件: 94℃、3 m in、1个循环;94℃、30 s,58℃、30 s,68℃、30 s,35个循环;68℃、10 m in、1个循环。
1.5.5 PCR扩增产物半定量:产物经1.8%琼脂糖电泳检测,溴化乙啶染色,紫外灯下观察实验结果,拍照后通过Image J软件对比电泳条带灰度,相对含量为rBD-1、rBD-2条带和内参条带的灰度比值。
1.6 统计学处理
实验数据用均数±标准差表示,正常咽鼓管鼓室黏膜rBD-1和rBD-2之间表达比较采用t检验,造模后rBD各亚型在不同时间点的表达比较采用随机区组方差分析。统计软件为STATA 10.0,P<0.05为差异有统计学意义。
2 结果
2.1 造模结果
所有48只SD大鼠在造模过程中均未因麻醉、手术而死亡。注药后鼓膜均有明显中耳炎症表现,主要征象为鼓膜增厚,由透明变为灰白色或琥珀色;气泡及积液征象在注药后第1、3天较明显,注药后第7天基本消退。
2.2 rBD-1和rBD-2基因表达
正常SD大鼠咽鼓管鼓室黏膜rBD-1 mRNA相对表达量为:0.80±0.07,rBD-2 mRNA相对表达量为:0.22±0.02,两者差异有显著性(P<0.01)(见图5)。造模后第1、3天,rBD-2 mRNA对比造模前表达明显增加,相对表达量为0.84±0.03,0.81± 0.07,差异有显著性(P<0.01),造模后第7天,rBD-2 mRNA(0.30±0.04)基本回复到正常水平; rBD-1 mRNA在造模前后变化不大,差异无统计学意义(见图6)。生理盐水对照组与正常组比较,rBD基因表达无明显差异。

M:DNA标记物图5正常SD大鼠和生理盐水对照组SD大鼠咽鼓管鼓室黏膜rBD-1 mRNA和rBD-2 mRNA的表达M:DNA markerFig.5 Expression of rBD-1 mRNA and rBD-2 mRNA in the tubotympanum mucosa of rats in the normal group and saline control group
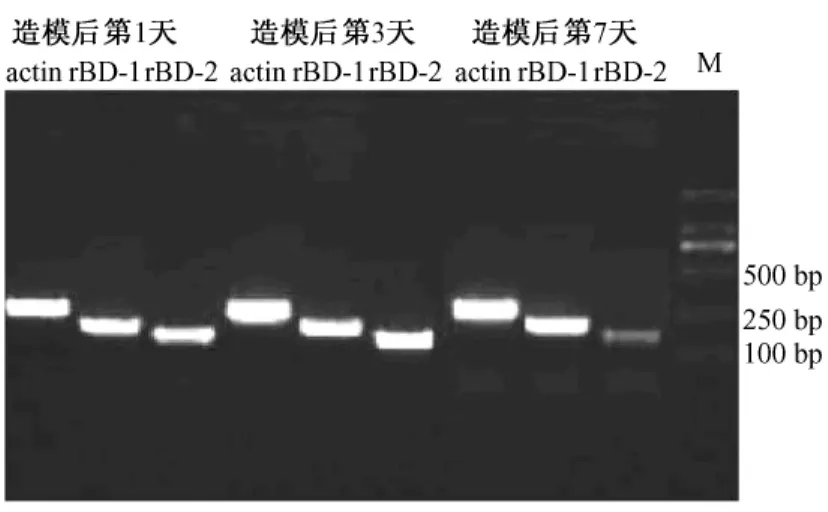
M:DNA标记物图6造模后第1、3、7天SD大鼠咽鼓管鼓室黏膜rBD-1 mRNA和rBD-2 mRNA的表达M:DNA markerFig.6 Expression of rBD-1 mRNA and rBD-2 mRNA in the tubotympanum mucosa of rats with otitis media with effusion at 1-,3-and 7-day after LPS injection
3 讨论
2001年Lim等[1]指出中耳炎的发病有三个必要条件:细菌等病原体附着于鼻咽部;病原体通过咽鼓管进入中耳腔;中耳上皮的物理和固有免疫防御屏障出现结构和功能紊乱。中耳上皮(包括咽鼓管)的生理稳态部分由粘蛋白、水通道蛋白、表面活性物质及一些抗微生物分子来维持,与OME发病相关的抗微生物分子主要包括β防御素,乳铁蛋白,溶菌酶等几种。
β防御素广泛表达于哺乳动物呼吸消化道、泌尿生殖道黏膜上皮,其不同亚型呈现2种表达方式:构成性表达(constitutive expression)和诱导性表达(inductive expression)。所谓构成性表达即表达较为恒定,一些诱导因素如病原体刺激等不能导致其表达增加;诱导性表达则表现为β防御素在病原体等诱导因素刺激下出现表达或表达上调。在人类和小鼠,β防御素-1一般呈构成性表达,β防御素-2、3等亚型则呈诱导性表达[3]。以往的研究表明,rBD的表达模式和人类及小鼠有所不同,1999年国外学者[4]首次在大鼠鉴定出两种β防御素,即rBD-1和rBD-2,并发现其表达呈组织特异性。在大鼠肾脏主要是rBD-1的表达;在大鼠肺,rBD-1主要在支气管上皮表达,rBD-2则主要在肺泡II型细胞表达。这种与其他哺乳动物表达方式上的差异可能是由于rBD-2在第2、3半胱氨酸残基之间的氨基酸序列和其他β防御素-2有明显不同造成。2005年Froy等[5]用RT-PCR方法测量rBD在大鼠脑,肾,肺,脾,肝等主要脏器的表达,结果发现rBD-1在肾,肺,脑有表达,rBD-2在肺、脑、肝表达,并认为大鼠适合作为β防御素相关研究的模式动物。在本实验鼓室中,rBD-1 mRNA和rBD-2 mRNA在正常大鼠咽鼓管黏膜均有发现,并且rBD-1的表达强度明显高于rBD-2,这提示在正常大鼠,主要是rBD-1参与正常中耳无菌状态的维持。
脂多糖(lipopolysaccharide,LPS)为革兰阴性菌内毒素的主要成分[6],属于病原体相关分子模式(pathogen-associated molecular patterns,PAMPs),是导致OME发病的重要病原因子。LPS已成为最常用的中耳炎动物模型局部诱导物质,可以在大小鼠、豚鼠等造成较为稳定的中耳炎症。本实验采用与国内李希平[7]报道的相似方法成功构建了OME大鼠模型,炎症持续时间大约7d,rBD-2的表达上调亦在造模后第7天基本回复正常。各种体内体外实验证实LPS可诱导大鼠中耳黏膜多种基因表达上调,如粘蛋白基因等[8],这些基因的表达上调和β防御素一起参与了中耳炎的发病,粘蛋白在LPS诱导下的表达上调被认为与其可固定病原体于β防御素高浓度区域,从而增强β防御素抗菌效力有关[1]。Jin等[9]用肺炎链球菌诱导出小鼠中耳炎模型,造模前,在咽鼓管鼓室只发现小鼠β防御素-1的表达,造模后则发现小鼠β防御素-2、3、4表达上调明显,小鼠β防御素-1表达上调则不显著。国内有学者[10]用免疫组化的方法发现在肺炎链球菌诱导的小鼠中耳炎模型中,造模后小鼠咽鼓管管旁腺体中β防御素-2的表达明显增加,造模后7d表达增加最明显。这与本实验的结果有所不同,本实验中SD大鼠咽鼓管鼓室rBD-2 mRNA在造模后第1、3天明显上调,第7天已基本回复到正常水平,这种差异或许可归结于rBD-2与小鼠β防御素不同的表达方式。
LPS诱导β防御素表达或表达上调被认为大都是通过Toll样受体(toll-like receptors,TLRs)调节。在病原体入侵后,TLR识别病原体表面的PAMPs如LPS,随后激活胞内相关信号通路,最后导致β-防御素表达或者表达上调。另外还存在一些不依赖于TLR的信号通路,相关研究较少[11]。Song等[12]用RT-PCR及Western blot方法证实在大鼠咽鼓管鼓室黏膜有TLR-2及TLR-4的表达,说明rBD-2的表达上调亦可能是通过TLR相关信号通路调节。Kurland等[13]发现大鼠齿龈上皮中rBD-1和rBD-2在放线杆菌刺激下,表达有明显上调,而TLR水平则没有明显变化,故认为rBD在上皮黏膜的调节也可能有其他信号通路存在,这需要进一步的研究证实。
在实验中发现,在正常大鼠咽鼓管鼓室黏膜,存在rBD-1 mRNA的明显表达,造模后无明显表达上调;而在正常咽鼓管鼓室黏膜中微弱表达的rBD-2 mRNA在造模后则表达明显上调。这可能提示: rBD-1在正常中耳上皮无菌状态的维持中起作用,而rBD-2则可能在病原体入侵后起作用,与病原体的清除和后续的适应性免疫系统激活有关。需要结合体外实验进一步研究rBD表达调节的具体信号通路及其和粘蛋白、水通道蛋白及其他抗菌分子的相互作用。
(本文图1~4见彩插6。)
[1]Lim DJ,Chun YM,Lee HY,et al.Cell biology of tubotympanum in relation to pathogenesis of otitis media–a review[J].Vaccine,2000,19(Suppl 1):S17-25.
[2]Ganz T.Defensins:antimicrobial peptides of innate immunity[J].Nat Rev Immunol,2003,3(9):710-720.
[3]Lehrer RI,Ganz T.Defensins of vertebrate animals[J].Curr Opin Immunol,2002,14(1):96-102.
[4]Jia HP,Mills JN,Barahmand-Pour F,et al.Molecular cloning and characterization of rat genes encoding homologues of human beta-defensins[J].Infect Immun,1999,67(9):4827-4833.
[5]Froy O,Hananel A,Chapnik N,et al.Differential expression of rat beta-defensins[J].IUBMB Life,2005,57(1):41-43.
[6]郭萌,李冠民,黄清泉.细菌内毒素研究进展[J].中国实验动物学报,2009,17(5):397-401.
[7]李希平,牟文清,赵守琴,等.内毒素诱导的分泌性中耳炎动物模型建立及评价[J].中国耳鼻咽喉头颈外科,2007,14 (8):460-462.
[8]Hunter SE,Singla AK,Prazma J,et al.Mucin production in the middle ear in response to lipopolysaccharides[J].Otolaryngol Head Neck Surg,1999,120(6):884-888.
[9]Jin Shin D,Gan-Undram S,Jin Kim S,et al.Expression of beta-defensins in the tubotympanum of experimental otitis media[J].Acta Otolaryngol,2006,126(10):1040-1045.
[10]郝丽丽,华清泉,吴展元,等.急性中耳炎小鼠咽鼓管管旁腺腺体中β-防御素-2的表达及意义[J].中国眼耳鼻喉科杂志,2006,6(3):143-145.
[11]Froy O.Regulation of mammalian defensin expression by Tolllike receptor-dependent and independent signalling pathways[J].Cell Microbiol,2005,7(10):1387-1397.
[12]Song JJ,Cho JG,Woo JS.Differential expression of toll-like receptors 2 and 4 in rat middle ear[J].Int J Pediatr Otorhinolaryngol,2009,73(6):821-824.
[13]Kurland AR,Schreiner H,Diamond G..In vivo beta-defensin gene expression in rat gingival epithelium in response to Actinobacillus actinomycetemcomitans infection[J].J Periodontal Res,2006,41(6):567-572.
Exp ression of β-Defensin in the Tubotym panum in the Rat M odel of O titis M edia w ith Effusion
FAN Chun-sun,HUANG Yi-bo,LI Wen,SHU Yi-lai,SHEN Yan
(ENT Department of EENT Hospital,Fuday University,Shanghai 200031,China)
ObjectiveTo compare the expression of β-defensin in normal rat tubotympanum mucosa with that in the rat model of otitis media(OME)with effusion induced by lipopolysaccharide(LPS),and to clarify the role of innate antimicrobial peptides in the pathogenesis of this disease.M ethods A total of 48 Sprague-Dawley rats(200-250 g),free of middle ear infection,were used in the current experiment.The bulla was exposed by neck approach.30 μL LPS solution (1 mg/m L)was injected into the right bulla in 36 rats,30 μL physiological saline was injected into the right bulla in another 12 rats(control group),the left bulla was intact to be normal group.The tubotympanum mucosa was obtained quickly after decapitation in 12 rats of the control group and 36 rats inoculated by LPS at 1,3,7 days(12 rats in each sub-group).Reverse transcription polymerase chain reaction(RT-PCR)was performed to detect the expression of rBD1 mRNA and rBD2 mRNA.ResultsBoth rBD-1 and rBD-2 mRNA were detected in normal rat tubotympanum mucosa and the expression of rBD-1 mRNA was significantly higher than rBD-2(P<0.01).rBD-2 mRNA increased dramatically in the inflammatory mucosa(P<0.01)whereas rBD-1 mRNA did not show significant augmentation.The up-regulation of rBD-2 gene was notable in the 1-and 3-day groups and declined to normal in the 7-day group.ConlusionOur findings indicate that rBD-1 may be a part of defense system in the normal rat middle ear,and the induced expression of rBD-2 is related to the clearance of invading pathogens.
β-defensin;Otitis media with effusion;Rat
R764.21
A
1005-4847(2010)04-0322-04
2010-01-15
樊春笋(1979-),男,在读硕士,研究方向:小儿耳鼻咽喉科学。
沈雁,主任医师,副教授,E-mail:drshenyan@139.com
