实验动物CAR杆菌16SrRNA基因PCR监测方法的建立
2010-09-09范薇隋丽华刘大伟赵爽张慧洋赵源汪舟佳刘永梅
范薇,隋丽华,刘大伟,赵爽,张慧洋,赵源,汪舟佳,刘永梅
(1.军事医学科学院实验动物中心,北京 100071;2.四川农业大学动物医学院禽病防治研究中心,雅安 625014; 3.军事医学科学院疾病预防控制所,北京 100071)
研究报告
实验动物CAR杆菌16SrRNA基因PCR监测方法的建立
范薇1,2,隋丽华1,刘大伟3,赵爽1,张慧洋1,赵源1,汪舟佳3,刘永梅1
(1.军事医学科学院实验动物中心,北京 100071;2.四川农业大学动物医学院禽病防治研究中心,雅安 625014; 3.军事医学科学院疾病预防控制所,北京 100071)
目的建立CAR杆菌的PCR监测方法,筛查国内部分实验动物样本中CAR杆菌携带状况。方法利用CAR杆菌的特有16SrRNA基因序列片段267bp设计引物,通过从日本实验动物中央研究所获取的CAR标准株DNA,建立实验动物CAR杆菌16SrRNA基因PCR监测方法。结果利用建立的CAR杆菌16SrRNA基因PCR监测方法对国内455份实验动物样本进行筛查,未检出CAR杆菌感染。结论建立了敏感性好,特异性高的实验动物CAR杆菌PCR监测方法,未见动物携带CAR杆菌。
实验动物;CAR杆菌;16S rRNA;PCR
CAR杆菌(cilia-associated respiratory bacillus)是目前尚未分类的、一种实验啮齿类和兔类的呼吸道感染细菌。“CAR”由Ganaway1985年首次提出并使用,因该细菌未被分类鉴定并命名,所以一直沿用至今[1]。近年来各种呼吸道疾病的暴发,人们开始对各种呼吸道传染性疾病病原的相关研究给予足够的重视,各种实验动物被用于呼吸道疾病,特别是传染性疾病的模型研究之中。CAR杆菌可以导致无症状的慢性呼吸道疾病,严重影响用于呼吸道相关疾病研究的动物实验结果。欧美许多国家和企业都将其列为实验动物必需排除的病原菌之一。目前我国尚未将CAR杆菌列为实验动物必需检测的项目,对该菌的研究处于一个基本空白的状态,缺乏病原学、流行病学的相关资料以及有效的检测方法[2]。
为了解我国CAR杆菌流行情况,建立相关的快速检测方法,本研究拟利用CAR杆菌特有的16SrRNA基因序列片段,建立CAR杆菌的PCR监测方法,并对国内455份实验动物标本进行了筛查,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 标准菌株:阳性对照CAR杆菌小鼠株DNACARM由日本实验动物中央研究所伊藤丰志雄教授惠赠。E.coli DH5α由本室保存,pGEM-T克隆载体为Promega公司产品。
1.1.2 工具酶、试剂和抗体:各种限制性内切酶、PCR试剂为TaKaRa公司(大连宝生生物工程有限公司)产品;T4DNA连接酶、质粒提取试剂盒为Promega公司(美国)产品;DNA提取试剂盒、DNA片段纯化回收试剂盒为Qiagen公司(德国)产品。
1.1.3 引物设计:针对CAR杆菌保守的特有16SrRNA基因序列片段267 bp设计了两条引物: P1:5′-TTA AAG CTC CGG CGC TCG AAG-3′;P2:5′-ACA CCC TTA GAA AAG GGG ATT-3′。
1.1.4 实验动物:①北京市内多家实验动物生产厂家(均持有北京市实验动物生产许可证)提供的清洁级、SPF级大鼠200只,体质量180~220 g;清洁级、SPF级小鼠200只,体质量18~22 g,来源同上。②小型猪25只,由中国农业科学院北京畜牧兽医研究所[SYXK(京)2008-0007]提供,均为3~6月龄,雄性15只,雌性10只。其中五指山小型猪为近交系动物,饲养于屏障环境5只,饲养于普通环境5只;广西巴马小型猪为封闭群动物,饲养于屏障环境5只,饲养于普通环境5只;贵州小型猪为封闭群动物,饲养于普通环境5只。③恒河猴30只,军事医学科学院实验动物中心提供【SCXK-(军)2007-004】。为患病安乐死的动物,雌性14只,雄性16只,年龄在6月龄~2岁之间。
1.1.5 样本采集:无菌打开动物胸腔,取气管与肺相连的一段组织,-70℃冻存备用。
1.2 方法
1.2.1 样品DNA制备:将肺组织快速解冻,用玻璃匀浆器将组织用PBS进行匀浆处理,用Qiagen组织DNA提取试剂盒提取DNA,用于PCR扩增。
1.2.2 PCR扩增:以提取的DNA为模板进行PCR扩增,PCR反应体系为50 μL。PCR反应参数为: 94℃3 min,94℃30 s,55℃30 s,72℃40 s,35个循环,72℃延伸7m in。取PCR产物进行2%琼脂糖凝胶电泳,电泳电压为85 V。
1.2.3 序列测定:将纯化的DNA片段,直接连接pGEM-T克隆载体,转化感受态E.coli DH5α,铺于含IPTG和X-gal的LB平板上,挑取白色菌落进行PCR及酶切鉴定。阳性克隆使用ABI377全自动测序仪(上海生物工程有限公司)以通用引物(T7,SP6)对插入片段进行序列测定。
1.2.4 DNA提取方法验证:将标准DNA 10 μL加入到已经确认为阴性的组织匀浆中,同时与未加阳性DNA的样本匀浆进行DNA提取后进行PCR扩增。
1.2.5 方法特异性验证:将金黄色葡萄球菌,嗜肺巴斯德杆菌,大肠杆菌,绿脓杆菌常规方法液体培养后,将菌液100℃5min灭活,Qiagen DNA提取试剂盒提取DNA,与标准CAR杆菌DNA同时进行PCR扩增。
1.2.6 方法敏感性验证:分别用阳性对照CAR杆菌DNA 2、1、0.5 μL为模板进行PCR扩增。
1.2.7 临床标本普查:将提取的样品DNA标本按照建立的方法条件进行PCR扩增。
2 结果
2.1 标准DNA样本扩增结果
标准DNA样本可见阳性267 bp条带,见图1。

M:2000 bp DNA marker;1:CAR杆菌。图1 pcr扩增产物电泳图M:2000 bp DNA marker;1:CAR bacillusFig.1 Electrophoretogram of the PCR amplification products
2.2 序列测定结果
经序列测定(图2,彩插7),插入片段与GenBank标准株序列同源性为100%(结果未显示)。
2.3 DNA提取方法验证结果
将标准DNA以同样的方法提取后进行PCR扩增,结果标准DNA经DNA提取步骤后,仍可扩增出267 bp阳性条带,阴性标本未见条带,见图3。
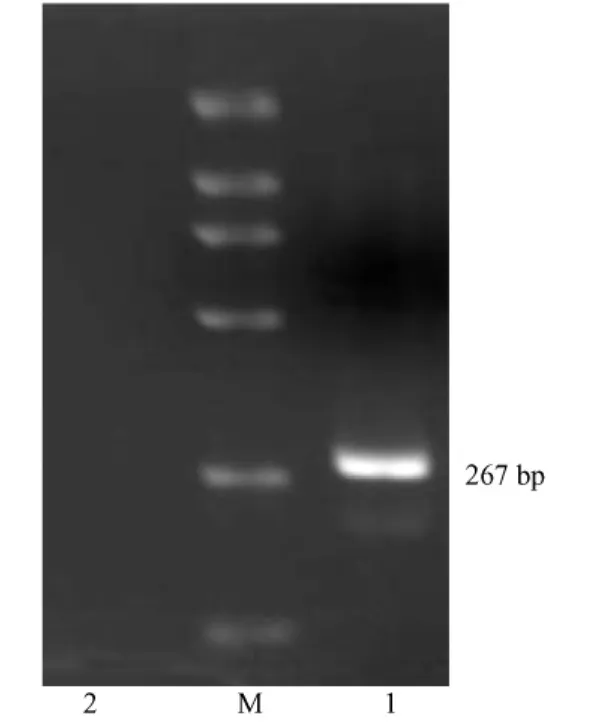
M:2000 bp DNA marker;1:CAR杆菌;2:阴性标本图3 DNA提取方法验证结果M:2000 bp DNA marker;1:CAR bacillus;2: Negative sampleFig.3 Validation of the isolation of CAR bacillus DNA
2.4 方法特异性验证结果
金黄色葡萄球菌、嗜肺巴斯德杆菌、大肠杆菌、绿脓杆菌DNA均未扩增出阳性条带,而CAR杆菌DNA可见阳性条带,见图4。
2.5 方法敏感性验证实验结果
几个不同模板量均可扩增到267 bp的阳性条带,见图5。
2.6 动物样本普查结果
普查实验动物样本455份,未见阳性结果。
3 讨论
对CAR杆菌感染的诊断比较困难,诊断的方法包括血清学方法(ELISA、IFA)、PCR以及免疫组化和组织病理学方法。免疫组化和组织病理学只能在死亡的动物中进行。对组织切片进行显微镜观察是CAR杆菌最特异的诊断方法,在肺组织中确证有该菌存在。确诊的诊断标准是用W-S染色、银染以及免疫组化等方法看到定植的组织切片中的纤丝状细菌[1,3,4]。血清学实验包括ELISA和IFA等是对CAR杆菌感染群进行最初监测一种有效的方法。但是和很多细菌的血清学方法一样,假阳性是不可避免的问题,因而阳性的结果必须使用其他确认病原体方法来验证[5]。

M:1000 bp DNA marker;1:CAR杆菌;2:金黄色葡萄球菌;3:嗜肺巴斯德杆菌;4:大肠杆菌;5:绿脓杆菌图4特异性实验结果M:1000 bp DNA marker;1:CAR bacillus;2: Staphylococcus aureus;3:Pasteurella pneumotropica;4: Escherichia coli;5:Pseudomonas aeruginosaFig.4 Results of specificity test

M:1000 bp DNA marker;1:2 μL模板;2:1 μL模板; 3:0.5 μL模板图5敏感性实验结果M:1000 bp DNA marker;1:2 μL DNA temp late;2:1 μL template;3:0.5 μL DNA temp lateFig.5 Results of sensitivity test
目前常用病原学的检测方法包括两种:细菌分离培养和PCR扩增[6,7]。CAR杆菌不能在无细胞的培养基上生长,体外培养困难,目前国际上认可的方法包括:1985年Ganaway等报道的在鸡胚尿囊膜上增殖培养该菌,1993年Schoeb建立了小鼠BALB/c3T3细胞培养的方法,以及使用SPF动物直接传代的方法。这些方法都极易受到样品中其他细菌的污染,导致培养失败。PCR方法是针对CAR杆菌最迅速的一种诊断方法,可使用鼻拭子和呼吸道组织进行检测。其相对简单的操作方式可以用于日常的常规监测[8]。由于目前我国没有该菌的标准菌株,所以用PCR方法来进行筛查,是可操作性较强的监测方式,一旦确定有阳性后可以进行后续的研究。
细菌核糖体16SRNA(16SrRNA)基因高度保守区为细菌共有,其基因序列的差异显示了细菌种属的差异。细菌核糖体16SRNA(16SrRNA)序列分析技术被广泛应用于细菌的鉴定分型上。其优点在于,该方法不依赖于细菌物的分离培养,是一种非培养分析技术,能够快速鉴定那些目前尚不能人工培养或人工培养较为困难的细菌[9]。因此运用16S rRNA基因PCR方法来进行CAR杆菌检测,可提供一种相对简单和可操作性强的监测方法。
本研究直接使用阳性DNA进行扩增。为了验证普查所得出的阴性结果不是样品DNA在提取过程中受到破坏所致,将标准DNA以同样的方法提取后进行PCR扩增,结果显示仍然能扩增出阳性条带。证明提取DNA的方法不会对结果造成影响。
对所建立的方法进行了特异性和敏感性验证,结果显示特异性较好,其他细菌未扩增出相应条带。敏感性显示,使用0.5 μL标准样品DNA仍可以扩增出阳性条带。
筛查了国内清洁级,SPF级大鼠样本200份,小鼠样本200份,小型猪样本25份,恒河猴样本30份,均未普查到阳性结果,这对评价方法的有效性可能不是一个有力的佐证,但换言之也可能说明我国未有此种细菌感染。作为全国范围内的流行病学调查来看,样本数量还相对较少。另有资料报道,在兔类和其他动物中也发现有此菌的感染[10-12],因此后续的工作中可扩大宿主的种类和进行大量的普查,以获得更加精确的结果。
(本文图2见彩插7。)
[1]Ganaway JR,Spenser TH,Moore TD,et al.Isolation, propagation,and characterization of a new ly recognized pathogen,ccilia-associated respiratory bacillus of rats,an etiological agent of chronic respiratory disease[J].Infect Immune 1985,47(2):472-479.
[2]李红.我国实验动物细菌学质量检测中亟待解决的若干问题[J].中国实验动物学杂志,2002,12(6):364-367.
[3]Schoeb TR,Davidson MK,Davis JK.Pathogenicity of ciliaassociated respiratory bacillus isolated for F344,LEW,and SD rats[J].Vet Pathol.1997,34(4):263-270.
[4]Medina LV,Chladny J,Fortman JD,et al.Rapid way to identify the cilia-associated respiratory bacillus:tracheal mucosal scraping with a modified microwave steiner silver impregnation[J].Lab Anim Sci.1996,46(1):113-115.
[5]Shoji Y,Itoh T,Kagiyama N.Enzyme-linked immunosorbent assay for detection of serum antibody to CAR bacillus[J].Exp Animal.1988,37(1):67-72.
[6]Schoeb TR,Dybvig K,Davidson MK,et al.Cultivation of ciliaassociated respiratory Bacillus in artifical medium and determination of the 16s rRNA gene sequence[J].J Clin Microbiol.1993,31(10):2751-2757.
[7]Cundiff DD,Besch-W illiford CL,Hook RR,et al.Detection of cilia-associated respiratory bacillus by PCR[J]J Clin Microbiol. 1994,32(8):1930-1934.
[8]Kawano A,Nenoi M,Matsushita S,et al.Sequence of 16S rRNA gene of rat-origin cilia-associated respiratory(CAR)bacillus SMR strain[J].J Vet Med Sci.2000,62(7):797-800.
[9]Woo PC,Lau SK,Teng JH,et al.Then and now:Use of 16S rDNA gene sequencing for bacterial identification and discovery of novel bacteria in clinical microbiology laboratories[J].Clin Microbiol Infect,2008,14(10):908-934.
[10]Nietfeld JC,Fickbohm BL,Rogers DG,et al.Isolation of ciliaassociated respiratory(CAR)bacillus from pigs and calves and experimental infection of gnotobiotic pigs and rodents[J].J Vet Diagn Invest.1999,11:252-258.
[11]Bergottini R,Mattielo S,Crippa L,et al.Cilia-associated respiratory(CAR)bacillus infection in adult red deer,chamois,and roe deer[J].J W ildlife Dis.2005,41(2):459-462.
[12]Easterbrook JD,Kaplan JB,Glass GE,et al.A survey of rodentborne pathogens carried by wild-caught norway rats:a potential threat to laboratory rodent colonies[J].Lab Anim,2008,42 (1):92-98.
Estab lishm ent of a PCR Assay for Detection of Cilia-Associated Respiratory Bacillus in Laboratory Anim als Based on 16SrRNA Gene Fragm ent Sequence
FAN Wei1,2,SUI Li-hua1,LIU Da-wei3,ZHA0 Suang1,ZHANG Hui-yang1,ZHAO Yuan1,WANG Zou-jia3,LIU Yong-mei1
(1.Laboratory Animal Center,Academy of Military Medical Sciences,Beijing 100071,China; 2.Research Center of Avian Diseases,College of Veterinary Medicine of Sichuan Agricultural University,Yaan 625014,China; 3.Institute of Disease Control and Prevention,Academy of Military Medical Sciences,Beijing 100071)
Objective To establish a PCR assay for detection of cilia-associated respiratory bacillus,and to identify the infectious status of clinical samples from m ice,rats,mini pigs,rhesus monkeys,etc.M ethods The specific primers were designed according to the 267 bp 16SrRNA gene fragment sequence.Then the PCR assay was established by using DNA copy from Japan.ResultsFour hundred fifty five clinical samples were tested by this established method and no positive CAR bacillus infection was detected.ConlusionThe method established in this study is efficient with high sensitivity and specificity.The infection of CAR bacillus hasn’t been detected in laboratory animals in Beijing up to now.
Cilia-associated respiratory bacillus;16S rRNA;PCR;Laboratory animals
R332
A
1005-4847(2010)04-0308-04
2009-12-14
2004国家科技基础条件平台工作重点项目(课题号2003DIA7J033)。
范薇(1973-),副研究员。目前从事实验动物微生物研究。E-mail:fanwei@bmi.ac.cn
