唐鱼卵黄蛋白原的ELISA检测方法的建立
2010-09-09姚静方展强
姚静,方展强
(华南师范大学生命科学学院,广东省高等学校生态与环境科学重点实验室,广州 510631)
研究报告
唐鱼卵黄蛋白原的ELISA检测方法的建立
姚静,方展强
(华南师范大学生命科学学院,广东省高等学校生态与环境科学重点实验室,广州 510631)
目的探索建立唐鱼卵黄蛋白原的ELISA检测方法。方法以卵黄脂磷蛋白(Lv)抗血清为抗体,以纯化的Lv作为抗原建立间接酶联免疫吸附反应(ELISA)方法检测雄性唐鱼(Tanichthys albonubes)整体匀浆液中的卵黄蛋白原(Vtg)。结果利用ELISA方法测定了经17-β雌二醇(E2)和不同浓度DDTs暴露21 d诱导的雄鱼整体匀浆液中的Vtg含量,可以直接在1块或在不同的酶标板上准确地进行比较。经0.055 mg/m L E2诱导的雄鱼整体匀浆液中Vtg含量为4148.33 μg/g;当暴露DDTs浓度为0.0275、0.0137和0.0067 mg/mL时,雄鱼整体匀浆液中Vtg含量分别为1109.43、911.16和1322.79 μg/g,与丙酮溶剂对照组462.79 μg/g比较差异存在显著性(P<0.05)。结论建立了唐鱼卵黄蛋白原的ELISA检测方法,本方法的检测灵敏度为8.1 ng/m L,批内误差为8.59%,批间误差为6.28%,工作范围为3.26~209.25 ng/mL。在该范围内,标准曲线具有良好的线性和重复性。
卵黄脂磷蛋白;卵黄脂磷蛋白抗血清;酶联免疫吸附反应;唐鱼
环境内分泌干扰物(environmental endocrine disrupting chemicals,EDCs)对人类和野生动物的有害效应已经引起人们的广泛关注。近年来,包括实验室内及野外实验的结果都表明,检测水生动物体内卵黄蛋白原的诱导产生是筛选EDCs以及评价水生动物暴露于其中的潜在风险的有用工具[1]。酶联免疫吸附反应(enzyme-linked immunosorbent assay,ELISA)方法在蛋白质的分析测定中应用十分广泛,该方法用于检测卵黄蛋白原(vitellogenin,Vtg)具有方便易用、灵敏度高又没有同位素污染,受到很多研究者的青睐。是目前最常用的Vtg检测方法[2]。
唐鱼(Tanichthys albonubes)隶属鲤科亚科唐鱼属的一种小型鱼类,生活在广州及珠江三角洲地区。唐鱼在室内人工饲养良好条件下,寿命可达800日龄。目前的一些研究报道,重金属和滴滴涕(DDTs)污染实验显示,唐鱼对污染物敏感,因此可作为生态毒理学研究的理想实验动物[3,4]。本文研究以唐鱼Lv抗血清为抗体,以Lv为抗原及标准品建立间接ELISA方法,并应用该法检测经DDTs暴露处理的雄性唐鱼体内的Vtg含量,探索建立唐鱼卵黄蛋白原的ELISA检测方法。
1 材料与方法
1.1 药品及仪器
17-β雌二醇(E2)(Sigma公司),唐鱼Lv和Lv抗血清(本实验室),丙酮(分析纯),DDTs(美国Supelco公司),酶标仪(BioRed 680),兔抗大鼠IgGHRP(武汉博士德生物工程公司),TMB(MBchem产品),BSA(Roche分装),其他试剂均为分析纯。丙酮用作E2和DDTs的助溶剂,并用于溶剂对照实验;DDTs用丙酮配制成0.22 mg/m L的母液,使用时根据实验所需浓度进行稀释;E2用于阳性对照实验,用丙酮配制成1 mg/m L的母液,使用时根据实验所需浓度稀释。
间接ELISA试剂及配制如下:①包被缓冲液(pH 9.6,0.05 mol/L碳酸盐缓冲液):Na2CO31.59 g,NaHCO32.93 g,加蒸馏水定容至1000 m L。②洗涤缓冲液(pH 7.4,0.15 mol/L PBST):KH2PO40.2 g,Na2HPO42.9 g,NaCl 8.0 g,KCl 0.2 g,Tween-20 (0.05%)0.5 mL,加蒸馏水定容至1000 m L。③封闭液(1%BSA):BSA 0.1 g,加蒸馏水定容至10 m L。④终止液(2 mol/L H2SO4):蒸馏水178.3 m L,逐滴加入浓硫酸(98%)21.7 m L。
1.2 实验动物
实验用唐鱼(T.albonubes)取自本学院生态毒理学实验室培育的鱼种,在室内装有水循环系统的水族缸内培养并进行人工繁殖至第3代,取5月龄性成熟的成鱼个体[体重(0.27±0.04)g;体长(3.29±0.17)cm]进行实验。
1.3 实验方法
1.3.1 诱导实验:实验用水为充分曝气24 h的自来水,水温(26±1)℃,pH(6.8~7.2),硬度约2.4度(德国度)。实验采用静水法,在5000 m L烧杯中进行,每烧杯加入1500 m L实验液,各放入雄性唐鱼5尾,实验鱼体重(0.27±0.04)g;体长(3.29± 0.17)cm。在实验第10天彻底清换实验液一次,实验期间不喂食,自然光照,温度条件不设控制,每天定时记录水温。实验设置丙酮溶剂对照组(0.25 m l/L);E2阳性对照组(0.055 mg/m L)。参照唐鱼仔鱼的48 h半致死浓度0.049 mg/L[4],设置DDTs暴露组:0.0550、0.0275、0.0137和0.0067 mg/mL。每组作3缸平行,共15尾。暴露开始第21天采集鱼样,称量体重、体长后,制作整体匀浆液用作ELISA检测。
1.3.2 间接ELISA方法:操作步骤包括:①包被。用包被缓冲液将提纯的唐鱼Lv稀释成不同质量浓度,往酶标板的每个孔中加入100 μL的Lv液,用微量振荡器振荡30 s以使Lv均匀分布,4℃过夜。②洗涤。取出酶标板,弃去包被液,用洗涤缓冲液洗涤,每个孔加入280 μL的洗涤缓冲液PBST,3 min后将PBST倾倒,重复洗涤3次,洗后拍干。③封闭。在酶标板上每孔加100 μL的1%BSA封闭液,37℃培养1 h后,洗涤3次。④洗板。倾倒封闭液,再按②的操作洗涤3次。⑤一抗。加入1∶500 Lv抗血清,每孔加入100 μL,37℃培养1 h。⑥洗板。倾倒Lv抗血清后,洗涤3次。⑦二抗。加入1∶1000酶标二抗兔抗大鼠IGg-HRP:每孔加入100 μL,37℃培养1 h。⑧洗板。倾倒二抗液体,再按②的操作洗涤3次。⑨显色。在每孔中加入TMB底物100 μL,室温避光静置30 m in后,每孔中加入50 μL终止液终止显色。⑩在酶标仪上测定450 nm波长下的各孔A值。
1.3.3 抗血清和包被抗原最佳工作浓度筛选:抗血清和包被抗原最佳工作浓度筛选用棋盘滴定法测定[5]。Lv按不同的倍比浓度稀释横向包被酶标板,按1.3.2节间接ELISA测定方法将不同浓度的抗血清横向逐孔加入。在酶标仪上读出各孔A450值,比较A450值,将A450值在1.0左右的抗原抗体组合进一步做标准曲线,从而确定抗原最适包被浓度和血清的稀释度。
1.3.4 标准曲线的制作:标准曲线的制作按间接ELISA方法进行,Lv倍比稀释成一系列浓度后包被酶标板;4℃孵育过夜,阴性对照不包被Lv,直接加入包被液;Lv抗血清的浓度应为最佳工作浓度;兔抗大鼠IGg-HRP的浓度为1∶1000。
1.3.5 样品ρ(Vtg)的检测:用包被液将受试唐鱼整体匀浆液稀释至合适浓度进行包被,按以上建立的间接ELISA方法进行Vtg的定量分析。如果所检测样品中Vtg的含量超出了ELISA标准曲线的范围时,则需先稀释一定的倍数使之处于检测范围后再检测,稀释倍数依唐鱼匀浆液样品中Vtg的含量而不同。
2 结果
2.1 抗血清和包被抗原最佳工作浓度确定
对最适工作浓度评判的标准为阳性孔的A450值约为1,阴性对照孔的A450值小于0.1,而抗原抗体浓度最低即为最适工作浓度。棋盘滴定的结果见表1。对表中的数据进行分析,将A450值在1.0左右的抗原、抗体组合进行比较后,选择Lv抗血清的稀释度为1∶1600、1∶3200及其中间值1∶2500等3个浓度再进一步确定最佳的抗体浓度和标准曲线的范围。Lv按837、418.5、209.25、104.62、52.31、26.15、13.07、6.53、3.26、1.63和0.81 ng/m L等11个倍比稀释后浓度包被酶板,每个抗血清浓度在同一酶标板上做3个重复。当抗体浓度为1∶3200时,209.25 ng/m L与3.26 ng/m L之间曲线的灵敏度和检测范围较好,因此在ELISA检测中采用1∶3200的抗体浓度。
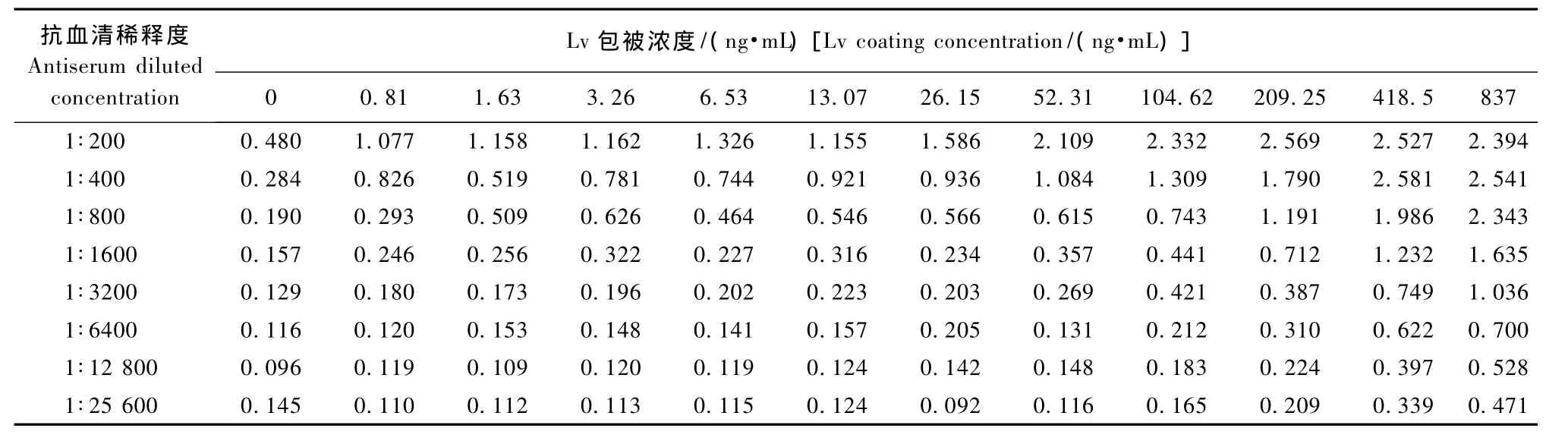
表1 Lv与Lv抗血清棋盘滴定结果Tab.1 Results of the checkerboard titration of Lv and Lv antiserum
2.2 Lv标准曲线的制作
以1∶3200为抗血清稀释度,抗原包被浓度为209.25、104.62、52.31、26.15、13.07、6.53和3.26 ng/m L,按间接ELISA方法进行测定。以A450值为横坐标,以标准Lv浓度为纵坐标,用Microsoft Excel软件作线性回归图(图1),得到一条回归直线,回归方程为y=705.29x-35.275,相关系数R2=0.999。
2.3 测定唐鱼Vtg的间接ELISA方法的质量控制
2.3.1 方法的灵敏度:指该方法能检测出的待测抗原的最低量,即最小检出量。以相当于阴性对照孔A450值2倍时的抗原浓度作为最小检出量。从表2可知,当Lv浓度达8.1 ng/m L时,其A450值与0 ng/ m L时的A450值出现明显差异,P/N>2.1,故检出限为8.1 ng/m L。因此得到该方法的灵敏度为8.1 ng/m L。
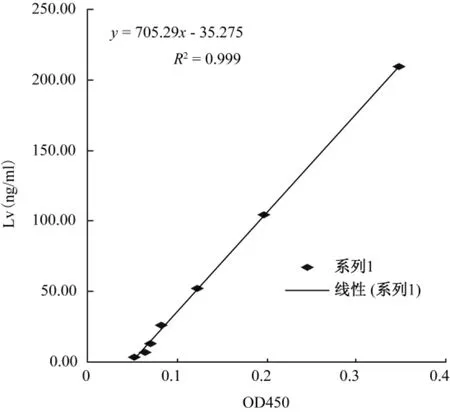
图1 1∶3200稀释抗血清ELISA标准曲线Fig.1 The calibration curve of the ELISA for the anti-Lv serum at 1∶3200 dilution
2.3.2 方法的精确度:该方法以批内误差和批间误差来表示精确度。以标准曲线的批内变异系数表示批内误差,变异系数CV=(SD/平均值)×100%。表3的结果显示,各质量浓度的批内变异系数为1.408%~21.538%,平均为8.591%。批间误差以批间变异系数表示,同一样品在不同时间分3批进行检测,批间变异系数为0.872%~14.893%,平均为6.279%。批内误差和批间误差均小于10%,基本达到ELISA方法的质量控制要求。表明该方法在3.26~209.25 ng/m L范围内具有良好的线性和重复性。
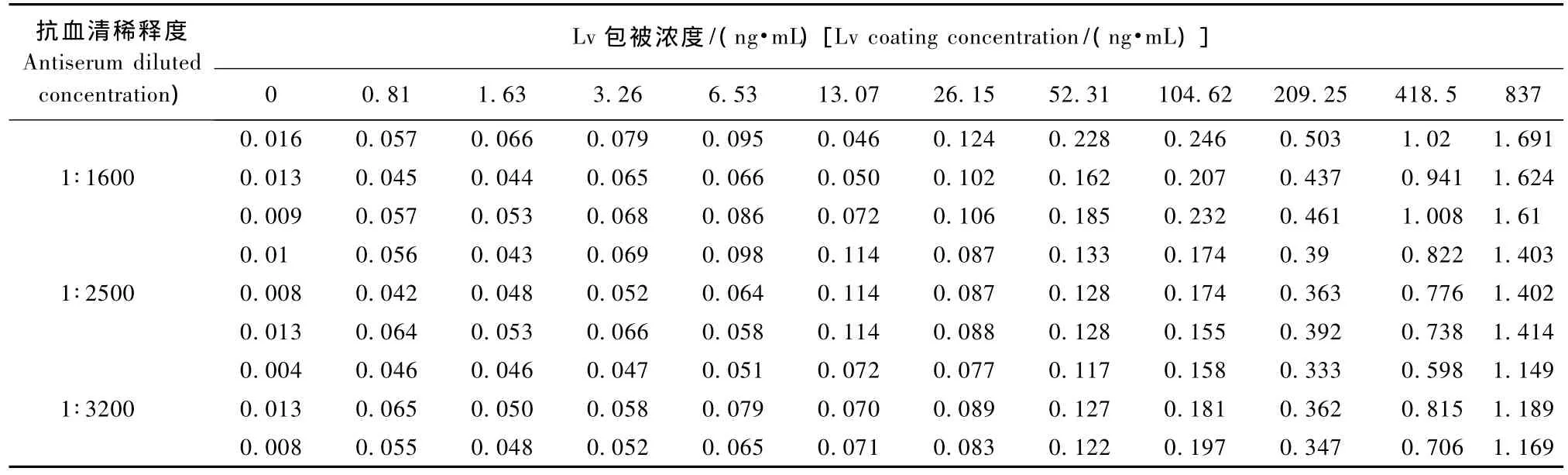
表2 不同抗血清稀释度下的Lv的浓度范围及抗体浓度的筛选结果Tab.2 Range of different anti-Lv serum diluted concentrations and the screened results of antibody concentrations
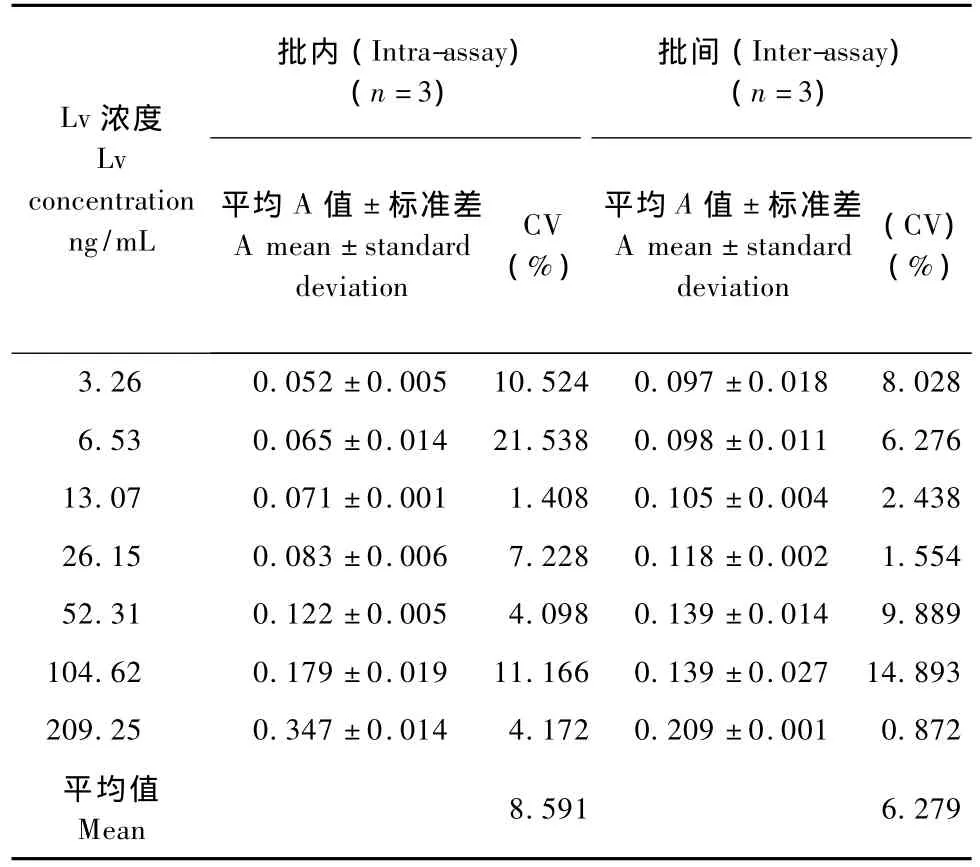
表3 间接ELISA标准曲线批内和批间误差Tab.3 The intra-assay and inter-assay variability of the indirect ELISA calibration curves
2.4 样品的检测
采用上述建立的间接ELISA方法检测了丙酮溶剂对照组、E2阳性对照组和DDTs暴露组各实验组唐鱼整体匀浆液样品中的Vtg含量。其结果如表4所示。与丙酮溶剂对照组相比,E20.0550 mg/m L阳性对照组的Vtg含量比溶剂对照组的高达将近9倍,表明了E2阳性对照组的有效性。除了DDTs 0.055 mg/m L组之外,在低于LD50的浓度下,DDTs 0.0275 mg/m L,0.0137 mg/m L和0.0067 mg/m L等3个DDTs暴露组唐鱼的Vtg含量都有明显的增加,与丙酮溶剂对照组比较差异均具有显著性(P<0.05),表明DDTs具有的类雌激素效应,但是各组数据之间未呈现明显的剂量-效应关系。
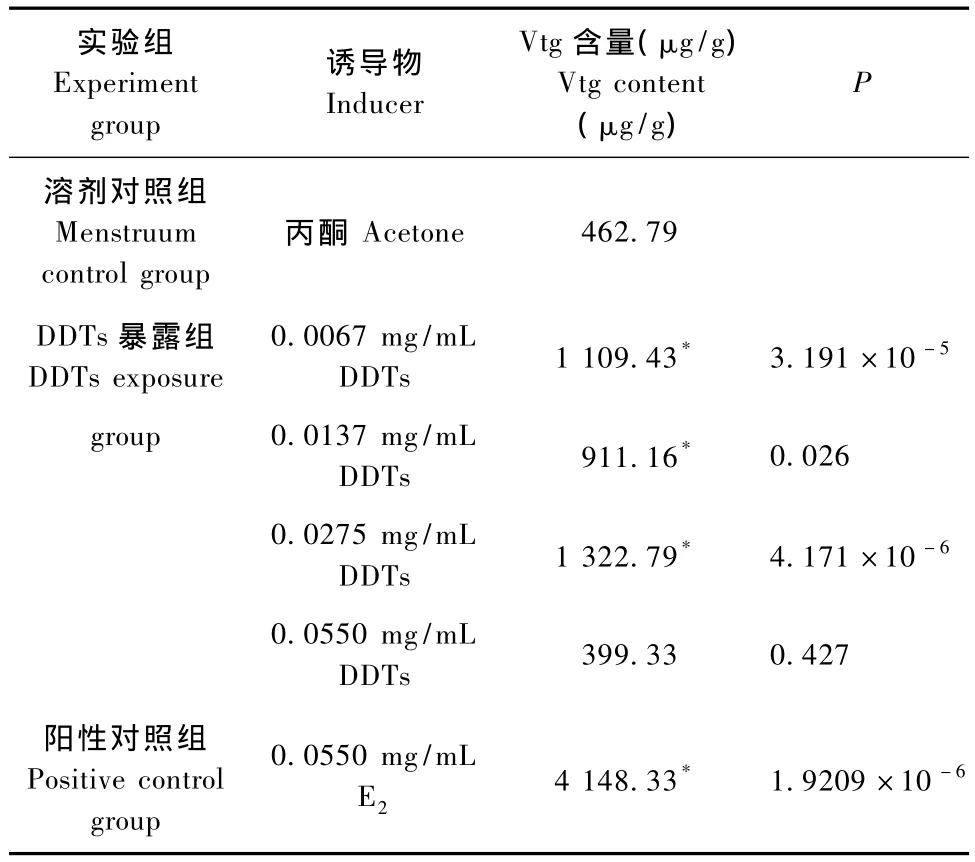
表4 ELISA方法检测经DDTs和E2诱导唐鱼的整体匀浆液中的Vtg结果Tab.4 The results of ELISA detection of the amount of Vtg in the whole fish homogenate of 17-β estradiol-and DDTstreated male T.albonubes for 21 days
3 讨论
鱼类血清中Vtg的定量测定方法有多种。酶联免疫吸附法(ELISA)因其具有特异性强、灵敏度高、操作方便、快速等优点而受到广泛应用。目前已有大西洋鲑(Salmo salar)、虹鳟(Oncorhynchus mykiss)和剑尾鱼(Xiphophorus helleri)等鱼种用该方法建立了Vtg的ELISA检测方法[6-9]。Lv是由Vtg在卵巢中经过加工而形成的天然降解产物,免疫印迹结果显示,在自然状态下,Lv抗血清与Vtg有良好的交叉反应。已经证明剑尾鱼的Lv抗血清与Vtg有良好的交叉反应,而且,Lv在卵中有很高的含量,比Vtg更容易获得[10]。因此可以用Lv代替Vtg作为ELISA的标准品,用Lv抗血清代替Vtg抗体,建立ELISA方法。最近的研究结果显示,天然状态下唐鱼的Lv及其大分子亚基抗血清都能和Lv及Vtg发生特异性交叉反应。这表明除了天然状态下的Lv之外,其大分子亚基和Vtg同样具有相同的免疫原性。并且在纯化过程中,Lv的大分子亚基稳定性高于天然状态下的Lv。因此,以Lv的大分子亚基代替Vtg作为抗原,对Vtg进行检测,是可行的[11]。本研究中以Lv作为抗原和标准物建立Vtg检测的间接ELISA方法,包括抗原最佳工作浓度筛选、ELISA标准曲线绘制等。实验结果表明,所建立的间接竞争ELISA检测浓度为3.26~209.25 ng/m L,灵敏度为8.1 ng/mL,经多次实验反复验证,批内误差为8.59%,批间误差为6.28%,均小于10%,与其他研究者的报道相近[12],符合ELISA实验方法的要求。说明在此范围内,标准曲线具有良好的线性和重复性。这一发现对目前的生态毒理学研究是十分有意义的。对于小型实验鱼类来说,由于其血量少,采集困难,所以难以从中提取Vtg用作免疫分析。Lv是鱼卵中的主要蛋白质,并且可以较容易地从卵巢中获取足够的量。因此,以Lv或Lv大分子亚基代替Vtg作为抗原,除了可以解决难以大量获取的问题以外,还能克服Vtg极易降解的难题。
本实验应用间接ELISA方法分析经不同浓度DDTs处理过的雄性唐鱼体内的Vtg含量,结果表明,在DDTs浓度0.0067~0.0275 mg/m L的暴露组中,雄性唐鱼体内的Vtg含量有不同程度的明显增加。虽然有些报道认为DDTs并不与鱼类的雌激素受体发生竞争性结合,但通过重组人类雌激素受体(HER)基因酵母细胞来检测DDTs雌激素活性的研究结果证明,DDTs是一类可直接像配体一样与雌激素受体接合的EDCs,其中o,p′-DDT的雌激素活性最强。本实验的结果支持DDT具有雌激素活性的结论[13]。同时也证明唐鱼对DDTs有一定的敏感性,适合作为监测环境EDCs的标识物。此外,从DDTs对唐鱼诱导所产生的Vtg量与由E2诱导所产生的量作比较表明,DDT具有雌激素性质,但活性相对比较低,推测可能是由雌激素受体介导的。本实验发现,在浓度为0.055 mg/mL DDTs的暴露组中,唐鱼体内的Vtg含量不仅没有明显增加,反而比溶剂对照组略有减少。解释这一现象,初步认为这可能是由于DDTs的浓度已经超过了唐鱼的安全浓度,唐鱼中毒后其肝细胞将受损,蛋白质合成功能受阻,导致鱼体内Vtg含量下降。
[1]Sumpter JP,Jobling S.Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment[J]. EnvironHealth Persp,1995,103:173-178.
[2]Christiansen T,Korsgaard B,Jespersen A.Induction of vitellogenin synthesis by nonylphenol and 17β-estradiol and effects on the testicular structure in the eelpout Zoarces viviparous[J].Marine Environ Res,1998,46:141-144.
[3]温茹淑,方展强,陈庭伟.17β-雌二醇对雄性唐鱼卵黄蛋白原诱导及性腺发育的影响[J].动物学研究,2008,29(1):43-48.
[4]杨志聪,姚静,方展强.DDTs对唐鱼仔鱼的急性毒性及安全浓度评价[J].实验动物与比较医学,2007,27(2):123-126.
[5]李康,周忠良,于静,等.鲫鱼(Carassius auratus)卵黄蛋白原的ELISA检测[J].中国环境科学,2003,23(3):276-280.
[6]Arukwe A,Celius T,Walther BT,et al.Plasma levels of vitellogenin and eggshell zona radiate proteins in 4-nonylphenol and o,p’-DDT treated juvenile Atlantic Salmon(Salmo salar)[J].Marine Environ Res,1998,46:133-136.
[7]Arukwe A,Kullman SW,Hinton DE.Differential biomarker gene and protein expressions in nonylphenol and estradiol-17beta treated juvenile rainbow trout(Oncorhynchus mykiss)[J].Comp Biochem Physiol,2001,129(1):1-10.
[8]温茹淑,方展强,江世贵,等.17β-雌二醇对雄性剑尾鱼卵黄蛋白原的诱导研究[J].中国实验动物学报,2007,15 (4):280-284.
[9]温茹淑,方展强,江世贵,等.剑尾鱼卵黄蛋白原的ELISA检测[J].环境科学研究[J],2007,20(4):142-147.
[10]温茹淑,方展强,江世贵,等.剑尾鱼卵黄脂磷蛋白的纯化及免疫分析[J].水产学报,2007,31(5):198-205.
[11]姚静,方展强,徐杰,等.唐鱼卵黄脂磷蛋白的纯化与免疫原性分析[J].应用与环境生物学报,2008,14(1):69-73.
[12]Lomax DP,Roubal WT,Moore JD,et al.An enzyme-linked immunosorbent assay(ELISA)for measuring vitellogenin in English sole(Pleuronectes vetulus):development,validation and cross-reactivity with other p leuronectids[J].Comp Biochem Physiol,1998,121B(4):425-436.
[13]Leaños-Castañeda O,Van Der Kraak G,et al.O,p′-DDT induction of vitellogenesis and its inhibition by tamoxifen in Nile tilapia(Oreochrom is niloticus)[J].Marine Environ Res,2002,54(3-5):703-707.
Developm ent and App lication of an ELISA Technique for Detecting Tanichthys albonubes Vitellogenin
YAO Jing,FANG Zhan-qiang
(Key Laboratory of Ecology and Environmental Science in Guangdong Higher Education,College of Life Sciences,South China Normal University,Guangzhou 510631,China)
ObjectiveThe aim of this study was to set up an indirect enzyme-linked immunosorbent assay (ELISA)for detecting Tanichthys albonubes vitellogenin.M ethods ELISA was established for detecting Vtg in the whole body homogenate(WBH)of male T.albonubes.The technique was developed with antiserum against lipovitellin(Lv)as antibody and Lv as antigen.Results Adult male T.albonubes was exposed to nominal water(control group),to DDTs at concentrations of 0.0275 mg/m L,0.0137 mg/m L and 0.0067 mg/m L(DDTs exposure groups)and to 17-β estradiol at concentration of 0.0550 mg/mL(E2exposure group)in a static exposure system for 21 days.WBH samples of male fish could be checked in the same one coated well and different coated wells to develop screening of environmental estrogen. Compared with control group(462.79 μg/g),the Vtg concentrations in DDTs exposure groups(1 109.43 μg/g,911.16 μg/g,and 1 322.79 μg/g,respectively)and E2exposure group(4 148.33 μg/g)were significantlyly different(P<0.05).ConlusionAn ELISA assay for detecting T.albonubes vitellogenin has been set up.The working range is 3.26 to 209.25 ng/mL,the sensitivity is 8.1 ng/m L,the intra-assay and inter-assay coefficients of variation are 8.59%and 6.28%,respectively.This technique shows a good linearity and repeatability in standard curves.
lipovitellin;Anti-lipovitellin(Lv)serum;ELISA;Tanichthys albonubes
X171.1
A
1005-4847(2010)03-0242-05
2009-10-22
珠海市科技计划项目(编号:PC20081050)和广东省科技计划项目(编号:2009B030600006)。
姚静(1981-),女,研究方向:水生态毒理学。E-mail:yyspirit@hotmail.com.
方展强。E-mail:fangzhq@scnu.edu.cn.
