PMSG和FSH同期发情处理对小鼠子宫、卵巢和输卵管中雌激素α受体分布的影响
2010-09-09林自力高雅邓桂馨梁鸿斌张鸿波刘云海倪和民郭勇王志刚
林自力,高雅,邓桂馨,梁鸿斌,张鸿波,刘云海,倪和民,郭勇,王志刚
(1.北京农学院动物科学技术系,北京 102206;2.农业部全国畜牧总站,北京 100125)
研究报告
PMSG和FSH同期发情处理对小鼠子宫、卵巢和输卵管中雌激素α受体分布的影响
林自力1,高雅1,邓桂馨1,梁鸿斌1,张鸿波1,刘云海1,倪和民1,郭勇1,王志刚2
(1.北京农学院动物科学技术系,北京 102206;2.农业部全国畜牧总站,北京 100125)
目的从雌激素α受体(estrogen receptor α,ERα)的角度探讨孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)和促卵泡激素(follicle-stimulating hormone,FSH)处理小鼠的卵巢、输卵管和子宫中,ERα分布是否有显著性差异。方法10只8周龄母鼠,随机分为处理方式不同的两个组:PMSG组和FSH组,两组均在处理第48小时取其卵巢、输卵管和子宫样固定,采用免疫组织化学法分别观察组织中ERα分布情况。结果免疫组化结果显示,两个处理组小鼠卵巢、输卵管和子宫内膜的细胞中都有ERα表达;PMSG处理组卵巢中的初级卵泡和成熟卵泡上ERα阳性率和平均吸光度均显著高于FSH处理组;FSH处理组的输卵管中ERα阳性率和平均吸光度均高于PMSG处理组;FSH处理组子宫基质和腺上皮细胞中ERα的阳性率显著高于PMSG组,其中PMSG组基质中的平均吸光度显著高于FSH组,而子宫内膜上皮细胞的阳性率和平均吸光度两处理组间差异无显著性。结论PMSG和FSH同期发情诱导由于其特性可不同程度地影响小鼠卵巢、输卵管和子宫中ERα的分布,使之在不同组织中产生差异性变化。
小鼠;卵巢;输卵管;子宫;雌激素α受体分布
同期发情是胚胎移植、转基因、克隆等研究不可缺少的基本技术环节,同期发情处理可以使哺乳动物受体的子宫处于胚胎着床“接受态”。胚胎发育到特定时期与子宫发生一系列的变化达到容受状态的同步化对于胚胎的植入至关重要[1],此时期与胚胎正常发育、子宫内膜的容受性及适宜的内分泌环境密切相关[2],其中卵巢分泌的雌激素对小鼠的作用很重要[1],雌激素是通过其受体(estrogen receptor,ER)发挥作用的,ER是核受体超家族中的一种配体依赖转录因子[3],与雌激素发生结合引发下游的信号通路,调节生殖生理内环境[4],ER有其亚型,通过选择性缺失研究它们特异性的作用发现: α–/–的子宫发育不全而且不接受植入[5],β–/–的子宫保持生物学功能和正常的植入[6],说明ERα发挥了主要作用[1],因此ERα的分布情况对于了解母体“接受态”具有重要的指导意义。虽已有人通过免疫组化的方法研究了激素处理同期发情小鼠子宫内膜[7]或其他组织[8-10]中ER的分布情况,但多数仅针对发情小鼠子宫内膜上激素受体的分布变化[11],并未全面分析对比卵巢、输卵管和子宫中ERα相对表达量的差异变化。本研究拟从ERα的角度探讨PMSG和FSH同期发情处理后,此类受体在小鼠卵巢、输卵管和子宫内膜上的分布是否存有差异,同时结合ERα的阳性率和平均吸光度变化分析其相应分布是否受内源性激素的特异诱导,以期为研究哺乳动物着床“窗口期”母体的激素信号表达通路提供参考依据。
1 材料与方法
1.1 实验动物及分组
本实验选用ICR系雌性小鼠10只,8周龄,体重28 g左右。购自北京维通利华实验动物科技有限公司【SCXK(京)2002-2003】。将10只母鼠随机分为两个组,每组五只:①PMSG处理组;②FSH处理组。根据PMSG和FSH在小鼠体内的半衰期差异[3],其剂量和间隔时间如下:①PMSG处理组:于实验开始当天腹腔注射PMSG 10 IU/只(注射第1针计为0 h);②FSH处理组:实验当天腹腔注射FSH 10 IU/只(注射第1针计时为0 h);12 h后腹腔注射FSH 10 IU/只;第24 h腹腔注射FSH 5 IU/只;第36 h腹腔注射FSH 5 IU/只。
1.2 实验试剂
兔抗ERα单克隆抗体,购自Epitomics公司,货号:1115-1;抗体稀释液、羊抗兔SABC试剂盒、3,3-二氧基联苯胺(DAB)显色试剂盒购自武汉市博士德生物工程公司;磷酸盐缓冲液(PBS,pH 7.2~7.6)自配。
1.3 实验仪器
倒置显微镜:Olympus公司,BX51;普通光学显微镜:Nikon,YS2-H;石蜡切片机:上海莱卡仪器有限公司,Leica RM 2126RT。
1.4 样本采集
两组小鼠均在PMSG或FSH处理第48小时颈部脱臼处死后取其卵巢、输卵管、子宫,生理盐水冲洗,4%的中性多聚甲醛4℃浸渍固定48~96 h。
1.5 免疫组化SABC法操作程序
①常规石蜡包埋、切片;②组织经40℃水浴展片后,用APES处理的载玻片捞起,40℃过夜烘烤后脱蜡至水,3%H2O2室温60 min以灭活内源性酶,PBS洗3次;③0.01 mol/L的枸橼酸盐缓冲液进行抗原热修复,PBS洗3次;④5%BSA在37℃封闭40 min,甩去多余液体,不洗;⑤滴加兔抗ERα一抗(1∶50),4℃过夜(12~14 h),PBS洗3次;⑥生物素化羊抗兔IgG,37℃孵育1 h,PBS洗4次;⑦滴加SABC 37℃40 m in,PBS洗4次;⑧DAB显色:使用DAB显色试剂盒。取1 m L蒸馏水,依次加试剂盒中B、C、A试剂各50 μL,混匀后滴加至组织。根据显色程度光镜下控制反应时间,蒸馏水洗涤。⑨苏木素复染3~5 s、脱水、透明、封片、显微镜观察。
阴性对照以抗体稀释液代替⑤中的一抗,其余步骤同上。
1.6 图像分析
选取连续5张切片,每张片子随机观察5个视野,取5个视野的胞核阳性表达率(阳性胞核/细胞总胞核)均值,并采用Motic图片分析系统分析其平均吸光度。卵巢根据卵泡的发育水平,分析系统计数各级卵泡免疫组化阳性细胞数量和平均吸光度;输卵管采取整张切片计数;子宫内膜细胞按照子宫腺上皮细胞、子宫内膜上皮细胞和子宫内膜基质细胞三种细胞类型分别计数。
1.7 统计方法
实验数据采用DPS数据处理软件单因素方差,Duncan检验分析,数据相关分析结果采用平均数±标准差(mean±SD)表示。P<0.05为差异有显著性。
2 结果与分析
2.1 经PM SG或FSH处理的小鼠子宫、卵巢、输卵管中ERα的表达分布
免疫组化染色阳性切片背景经苏木素复染为淡蓝色,ERα免疫反应的细胞为棕黄色;阴性对照组切片为淡蓝色,无棕黄色染色,说明免疫组化SABC法具有ERα免疫反应的特异性(图1,彩插5)。
2.2 PM SG和FSH处理的小鼠其ERα在卵巢、输卵管和子宫内膜中的定位与表达差异
经PMSG处理组的卵巢其初级卵泡和成熟卵泡的中ERα胞核的阳性率显著高于FSH处理组(P<0.05),但在原始卵泡和次级卵泡中差异无显著性(P>0.05),PMSG处理组初级卵泡、次级卵泡和成熟卵泡的平均吸光度均显著高于FSH处理组(P<0.05);输卵管中FSH处理组的阳性率(0.154± 0.06)和平均吸光度(0.664±0.11)均显著高于PMSG处理组的阳性率(0.100±0.04)和平均吸光度(0.418±0.08)(P<0.05);FSH处理组的子宫基质和腺体的阳性率显著高于PMSG处理组(P<0.05),而FSH处理组基质中ERα的平均吸光度显著高于PMSG组(P<0.05)。(表1、表2)。
表1 两个处理组卵巢中各级卵泡的ERα胞核阳性率和平均吸光度的变化(±s)Tab.1 The expression intensity and average optical density of ERα in the ovarian follicles(±s)
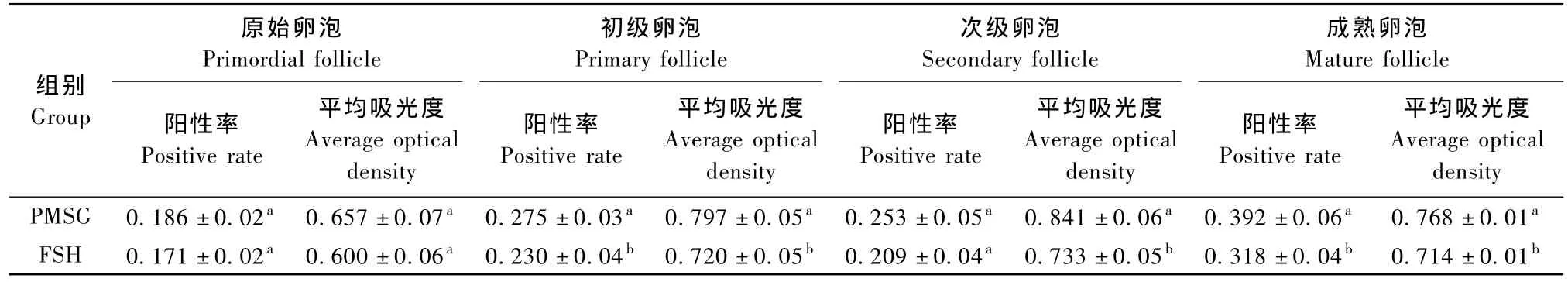
表1 两个处理组卵巢中各级卵泡的ERα胞核阳性率和平均吸光度的变化(±s)Tab.1 The expression intensity and average optical density of ERα in the ovarian follicles(±s)
注:上标相同字母表示差异无显著性(P>0.05),字母不相同表示差异有显著性(P<0.05)。Note:The same letters indicate no significant differences among them(P>0.05),the different letters indicate a significant difference among them(P<0.05).
组别Group原始卵泡Primordial follicle初级卵泡Primary follicle次级卵泡Secondary follicle成熟卵泡Mature follicle阳性率Positive rate平均吸光度Average optical density阳性率Positive rate平均吸光度Average optical density阳性率Positive rate平均吸光度Average optical density阳性率Positive rate平均吸光度Average optical density PMSG 0.186±0.02a0.657±0.07a0.275±0.03a0.797±0.05a0.253±0.05a0.841±0.06a0.392±0.06a0.768±0.01aFSH 0.171±0.02a0.600±0.06a0.230±0.04b0.720±0.05b0.209±0.04a0.733±0.05b0.318±0.04b0.714±0.01b
表2 两个处理组子宫基质、内膜上皮、腺上皮的ERα胞核阳性率和平均吸光度的变化(±s)Tab.2 The expression intensity and average optical of ERα in the endometrial stroma,luminal epithelium and glandular epithelium of mouse uterus(±s)
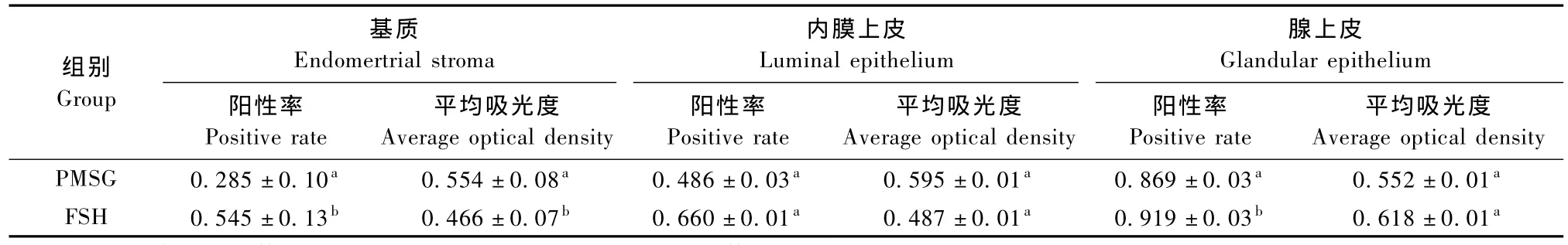
表2 两个处理组子宫基质、内膜上皮、腺上皮的ERα胞核阳性率和平均吸光度的变化(±s)Tab.2 The expression intensity and average optical of ERα in the endometrial stroma,luminal epithelium and glandular epithelium of mouse uterus(±s)
注:上标相同字母表示差异无显著性(P>0.05),字母不相同表示差异有显著性(P<0.05)。Note:The same letters indicate no significant differences among them(P>0.05),the different letters indicate a significant difference among them(P<0.05).
组别Group基质Endomertrial stroma内膜上皮Lum inal epithelium腺上皮Glandular epithelium阳性率Positive rate平均吸光度Average optical density阳性率Positive rate平均吸光度Average optical density阳性率Positive rate平均吸光度Average optical density PMSG 0.285±0.10a0.554±0.08a0.486±0.03a0.595±0.01a0.869±0.03a0.552±0.01aFSH 0.545±0.13b0.466±0.07b0.660±0.01a0.487±0.01a0.919±0.03b0.618±0.01a
3 讨论
雌激素(estrogen)是与动物繁殖密切相关的生殖激素。雌激素在雌性动物的不同组织器官都有一定的生理作用:作用于卵巢,可以刺激卵泡发育;在输卵管增生期,上皮细胞的有丝分裂明显增加,纤毛增加,内膜变厚[12];接近排卵时,雌激素可增加输卵管峡部平滑肌的活性,由输卵管平滑肌和纤毛协同作用将受精卵送入子宫腔[13-15];作用于子宫,刺激子宫管状腺长度增加,黏液分泌增加,肌肉层增厚,蠕动增强。子宫在雌激素的作用下可以与孕酮协同作用使子宫处于接受态,这是胚胎植入的重要前提[16]。雌激素是通过其受体ER发挥作用的,雌激素受体未与雌激素结合时,结合热休克蛋白,此时无活性;当遇到雌激素时,ER与热休克蛋白解离,与雌激素结合而产生生理功能[3]。与热休克蛋白结合的雌激素受体不能被检测到,因此对雌激素受体的检测在很大程度上可以反映出雌激素对组织的作用。本实验中两个处理组的卵巢、输卵管和子宫中均有ERα信号相对波动表达,说明同期发情使雌激素产量动态变化,从而调节ERα的表达,这与潘永苗[7]和Halachm i等[17]研究结果一致。由于PMSG半衰期较长(40~125 h),在体内不易被及时清除,残存的PMSG会影响卵泡的成熟和排卵,产生大卵泡并持续分泌雌激素[18],本实验研究表明经PMSG处理组,卵巢中初级卵泡和成熟卵泡ERα的分布均显著高于FSH处理组(P<0.05),其平均吸光度显示PMSG处理组的初级卵泡、次级卵泡和成熟卵泡中信号强度显著高于FSH组(P<0.05),表明这些时期由PMSG诱导的雌激素分泌显著高于由FSH所诱导的分泌结果。由于原始卵泡的活动尚不活跃,其激素的活性波动不大,而初级卵泡、次级卵泡和成熟卵泡中的激素变化可能由于PMSG的长效作用而发生显著的增加。在输卵管中,ERα在FSH组的阳性率显著高于PMSG组(P<0.05),雌激素的分布影响了输送卵母细胞和受精的效率,由于FSH的多次注射有效调节了雌激素的分泌曲线最终调节了ERα的相对分布,可以弥补其半衰期较短的缺陷。子宫中FSH组基质和腺上皮中ERα的表达显著高于PMSG组(P<0.05),而子宫内膜上皮细胞的阳性率两处理组间差异无显著性,由此可以看出:雌激素对子宫腺上皮和间质中的ERα调节反馈更迅速,这与Kuiper[19]和Jonna[20]的结果相同,子宫内膜上皮是与胚胎发生直接联系的部位,它的稳定性尤为重要,如果对体内激素的变化反应过于强烈可能对胚胎产生不利的影响。
在此实验中,PMSG和FSH对小鼠同期发情处理均不同程度影响了其卵巢、输卵管和子宫中的ERα分布,这种影响是由内源性雌激素的变化引起的,与同期发情效果密切相关。PMSG作为长效激素对于卵巢中卵泡的ERα的调节作用更为显著,在用FSH作为小鼠超排药物时,需要多次注射才能维持小鼠的输卵管中ERα的分布。但这两种激素的作用,特别是在其后对受精前卵母细胞的生长和运输,以及受精等关键时期中的作用和探讨对大家畜人工辅助生殖中的潜在影响,尚待进一步的研究。
(本文图1见彩插5。)
[1]Wang HB,Dey SK.Roadmap to embryo implantation:clues from mouse models[J].Nature Reviews Genetics,2006,7:185-199.
[2]李萍.体外受精-胚胎移植中胚胎着床的相关性研究[J].中国计划生育学杂志,2006,8(130):504-506.
[3]杨增明,孙青原,夏国良.生殖生物学[M].北京:科学出版社出版,2005,410.
[4]Schoolcraft W,Lane M,Stevens J,et al.Increased hyaluronan concentration in the embryo transfer medium results in a significant increase in human embryo implantation rate[J].Fertil Steril,2002,14:S5.
[5]Wang Y,Wang F,Sun T,et al.Entire mitogen activated protein kinase(MAPK)pathway is present in preimplantation mouse embryos[J].Dev Dyn,2004,231:72-87.
[6]Dey SK,Lim H,Sanjoy K,et al.Molecular cues to imp lantation[J].Endocr Rev,2004,25:341-373.
[7]潘永苗,石一复.GnRHa超排卵对小鼠子宫内膜形态学和雌、孕激素受体表达的影响[J].生殖与避孕,2002,22.
[8]吴建云,田茂春,王鲜忠,等.雌激素受体α在雌性大鼠脑中的表达[J].中国兽医学报,2009,29(11):1489-1493.
[9]唐成和,杨留才,臧宜平.雌激素相关受体α在胃腺癌中表达及意义[J].山东医药,2009,49(40):64-65.
[10]周智君,俞远京,丁志刚,等.大豆异黄酮对老龄大鼠雌激素水平和子宫雌激素受体表达的影响[J].中国实验动物学报,2009,17(4):288-291.
[11]张鸿波,秦国嵩,刘云海,等.雌激素和孕激素对不同发情方式小鼠子宫内膜中孕激素受体分布的影响[J].中国实验动物学报,2009,17(3):206-209.
[12]徐晨,周作民.生殖生物学理论与实践[M].第一版.上海:上海科学技术文献出版社,2005,171.
[13]戴钟英.异位妊娠的病因、早期诊断和治疗研究的进展[J].中华妇产科杂志,1992,27(6):373-376.
[14]Matthews CP,Coulson PB,W ild RA.Serum progesterone levels as an aid in the diagnosis of ectopic pregnancy[J].Obstet Gynecol,1986,68:390-394.
[15]陆奎春.孕激素受体的研究进展[J],国外医学计划生育分册,1996,15(4):218.
[16]赵兴绪.兽医产科学[M].第三版.北京:中国农业出版社,2002,29.
[17]Halachmi S,Marden E,Martin G,et al.Estrogen receptorassociated proteins:possible mediators of hormone-induced transcription[J].Science,1994,264:1455-1458.
[18]徐晨,周作民.生殖生物学理论与实践[M].上海科学技术文献出版社,2005,171.
[19]Kuiper GG,Carlsson B,Grandien K,et al.Comparison of the ligand binding specificity and transcript tissue distribution of estrogen receptors α and β[J].Endocrinology,1997,138:863-870.
[20]Frasor J,Barnett DH,Danes JM.Response-specific and ligand dose-dependent modulation of estrogen receptor(ER)α activity by ERβ in the uterus[J].Endocrinology,2003,144(7):3159-3166.
Effect of Estrus Synchronization with PMSG and FSH on the Distribution of Estrogen Receptor α in the Mouse Uterus,Ovary and Fallopian Tube
LIN Zi-li1,GAO Ya1,DENG Gui-xin1,LIANG Hong-bin1,ZHANG Hong-bo1,LIU Yun-hai1,NI He-min1,GUO Yong1,WANG Zhi-gang2
(1.Department of Animal Science and Technology,Beijing University of Agriculture,Beijing 102206,China; 2.National Animal Husbandry Service of the Ministry of Agriculture,Beijing 100125)
ObjectiveTo investigate the distribution of estrogen receptor α(ERα)in the ovary,fallopian tube and uterus between the mouse treated by estrus synchronization with PMSG and FSH.MethodsAccording to the different treatments,in total 10 ICR mice were divided into two groups:the PMSG FSH treatment groups.At 48 h after the injection of hormones,the ovaries,oviducts and uterus were taken and fixed in paraformaldehyde.Immunohistochemical staining was used to observe and analyze the distribution of ERα in these tissues.ResultsThe positively stained cell number and average optical density in the primary ovarian follicles and matured follicles of the PMSG treatment group were significantly higher than those of the FSH one(P<0.05).The positively stained cell number and average optical density in the oviduct of the FSH treatment group was significantly higher than those of the PMSG one(P<0.05).In the uterine stroma and glandular epithelium,the positively stained cell number of the FSH treatment group was significantly higher than that in thePMSG group(P<0.05),but the positive rate and average optical density between two treatment groups was not significantly different(P>0.05).ConlusionPMSG and FSH may affect on the distribution of ERα in mouse ovary,oviduct and uterus to a varying degree,and lead to a differential ERα expression in those tissues.
Mouse;Ovary;Oviduct,Uterus;Distribution of estrogen receptor α
R321-33
A
1005-4847(2010)03-0204-04
2010-2-24
2009年度北京市自然基金重点项目“胚胎滋养层干细胞的功能性分析”(项目批准号:5091002);国家“十一五“863计划”重点项目“家畜卵泡高效诱导发育技术研究与应用”(项目批准号:2008AA101003);国家“十一五科技支撑计划”项目“肉羊高效育种关键技术的研究与应用”(项目批准号:2008BADB2B04-4)。
林自力(1984-),女,在读硕士研究生,研究方向:动物产科及胚胎工程,E-mail:talzl@163.com
王志刚,男,研究员;研究方向:动物遗传育种,E-mail:talzl@163.cn
