汞对中国林蛙蝌蚪的毒性效应
2010-09-08徐纪芸潘奕陶池振新
徐纪芸,潘奕陶,池振新,王 宁
(1.东北师范大学城市与环境科学学院,吉林长春130024; 2.中石油东北炼化工程有限公司吉林设计院,吉林吉林132001; 3.吉林大学资源与环境学院环境科学系,吉林长春130012; 4.大连东泰产业废弃物处理有限公司,辽宁大连116600)
汞对中国林蛙蝌蚪的毒性效应
徐纪芸1,2,潘奕陶3,池振新4,王 宁1
(1.东北师范大学城市与环境科学学院,吉林长春130024; 2.中石油东北炼化工程有限公司吉林设计院,吉林吉林132001; 3.吉林大学资源与环境学院环境科学系,吉林长春130012; 4.大连东泰产业废弃物处理有限公司,辽宁大连116600)
为深入探讨汞对两栖类动物的致毒作用和机理,将中国林蛙(Rana chensinensis)蝌蚪暴露于含Hg2+的曝气自来水中,统计得出24,48,72和96 h的半致死浓度(LC50)分别为1.048,0.849,0.609和0.488 mg/L,并计算得出安全浓度(SC)为0.167 mg/L.另外,将26~27期林蛙蝌蚪饲养在Hg2+质量浓度分别为10,20,30和40μg/L的曝气自来水中,染毒40 d,分两时段测定其体内汞的含量,24 h蝌蚪体内的汞含量表现为染毒初期出现多个富集高峰,10 h后逐渐下降并稳定;每隔5 d的采样测定结果表明,随染毒时间延长,蝌蚪体内总汞含量总体呈下降趋势.染毒30 d后,各染毒组蝌蚪体内总汞含量基本稳定,且各染毒组蝌蚪体内总汞的平衡含量接近.蝌蚪急慢性汞中毒实验表明,汞污染对林蛙种群的正常生长有极大的负面影响.
汞;中国林蛙蝌蚪;毒性
0 引言
汞是自然界中一种有毒重金属元素,是动物体内的非必需元素,具有极强的生物累积作用,即使是低浓度的汞,一旦进入水环境中也可通过水生食物链的富集作用,使鱼体内的汞含量严重超标[1-2],并直接威胁到人类的健康.近些年来,随着环境污染的日益严重,两栖动物种类、数量在世界各地急剧下降[3],人们对于两栖动物的关注程度也在不断加大.两栖类动物具有独特的生活习性和生命周期,卵和蝌蚪期在水中生活,成体的生境则位于接近水的陆地.两栖类的皮肤具有较高的渗透性,对污染物的累积作用明显,因此对水体污染非常敏感,尤其是在幼体发育阶段对毒物有较好的响应作用,是毒理学研究的理想材料之一[4].
中国林蛙(Rana chensinensis)是一种营养价值极高的经济蛙类,广泛分布于以长白山地区为主的我国东北各省.目前,有关重金属对中国林蛙蝌蚪的毒性研究多集中在镉和铜的毒性效应方面[5],而对汞的研究尚未见报道.本实验以中国林蛙的蝌蚪为对象,分别研究了其体内汞的急性中毒和慢性中毒效应,为深入探讨汞对两栖类动物的致毒机理、反映研究区域环境质量状况提供了科学依据.
1 材料和方法
1.1 实验试剂
(1)氯化汞(HgCl2):优级纯,北京金星化工厂生产,用去离子水配制成1 mg/L母液;(2)硝酸(HNO3):优级纯,北京化工厂生产;(3)硫酸(H2SO4):优级纯,北京化工厂生产;(4)五氧化二钒(V2O5):分析纯,上海科丰化学试剂有限公司生产.
1.2 急性毒性试验
实验材料:林蛙受精卵,采集于吉林省丰满区旺起镇附近水域.实验室孵化,孵化期间室温为17℃~19℃.林蛙蝌蚪由受精卵发育到26~27期[6],约15日龄.适应3 d后选取体质健康、大小相似的个体进行实验,平均体重(0.068±0.01)g,平均体长(1.90±0.24)cm.实验期间,水温18℃~21℃,p H值保持在6.8~7.0.
参考有关研究资料进行预实验[7-9].设3~5个间隔较大的 Hg2+浓度,观察24,48和96 h蝌蚪的死亡数量,确定正式实验的浓度范围.正式实验设8个实验组,Hg2+的质量浓度分别为0.2,0.4,0.6,0.8, 1.0,1.2,1.4,1.6 mg/L及相应的空白对照.实验用水为曝气3 d以上的自来水,用2 L的烧杯,每个烧杯中随机放10只蝌蚪,设3个平行组.为保证染毒浓度的稳定,实验采取静态-更新的方法[10],每12 h换水一次.为减少食物对实验结果的影响,实验期间禁食.及时观察,记录蝌蚪中毒症状,并随时清除死亡个体.
用SPSS统计软件计算 Hg2+在24,48,72,96 h的半致死浓度(LC50),采用如下公式计算安全浓度SC值[11]:

其中:ρSC为安全浓度SC值,单位mg/L;ρ48hLC50为24 h半致死浓度LC50值,单位mg/L;ρ48hLC50为48 h半致死浓度LC50值,单位mg/L.
1.3 慢性毒性实验
根据相关研究资料[9,12],设置Hg2+质量浓度分别为10,20,30和40μg/L的4个染毒组,1个对照组.将蝌蚪饲养在直径为30 cm的圆形鱼缸内,每组投放300只蝌蚪,用5 L曝气3 d以上的自来水饲养.实验过程中,每2 d换1次水并同时加药.用人工配制的合成饲料(玉米面、豆面、山野菜、维生素、动物油等按一定比例混合而成)喂养,每日喂食1次.实验过程分为两个时段,各组分别取15只蝌蚪测定总汞含量,实验共进行40 d.样品采用V2O5-HNO3-H2SO4法消解后,立即用AFS-2202型原子荧光光度计测定其总汞含量(湿重).原始数据利用SPSS,Excel进行统计分析.
2 结果与分析
2.1 林蛙蝌蚪急性毒性实验
1.2 mg/L和1.4 mg/L染毒浓度组蝌蚪在染毒4 h后即表现出明显中毒症状,蝌蚪的活动性减弱,多沉于烧杯底部,对外界刺激反应迟钝.染毒12 h后高于0.6 mg/L的浓度组部分蝌蚪游动时不能保持平衡,出现尾部弯曲和腹部膨大等中毒症状.
由表1中数据可见,蝌蚪的死亡率随着 Hg2+浓度的增大和时间的延长而不断升高.用SPSS统计软件计算Hg2+在24,48,72,96 h的半致死浓度(LC50)分别为1.048,0.849,0.609和0.488 mg/L,SC为0.167 mg/L.对水中 Hg2+浓度和林蛙蝌蚪死亡率进行回归分析,得出 Hg2+浓度和林蛙蝌蚪的死亡率呈线性相关,结果见表2.
急性毒性实验一般不能反映环境污染物对水生生物长时间作用的结果,但由于急性实验时间短,能确定化学物质的毒性程度和剂量-效应关系,提供毒作用模式等方面的资料,并为进一步开展其他毒性试验提供理论依据,因此急性毒性实验得到了广泛的应用.卢祥云、张燕萍等人研究了汞离子和铜离子对中华大蟾蜍蝌蚪的联合毒性[7],结果是汞离子对蝌蚪的24,48 h的LC50值分别为0.712,0.612 mg/L,汞离子和铜离子共存时对蝌蚪的24,48 h的LC50值分别为0.550~0.400 mg/L和0.379~0.300 mg/L.根据汪学英等人的研究[9],重金属离子对黑斑蛙蝌蚪的毒性大小依次为Hg2+>Cu2+>Cd2+>Cr6+>Pb2+,其中Hg2+的毒性最强,对黑斑蛙蝌蚪24 h和48 h的LC50值分别为0.77,0.75 mg/L.本次实验中Hg2+对中国林蛙蝌蚪的24 h和48 h LC50值分别为1.048,0.849 mg/L,说明中国林蛙蝌蚪对汞的抗性能力较中华大蟾蜍蝌蚪和黑斑蛙蝌蚪强,这可能与不同物种的生理特征、原生活环境的差异及实验物种所处发育阶段有关.蝌蚪的死亡率随着Hg2+浓度升高和染毒时间延长而升高,说明Hg2+在蝌蚪体内存在累积效应,Hg2+毒性随着蝌蚪体内汞的蓄积量增加而增加.

表1 中国林蛙蝌蚪染毒Hg2+的死亡数和死亡率

表2 水中Hg2+浓度与林蛙蝌蚪死亡率的回归分析
另外,黄敏毅等人研究了镉对中国林蛙蝌蚪的毒性影响[13],结果是Cd2+对林蛙蝌蚪的24,48,72, 96 h的LC50值分别为5.72,5.15,3.67,3.10 mg/L.本实验Hg2+对中国林蛙蝌蚪的24,48,72,96 h的LC50值分别为1.048,0.849,0.609,0.488 mg/L,说明汞对中国林蛙蝌蚪的毒性要远大于镉,对生物的危害性更大.
2.2 林蛙蝌蚪慢性毒性实验
2.2.1 汞对林蛙蝌蚪生长发育的影响
分别用10,20,30和40μg/L Hg2+对林蛙蝌蚪染毒40 d,染毒组和对照组蝌蚪均有50%~60%的个体处于尾退化期[6].染毒30~35 d后,20,30,40μg/L染毒组蝌蚪个体开始出现明显的发育畸形现象,包括尾基部弯曲(见图1a),后肢着生在尾部一侧(见图1b),前肢短小,着生位置靠后等(见图1c);特别是在变态后期40μg/L处理组蝌蚪大量畸形变态,无法正常上岸活动.

图140μg/L染毒组蝌蚪畸形变态
一直以来,汞都被怀疑是一种对生物机体危害极大的环境内分泌干扰物质.环境内分泌干扰物质具有类天然激素或抑制天然激素的作用,可干扰神经、免疫及内分泌系统的正常调节功能.两栖类在幼体向成体转变过程中伴随着一系列腺体结构的改变以及生理机能的变化,包括呼吸系统的改变、皮肤的渗透、排泄、分泌等,因此各种内分泌干扰物容易在它们体内富集并达到一个较高的浓度.这些都会直接或间接影响蝌蚪的发育,最终导致发育畸形.
2.2.2 蝌蚪体内的汞含量分析
实验分两个时段测定蝌蚪体内的汞含量.首先在染毒后24 h内,分别取1,2,3,4,6,8,12,24 h的各组蝌蚪15只,测定其体内总汞含量(湿重),分析蝌蚪对毒物的应急反应,结果见表3.

表3 染毒24 h内不同染毒浓度组蝌蚪体内汞含量随时间变化 mg/kg
从表3数据可见:①随染毒浓度增大,蝌蚪体内汞含量出现先升高再降低的变化趋势;②随染毒时间延长,各浓度组蝌蚪体内的汞含量呈波动变化,20μg/L以上浓度组蝌蚪体内汞含量出现两个或多个峰值,40μg/L染毒组蝌蚪体内汞含量明显高于其他染毒组,且峰值波动较大;③染毒初期出现多个富集高峰,10 h后逐渐下降并稳定.低浓度染毒组蝌蚪体内汞的富集高峰值出现在染毒后3 h,高浓度染毒组蝌蚪体内汞的富集高峰值出现在4~6 h,有滞后现象;40μg/L染毒组在染毒12 h后下降到染毒初期的浓度,其他染毒组均在10 h后降到染毒初期的浓度.
第二时段,每隔5 d取各组蝌蚪15只,测定其体内总汞含量,结果见表4和图4.
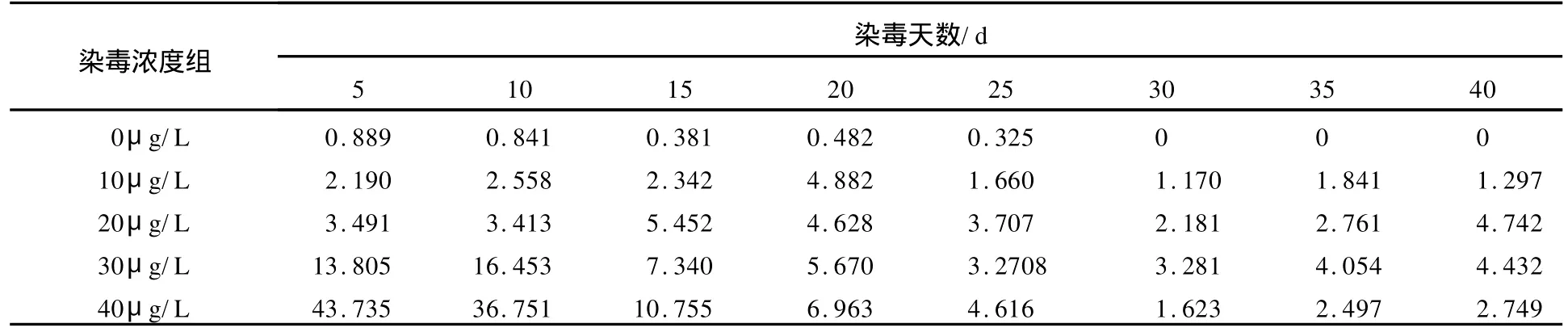
表4 不同染毒浓度组蝌蚪体内总汞含量随时间变化 mg/kg

图2 不同染毒浓度组蝌蚪体内总汞含量随时间变化曲线
从表3和表4可见,30和40μg/L染毒实验组蝌蚪从染毒24 h到第5天,体内汞的含量仍在继续上升,第15天后才迅速下降(见图2);10和20μg/L染毒组蝌蚪体内汞的含量也在缓慢上升,20 d后其体内浓度才逐渐下降;染毒30 d后,各浓度组蝌蚪体内汞含量基本稳定,蝌蚪对汞的吸收富集量和代谢排除量已基本达到平衡.
2.2.3 蝌蚪对污染物汞的中毒途径与作用机理探讨
根据相关文献[15],重金属可通过以下三种途径进入水生动物体内:一是经鳃直接吸收,然后通过血液输送到全身各个部位;二是通过食物链经消化道吸收[14];三是重金属通过生物体表与水体的渗透交换作用进入.
本实验中,染毒24 h后蝌蚪体内汞含量迅速升高.推测经鳃直接吸收和体表与水的渗透交换作用是其大量进入蝌蚪体内的两个主要途径.重金属进入生物体内后,主要通过体表吸附和透过体表吸收两种方式在体内累积赋存[15].无机汞主要聚积于肝脏和肾脏,并能诱导肝和肾内金属硫蛋白的合成.大部分无机汞是通过肝、肾代谢随尿液和胆汁排除体外的,而残余在体内的汞通过与金属硫蛋白结合被隔离固定,在生物体内蓄积.
各染毒浓度组蝌蚪体内汞含量在染毒10 h后迅速下降,说明大部分无机汞被排出体外;但在染毒第1天到第5天又有小幅上升,最终趋于稳定且平衡时的汞含量相差不大,说明蝌蚪体内残存的是与金属硫蛋白结合的结合态汞.当金属硫蛋白的结合位点达到饱和后,过量的未与金属硫蛋白结合的游离态汞会与生物体内其他的含巯基的蛋白质结合,导致蝌蚪体内某些酶类活性下降甚至失活;另外,汞也可通过与氨基、羟基、磷酸基结合与碱基等核酸组分络合,破坏DNA的结构完整性[16-17],这也是导致蝌蚪发育畸形(见图1)的又一重要原因.
本课题组2007—2009年每年4月,在松花江上游苇沙河流域金矿开采区附近河流设置了7个水质断面,水样中总汞含量为13~26μg/L[12].每年4-5月正值林蛙繁殖期,因此这一时期水体中汞的含量对蝌蚪的影响最大.本实验中10和20μg/L两个低浓度染毒组蝌蚪对水体中汞的最大浓缩系数分别为488.2和272.6.在实验室条件下,由于汞具有较强的挥发性,水中的汞浓度会随染毒时间的延长而逐渐降低.当水中汞浓度较低时,汞的相对挥发量很小,但对于蝌蚪的富集仍存在一定的影响.自然条件下,一定时期内水中的汞浓度基本上是稳定的,所以蝌蚪对水中汞的富集系数可能还会更高.可见汞污染对于林蛙种群的正常繁衍将产生极大的影响.虽然受实验条件限制,但本实验中10和20μg/L两个低浓度染毒组中国林蛙蝌蚪对水体中汞的富集规律以及汞对其生长发育产生的生理及形态影响,对研究汞污染地区的环境质量,探讨汞对两栖类的影响仍具有十分重要的指导意义.
3 结论
(1)将中国林蛙蝌蚪暴露于含Hg2+的曝气自来水中,蝌蚪在24,48,72和96 h的半致死浓度(LC50值)分别为1.048,0.849,0.609,0.488 mg/L,安全浓度(SC值)为0.167 mg/L.说明蝌蚪的死亡率随着Hg2+质量浓度的增大和时间的延长而不断升高,且蝌蚪出现尾部弯曲和腹部膨大的中毒症状.
(2)蝌蚪慢性毒性实验结果表明:随染毒时间延长,蝌蚪体内汞含量总体呈现下降趋势.染毒30 d后基本达到稳定,且各染毒组蝌蚪体内汞的含量非常接近,说明当蝌蚪对汞的吸收量和代谢排除量达到平衡后,其体内汞含量基本不随外界汞含量的变化而变化.
[1] SETHAJINTAIN D,JOHNSON E R,LOPER B R,et al.Bioaccumulation profiles of chemical contaminants in fish from the lower Willamette River,Portland Harbor[J].Oregon.Archives of Environmental Contamination and Toxicology,2004,46:114-123.
[2] DA SILVA DS,LUCOTTE M,ROULET M,et al.Trophic structure and bioaccumulation of mercury in fish of three natural lakes of the Brazilian Amazon[J].Water Air and Soil Pollution,2005,165:77-94.
[3] PARNDS J A,FOGDEN MPL,CAMPBELL J H.Biological response to climate change on a tropical mountain[J].Nature, 1999,398:611-615.
[4] 徐士霞,李旭东,王跃招.两栖动物在水体污染生物监测中作为指示生物的研究概况[J].动物学杂志,2003,38(6):110-114.
[5] 石戈,王健鑫,武佳,等.Cu2+和Cr6+对中国林蛙蝌蚪的急性毒性[J].东北师大学报:自然科学版,2007,39(2):116-121.
[6] 陈伟庭,范玉琴,李东风.中国林蛙胚胎后期发育观察[J].华南师范大学学报:自然科学版,2007(1):104-109.
[7] 卢祥云,张燕萍,等.汞离子和铜离子对中华大蟾蜍蝌蚪联合毒性研究[J].四川动物,2006,25(2):379-381.
[8] 杨再福.铜和汞对蝌蚪联合毒性的影响[J].农业环境保护,2001,20(5)370-371.
[9] 汪学英,卢祥云,李春梅,等.重金属离子对黑斑蛙胚胎及蝌蚪的毒性影响[J].四川动物,2001,20(2):59-61.
[10] 朱琳.环境毒理学[M].北京:高等教育出版社,2007.
[11] 雷衍之.养殖水环境化学[M].北京:中国农业出版社,2004.
[12] 蔡青香.松花江上游金矿区林蛙体内及其生境中汞和甲基汞污染研究[D].长春:东北师范大学,2008.
[13] 黄敏毅,张育辉.镉对中国林蛙蝌蚪生长发育的毒性效应[J].生态学杂志,2006,25(5):535-540.
[14] MASON R P,LAPORTE J M,ANDRES S.Factors controlling the bioaccumulatiaon of mercury,methylmercury,arsenic, selenium,and cadmium by freshwater invertebrates and fish[J].Archives of Environmental Contamination and Toxicology, 2000,38:283-297.
[15] 励建荣,李学鹏,王丽.贝类对重金属的吸收转运与累积规律研究进展[J].水产科学,2007,26:51-55.
[16] 费云芸,刘代成.低剂量汞元素的毒性作用机理[J].山东师范大学学报:自然科学版,2003,18(1):88-90.
[17] 吴益春,赵元凤,吕景才,等.水生生物对重金属吸收和积累研究进展[J].生物技术通报,2006(增刊):133-137.
(责任编辑:方 林)
Toxic effects of mercury on Rana chensinensistadpole
XU Ji-yun1,2,PAN Yi-tao3,CHI Zhen-xin4,WANG Ning1
(1.College of Urban and Environmental Sciences,Northeast Normal University,Changchun 130024,China; 2.Petro China Northeast Refining&Chemical Engineering Co.Ltd.,Jilin Design Institute,Jilin 132001,China; 3.College of Environmental and Resources,Jilin University,Changchun 130012,China; 4.Dalian Dongtai Industrial Waste Treatment Co.,Ltd.,Dalian 116600,China)
In this thesis,Rana chensinensistadpole was exposed toHg2+-containing tap water to research the effect and mechanism of mercury toxicity on the amphibian furtherly.The result showed that the half lethal concentration(LC50)of 24,48,72 and 96 h were 1.048,0.849,0.609,0.488 mg/L respectively and the safe concentration(SC)was 0.167 mg/L.In addition,theRana chensinensis tadpoles of the stage 26~27 were feed in tap water under Hg2+concentration(10,20,30 and 40μg/L) for 40 d.The mercury concentrations of tadpoles determined in two-stage showed that during 24 h there were several concentration peaks when early exposured and gradually decreased and stabilized after 10 h;The result determined every 5 d showed that with the exposure time increasing,the mercury concentrations of tadpoles appeared the trend of gradually declining.The total mercury concentrations in each group of exposured tadpoles were in basic stabilization after 30 d and the balanced concentrations were similar.The test of acute and chronic mercury poisoning in tadpoles showed that mercury pollution has a great negative impact on normal development ofRana chensinensisspecies.
mercury;Rana chensinensis;tadpole toxicity
X 171.5[学科代码]610·1020
A
1000-1832(2010)04-0138-06
2010-07-12
国家自然科学基金资助项目(40673059);东北师范大学测试基金资助项目.
徐纪芸(1983—),女,硕士研究生;通讯作者:王宁(1952—),女,博士,教授,主要从事环境物质地表过程及生态效应研究.
