水溶性壳聚糖对血管平滑肌细胞增殖的影响
2010-09-08刘贤英李桂荣
费 瑜,刘贤英,李桂荣,才 华,费 瑞
(1.吉林大学第二医院,吉林长春130041; 2.吉林大学白求恩医学院,吉林长春130021)
水溶性壳聚糖对血管平滑肌细胞增殖的影响
费 瑜1,刘贤英1,李桂荣1,才 华2,费 瑞2
(1.吉林大学第二医院,吉林长春130041; 2.吉林大学白求恩医学院,吉林长春130021)
通过化学方法测定了水溶性壳聚糖(water-solubility chitosan,WSC)的部分理化性质;通过原代分离培养大鼠腹主动脉平滑肌细胞和MTT实验,研究了1,10,100和1000μg/mL的WSC对血管平滑肌细胞的增殖作用.实验结果表明,WSC溶解度为125,含水量13.19%,脱乙酰度54.73%,重均相对分子质量1.17×105.在24 h和48 h时,大于10μg/mL的WSC可抑制原代培养的血管平滑肌细胞的增殖.其中,100和1000μg/mL的WSC在48 h时对细胞的增殖的抑制作用最明显,表明在一定条件下,WSC可抑制血管平滑肌细胞增殖,减轻由血管平滑肌细胞增殖所引起的血管狭窄问题.
水溶性壳聚糖;血管平滑肌细胞;增值
0 引言
血管狭窄(restenosis,RS)是血管创伤愈合的系统反应,涉及血管平滑肌细胞(vascular smooth muscle cells,VSMCs)、内皮细胞、血小板、炎症细胞和血液蛋白之间的复杂作用.其中,VSMCs的迁移和增殖是导致血管狭窄的重要环节[1-2].Clowes等研究发现,在大鼠颈动脉模型中,血管中层的VSMCs在损伤后几小时内即开始增殖,第4天迁移至内膜;14~21 d VSMCs数目增加为原来的3~5倍,占最终内膜细胞数目的90%[3].近年来,应用药物防治血管狭窄问题逐渐受到重视[4].一些抗血栓形成药物、血管扩张剂、抗增生药物及降血脂药物等,尽管能选择性地抑制某一活性因子,使血管狭窄得到缓解,但并没有使再狭窄的发生得到控制[5].因此,开发一种安全有效的抑制VSMCs增殖的药物,对降低冠心病经皮冠状动脉介入(percutaneous coronary intervention,PCI)治疗后血管狭窄的发生具有十分重要的临床意义.
水溶性壳聚糖(water-solubility chitosan,WSC)是壳聚糖的降解产物,它除具备壳聚糖原有的特点外,还具有易溶于水和利于吸收利用等特点,因此在生物医学领域具有极高的应用前景[6].Kosuzuki等实验证明,壳聚糖及其衍生物可抑制肿瘤细胞的生长和转移[7];刘晓宇等研究发现,两性壳聚糖在体内对T淋巴细胞的增殖有显著的刺激活性,但在体外对小鼠淋巴细胞增殖无影响[8].一些研究还显示,低分子壳聚糖(low molecular weight chitosan,LMWC)具有结合胆酸、降低胆固醇、升高 HDL-C/TC的作用,表明LWMC可用于血管狭窄的防治[9].本实验通过体外原代培养大鼠腹主动脉VSMCs,探讨了WSC对VSMCs增殖的影响,为进一步开发抑制血管狭窄的药物提供了实验依据.
1 材料与方法
1.1 材料
WSC(青岛海普);胶原酶Ⅱ(Invitrogen);四唑盐(Genview);二甲基亚砜(Sigma).
1.2 设备
显微镜(日本,OLYMPUS);酶标仪(Austria,T ecan A-5082);高效液相色谱仪(日本,SHIMADZU).
1.3 动物
体重(150±10)g SD大鼠(SPF),由吉林大学白求恩医学院动物中心提供,合格证号:吉实动质(2000)-042号.实验前在室内常规饲养2 d.
1.4 实验方法
1.4.1 WSC溶解度测定
室温下精确量取100 mL蒸馏水注入锥形瓶,同时准确称取WSC并逐渐加入锥形瓶,直至液体变为凝胶状.三次重复,取平均值.利用下列公式计算WSC溶解度:

式中,G1为原有的WSC质量(g),G2为剩余的WSC质量(g).
1.4.2 WSC含水量测定
准确称取一定质量的WSC,在25℃恒温干燥箱中烘干至恒重.三次重复,取平均值.利用下列公式计算含水量:
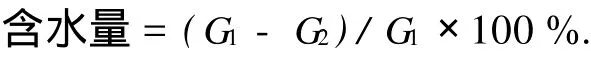
式中,G1和G2分别为烘干前后的糖样品质量(g).
1.4.3 WSC脱乙酰度测定
将WSC样品放于干燥箱中,25℃烘干至恒重.准确称取0.3 g样品置于250 mL锥形瓶中;先加入标准0.1 mol/L盐酸溶液30 mL,室温(20℃~25℃)下溶解完全;再加入5 mL混合指示剂(V(1%甲基橙)∶V(1%苯胺蓝)=1∶2).用0.05 mol/L氢氧化钠溶液滴定至锥形瓶中溶液刚好变色,即为滴定终点.重复三次,取平均值,按下列公式计算脱乙酰度:

式中,G1为盐酸标准溶液的浓度(mol/L);C2为氢氧化钠标准溶液的浓度(mol/L);V1为加入的盐酸标准溶液的体积(mL);V2为滴定的氢氧化钠标准溶液的体积(mL);G为样品质量(g).
1.4.4 相对分子质量测定
采用高效液相色谱法(HPLC)测定.仪器:SHIMADZU LC-l0Atm(Japan);监测器:SHIMADZU RID-10A;工作站:CLASS VP;色谱柱:TSK-GEL,G-4000 PWXL,7.8(ID)×30.0 cm(L);流动相: 0.9%NaCl;流速:0.5 mL/min;柱温:40℃;压力:1.6 MPa;进样量:20μL.
1.4.5 大鼠腹主动脉VSMCs的提取和培养
处死大鼠,分离胸腹主动脉,D-Hanks液漂洗2~3次.剪去血管外脂肪及结缔组织,剖开血管,刮去内膜细胞.将动脉置于含10%FBS的DMEM中,37℃5%CO2培养箱孵育12 h;取出剪碎,放入2 g/L胶原酶后,继续孵育12 h.取出,离心收集细胞,加入含20%FBS的DMEM,放入37℃5%CO2培养箱中培养.2~3 d后更换新鲜培养液;5 d左右,细胞融合达到70%~80%时,进行传代和纯化.
1.4.6 大鼠腹主动脉VSMCs的纯化
取一细胞生长良好的培养瓶,加入少量0.25%的胰蛋白酶消化细胞,制成细胞悬液.然后,将细胞悬液移入新培养瓶中静置15 min,收集培养液并放入另一培养瓶,再次静置15 min.重复上述步骤2次,离心.加入新鲜含10%FBS的DMEM培养液,于37℃5%CO2培养箱中培养.α-actin标记为阳性用于实验研究.
1.4.7 WSC对大鼠腹主动脉VSMCs增殖的影响
采用MTT比色法测定VSMCs的增殖结果.取6代以内细胞,加无血清培养基培养12 h,进行血清饥饿同步化处理.然后,用0.25%胰蛋白酶消化,制成细胞悬液,以每孔5×103个细胞的密度接种于3块96孔板,即每孔接种细胞悬液200μL.将细胞分成对照组和实验组,每组6个复孔.对照组加入含10%FBS的DMEM;实验组分别加入不同质量浓度(1,10,100和1000μg/mL)的WSC,每孔50μL,分别作用24,48和 72 h.在培养结束前4 h,吸去培养液,每孔加入新配置的 0.4%的 MTT溶液100μL,继续培养4 h.小心吸去培养液,加入150μL二甲基亚砜,置摇床上低速振荡10 min,然后迅速用酶标仪在492 nm处测量各孔吸光值D(492).
1.5 统计分析
实验数据以平均值±标准差表示.统计的差异显著性由ANOVA(方差)检验.概率值P<0.05为统计的显著性,P<0.01为统计的极显著性.
2 结果
2.1 WSC溶解度测定结果
室温下WSC的溶解度为125.溶解过程中,WSC呈棕褐色,遇水即溶,表明WSC有良好的水溶性.
2.2 WSC含水量测定结果
如表1所示,WSC的含水量为13.19%,表明该糖为较干燥的样品.

表1 WSC含水量测定
2.3 WSC脱乙酰度测定结果
用标准0.1 mol/L NaOH溶液滴定WSC的终点是测试液变成橙黄色.实验结果如表2所示,WSC的脱乙酰度为54.73%.

表2 WSC脱乙酰度测定
2.4 WSC相对分子质量测定结果
如图1所示,经HPLC法测定,WSC重均相对分子质量约为1.17×105.WSC有3个主要的峰,出峰时间分别为:11.906,13.657和15.357 min,所占峰面积分别为47.39%,16.81%,12.97%,说明样品的相对分子质量主要由这3种多糖组分决定.另外,由图1可见:第一个峰所占面积远大于其他各峰,说明样品中此相对分子质量的多糖含量最高.
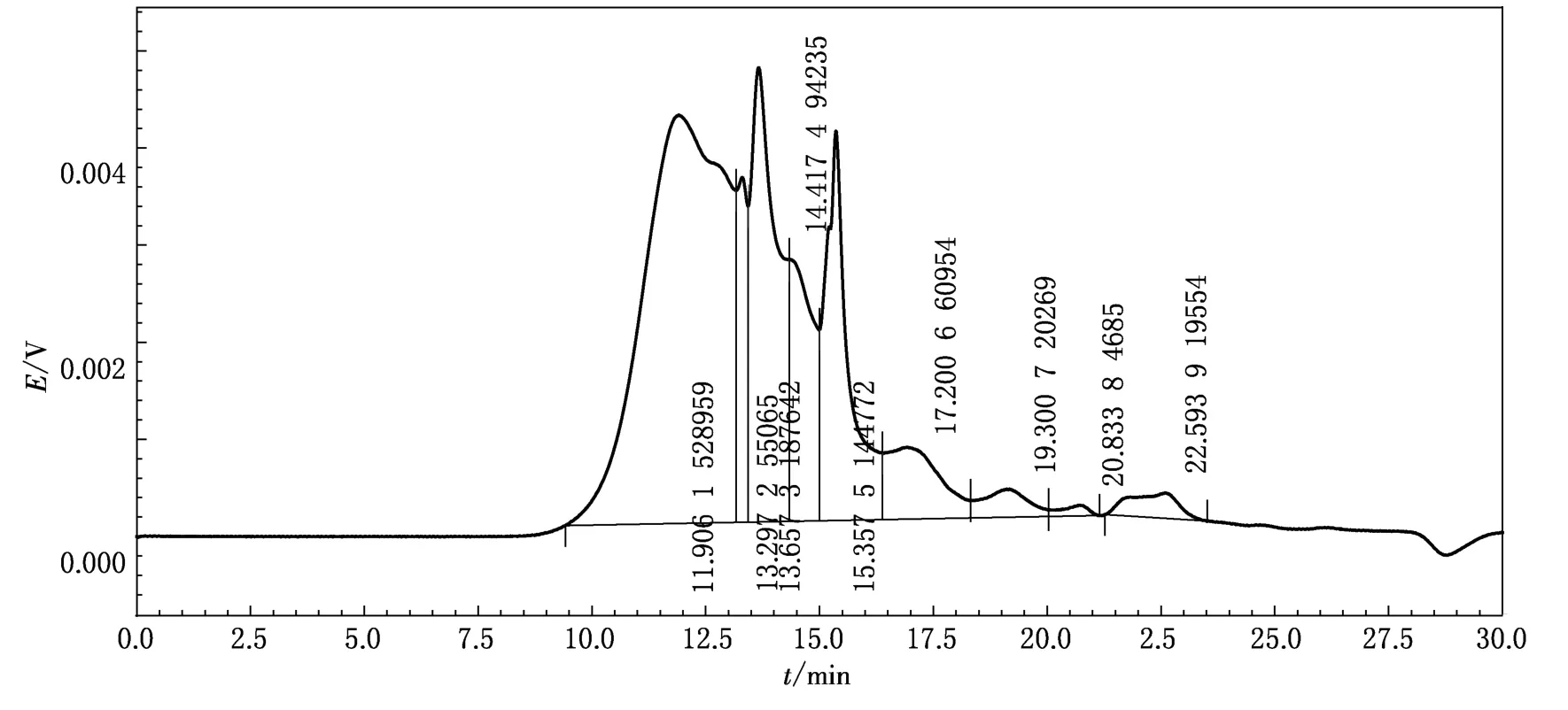
图1 WSC的HPLC分析
2.5 WSC对平滑肌细胞增殖的影响
MTT测定结果(见表3)表明:作用24 h时,随浓度增大,WSC对细胞的抑制作用加大.当质量浓度大于10μg/mL时,WSC对细胞的抑制作用与对照组相比有显著性差异(P<0.05).作用48 h时, WSC对细胞的抑制作用呈明显浓度依赖性,其中,质量浓度大于100μg/mL时,WSC对细胞的抑制作用与对照组相比有极显著性差异(P<0.01).作用72 h后,细胞增殖能力减弱,各组细胞生长变化差异不明显(P>0.05).
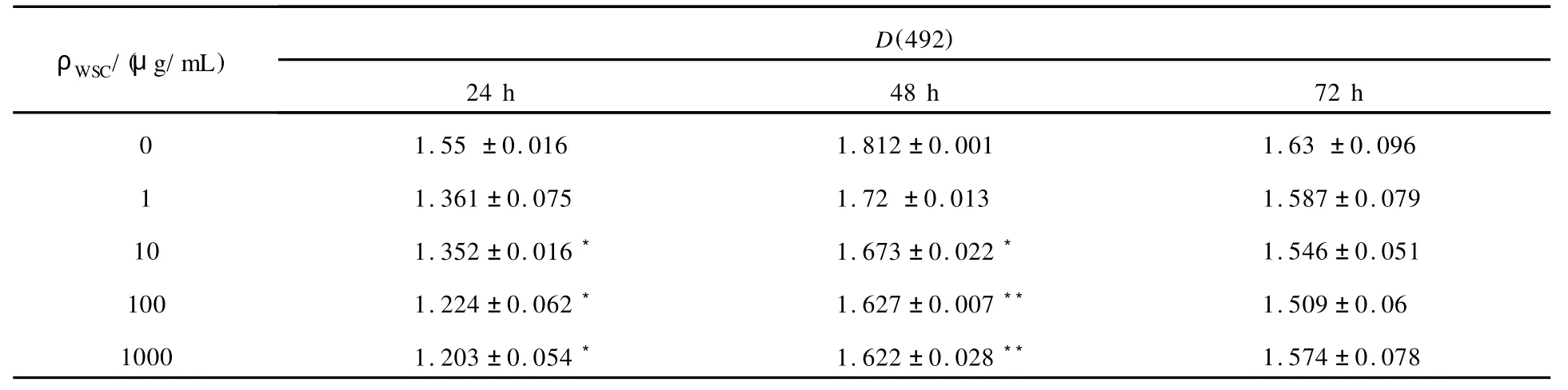
表3 WSC对平滑肌细胞的增殖作用
3 讨论
许多研究证实,化学改性剂、衍生物及溶剂等都影响壳聚糖的基本性能,从而使其生理功能发生变化[10-11].WSC是壳聚糖的降解产物,因此对WSC理化性质的研究有利于全面了解该成分的活性.脱乙酰度表征了乙酰化与脱乙酰化之间的平衡程度,说明了壳聚糖中自由氨基的含量,脱乙酰度大小直接影响到壳聚糖的结晶性、溶解性及一些重要的生理活性等.实验证明,脱乙酰度越高、相对分子质量越小,越易溶于水,其中,脱乙酰度在45%~55%之间的壳聚糖水溶性较好[12].本实验测定的WSC的脱乙酰度为54.73%,其溶解度(125)与上述结论相吻合.为进一步搞清WSC的理化性质,我们又对其含水量和相对分子质量进行了测定.实验测得,WSC的含水量为13.19%,重均相对分子质量是1.17×105.
研究表明,壳聚糖及其衍生物对肿瘤细胞有强烈的抑制作用;而LMTC也可通过干扰细胞膜的正常结构,阻止生长因子与细胞膜上受体的结合,实现细胞增殖抑制[13-14].实验证明,大鼠主动脉血管内皮损伤后,VSMCs大量增殖,约占整个新生内膜细胞总数的88.8%[15].因此,本实验根据以往文献,分离了大鼠腹主动脉VSMCs,研究了WSC对该VSMCs生长的抑制作用.实验结果发现,在48 h以内, WSC均能在一定范围内抑制大鼠腹主动脉VSMCs的增殖,其中,WSC在100,1000μg/mL时显现出最好的抑制效果.分析原因很可能与WSC的较强水溶性有关,具体机制有待进一步证实.另外,实验结果还表明,当细胞培养72 h时,细胞增殖能力减弱,WSC的作用不明显.分析原因可能与细胞生长状态有关.因为原代培养的细胞对营养、生存空间等条件要求较高,细胞的大量增殖使细胞生长环境恶化,导致部分细胞死亡,细胞增殖能力降低,从而影响实验结果[16].
我们的实验证明,WSC在一定条件下对VSMCs的增殖有明显的抑制作用,可进一步开发成治疗血管再狭窄的高效、低不良反应药物.
[1] 逯建华.冠状动脉粥样硬化性心脏病介入治疗的研究进展[J].中国现代医药杂志,2010,12(3):129-130.
[2] BLACKSHEAR J L,O'CALLAGHAN W G,CALIFF R M.Medical approaches to prevention of restenosis after coronary angioplasty[J].J Am Coll Cardiol,1987,9(4):834-848.
[3] CLOWES A W,REIDY M A,CLOWES M M.Kinetics of cellular proliferation after arterial injury.I.Smooth muscle growth in the absence of endothelium[J].Lab Invest,1983,49(3):327-333.
[4] QIAN J Q.Cardiovascular pharmacological effects of bisbenzyliso-quinoline alkaloid derivatives[J].Acta Pharmacol Sin,2002, 23(12):1086-1092.
[5] LANDZBERG B R,FRISHMAN W H,LERRICK K.Pathophysiology and pharmacological approaches for prevention of coronary artery restenosis following coronary artery balloon angioplasty and related procedures[J].Prog Cardiovasc Dis,1997, 39(4):361-398.
[6] 董静静,李思东,杨磊.水溶性壳聚糖的制备及其应用研究进展[J].广州化工,2008,36(6):7-10.
[7] KOSUZU KI.Antitumor effect of hexa-N-acetylchitohexaose and chiohexaose[J].Carbohydrate,Research,1986,151:403-408.
[8] 刘晓宇,孙成新,李杰,等.两性壳聚糖的制备及其对小鼠淋巴细胞增殖的影响[J].东北师大学报:自然科学版,2010,42(2): 110-114.
[9] 尤行宏,吴勇,彭圆,等.低分子壳聚糖对糖尿病大鼠血糖、血脂含量的影响[J].中国老年学杂志,2005,25(5):541-543.
[10] 吴晓莉,张灿,平其能.改性壳聚糖在药物传递中的应用进展[J].中国天然药物,2009,7(6):458-464.
[11] 吕全建,赵华新,姬小明,等.影响壳聚糖质量因素的研究[J].郑州牧业工程高等专科学校学报,2004,24(1):3-4.
[12] ZHANG X,ZHU B,GU Q.Effect of deacetylation degree of chitosan on thermosensitive hydrogel via rheological characterization[J]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2008,22(7):861~863.
[13] 谢勇,周南进,曹俊,等.壳聚糖及其衍生物对肝癌细胞SMMC7721生长的抑制作用[J].中国组织工程研究与临床康复, 2008,12(23):4579-4582.
[14] 王梅,丁华,魏欣冰.低分子壳聚糖季铵盐对牛血管平滑肌细胞增殖的影响[J].中国药理学通报,2005,21(8):966-969.
[15] 王金林,谭小进,谢志娟.大鼠颈动脉再狭窄模型的建立及其病理机制的初步研究[J].现代生物医学进展,2008,8(6): 1042-1045.
[16] 胡少勃,宋自芳,郑启昌,等.大鼠主动脉内皮细胞和平滑肌细胞的原代培养及生物学特性比较[J].中国组织化学与细胞化学杂志,2009,18(4):349-353.
(责任编辑:方 林)
Effect of water-soluble chitosan on the proliferation of vaseular smooth muscle cells
FEI Yu1,LIU Xian-ying1,LI Gui-rong1,CAI Hua2,FEI Rui2
(1.Second Hospital,Jilin University,Changchun 130041,China; 2.School of Norman Bethune Medical Science,Jilin University,Changchun 130021,China)
To assay the physical and chemical properties of water-soluble chitosans(WSC)by chemical method,and to research the effect of WSC,in the concentration of 1,10,100 and 1000μg/mL,on proliferation of vascular smooth muscle cells by the separating big the aorta smooth muscle cells of rats and MTT experiment.Results show that WSC solubility,moisture content and deacelation degree were respectively 125,13.19%and 54.73%,molecular weight was 1.17×105.WSC of more than 10μg/mL concentration of 24 h or 48 h,could inhibit the proliferation of vascular smooth muscle cells.Especially when in the concentration of 100μg/mL and 1000μg/mL of 48 h,WSC could obvious inhibit cells proliferation.These results showed that under certain conditions,WSC can inhibit vascular smooth muscle cells proliferation,reduce restenosis caused by vascular smooth muscle cells.
water-soluble chitosans;vascular smooth muscle cells;proliferation
Q 946.3[学科代码]180·5120
A
1000-1832(2010)04-0121-05
2010-05-23
吉林省科技发展计划项目(200705354).
费瑜(1963—),男,博士研究生,主任医师,主要从事心血管介入治疗研究;通讯作者:费瑞(1964—),男,博士,教授,主要从事多糖生物活性研究.
