大鼠间歇训练对海马 c-fos蛋白表达的影响
2010-09-08张安民
于 芳,张安民,李 楠
大鼠间歇训练对海马 c-fos蛋白表达的影响
于 芳1,张安民2,李 楠3
(1.中北大学体育系,山西太原 030051;2.烟台大学体育学院,山东烟台 264005;3.山西医科大学,山西太原 030001)
为了观察大鼠间歇训练对海马 c-fos蛋白表达的影响。将雄性 SD大鼠 30只,随机分为对照组(5只)、间歇训练组(25只)。建立大鼠间歇游泳训练模型,采用ABC免疫组织化学法,观察大鼠海马 c-fos阳性神经元细胞表达的变化(即 c-fos蛋白表达变化),并用图像分析系统和统计学软件进行图像和数据分析。结果表明:训练后大鼠海马不同区域 c-fos阳性细胞表达密度明显增高,与对照组相比均有显著性差异 (P<0.01);CA2区 c-fos阳性细胞表达迅速而明显,训练后 0.5 h即达峰值,而后回落;CA3区 c-fos阳性细胞表达最为密集,训练后 1 h达到高峰,而后快速回落; CA1区 c-fos阳性细胞表达相对较少,1 h达到高峰,而后缓慢下降。结论:大鼠间歇训练对海马不同区域 c-fos蛋白表达有影响,具有时效性;海马不同区域 c-fos蛋白表达在密度、时相上存在明显差异,这可能与海马不同区域对缺血、缺氧的耐受能力有关。
间歇训练;海马;c-fos蛋白
海马是下丘脑—垂体—肾上腺皮质轴 (HPA)应激反应的高位调节中枢。海马在抑制下丘脑—垂体—肾上腺皮质轴 (HPA)的应激反应中起着非常重要的作用。刺激海马可抑制应激诱导的糖皮质激素的分泌,损伤整个海马或海马背侧,则可引起HPA轴对多种应激源的敏感性增强,血浆糖皮质浓度异常升高[1]。据此,Fuchs提出边缘系统—下丘脑—垂体—肾上腺轴 (HLPA)[2]的概念,因此,作为边缘系统的海马就更受关注。旨在通过观察 6周间歇性负重游泳训练后,大鼠海马内 c-fos表达的分布特点、随时间变化的规律,探讨间歇训练脑变化的可能机制。
1 材料和方法
1.1 实验动物和分组
采用雄性 SD大鼠 (山西医科大学动物实验中心提供),3月龄,体重 220~250 g。饲养条件:分笼饲养,每笼 5只,自由饮食,自然昼夜节律光照,室温在20±5℃。相对湿度在40%~60%。将大鼠随机分为:对照组 5只,间歇训练组 25只。
1.2 训练模型建立
采用游泳训练方式建立训练动物模型。游泳条件:塑钢玻璃游泳池,150×60×70 cm,水深为大鼠身体长度的 2倍,约 60 cm,水温保持在 33℃至36℃之间,每个游泳池随机分配 5只大鼠。正式训练前训练组大鼠进行 3 d适应性游泳训练,3 d的训练时间分别为 15 min、20 min、30 min。随后开始正式的游泳训练,训练安排见表 1。

表1 游泳训练安排表
1.3 取材切片
6周间歇游泳训练造模结束后,分即刻、0.5 h、1 h、2 h、4 h共 5个时刻取材。首先用 0.2%戊巴比妥钠腹腔注射麻醉动物 (35~50 mg/公斤体重),打开胸腔,从心尖将穿刺针插入至升主动脉,然后迅速剪破右心耳,并快速灌入 400 ml预冷的生理盐水冲洗血管,随后用 4%多聚甲醛 250 ml快速灌注,接着放慢速度仍用 4%多聚甲醛 250 ml灌注,进行前固定,然后用 10%蔗糖 PBS液灌入 300 ml,至肝脏变硬变白为止。最后迅速断头,将头部放在冰盘上,打开颅腔,暴露全脑,取出放在 4%多聚甲醛液内固定 2 h,再浸入 20%蔗糖 PBS液中 4℃过夜,待组织块完全沉底后,用冰冻切片机连续冠状切片,隔 4取 1,片厚 40μm。
1.4 免疫组织化学染色
切片经 0.5%Triton X-100 PBS液孵育 40 min,入H2O2中 10 min,然后加入 10%正常羊血清封闭40 min,再加入第一抗体 (兔抗鼠),37℃孵育 5 h后,4℃再孵育 36 h;随后加入生物素化羊抗兔第二抗体,37℃孵育 40 min,接着入卵白素生物素复合物中,37℃孵育 40 min,以上各步骤均用 0.01 M PBS液经摇床充分漂洗 3遍 (每次 3~5 min),DAB呈色,用蒸馏水充分漂洗 3次 (每次 3~5 min), 0.2%明胶裱片,梯度酒精脱水,二甲苯透明,中性树胶封片。
阴性对照组:分别以正常兔血清和 PBS代替第一抗体孵育,对照组无阳性产物即无特异性反应。
1.5 细胞记数和定量分析
其免疫阳性物质位于细胞核内,核深染,呈圆形或椭圆形,核仁透亮不着色,胞浆染色为阴性,无论染色深浅只要所示细胞为DAB特征染色 (光镜下 c-fos免疫反应阳性神经元呈圆形和椭圆形),免疫阳性物质位于细胞核内,核深染,核仁透亮不着色,胞浆染色为阴性。在低倍镜下和高倍镜下与背景区分明确,即可认定为 FOS样蛋白免疫反应(Fos-like immunreactivity FL I)阳性细胞核。40×10倍光镜下计数每张切片双侧海马的 FL I阳性神经元的数量,应用 SPSS13.0统计软件进行分析,统计 FL I阳性细胞总数、均数、标准差和标准误,每组内各时段间的差异用方差分析,组间比较用独立 t检验。
2 实验结果
光镜下观察,大鼠海马区 c-fos蛋白免疫反应物质呈棕黄色颗粒状,染色均匀,主要位于神经细胞核内,胞浆内也有部分表达,背底呈淡黄或不着色。
图象分析和统计学处理结果显示 (见表 2,图1):正常对照组和模型组大鼠下丘脑内均有表达,对照组 c-fos阳性细胞少量散在大鼠海马;模型组 cfos阳性细胞数目明显增多。间歇训练结束后,在大鼠海马 CA1区域 c-fos阳性细胞表达较平和,逐渐升高至 1 h达最高值,而后缓慢回落;CA2区域 cfos阳性细胞表达迅速增加,0.5 h即达峰值,1h时较峰值显著下降 (P<0.05),然后维持在一定水平; CA3区域 c-fos阳性细胞表达密度持续升高,训练后 1 h,c-fos阳性细胞数密度最大,达到峰值,较其他各组表达显著升高 (P<0.05),2 h后表达快速下降。
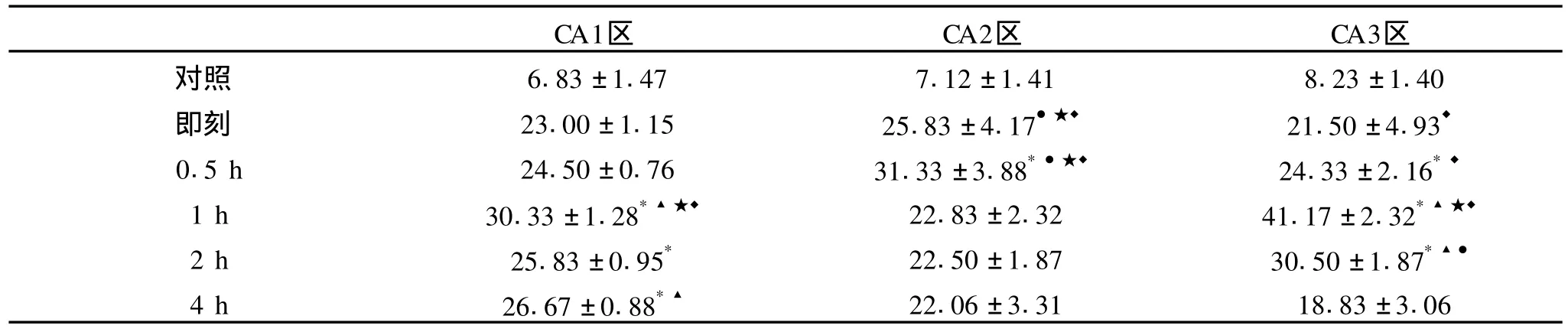
表 2 大鼠海马 CA1、CA2、CA3区 c-fos阳性神经元图像分析结果
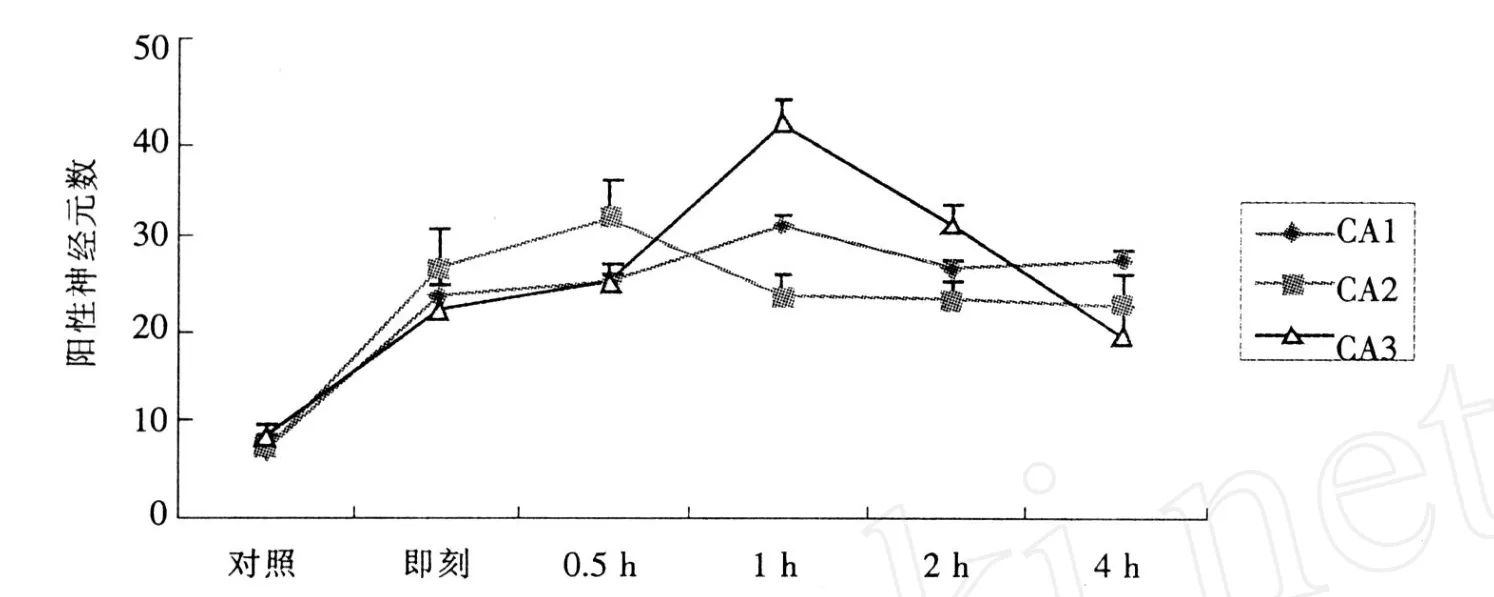
图 1 大鼠海马 CA1、CA2、CA3区 c-fos蛋白表达的时效性
3 讨论
在原癌基因的家族中有一类能被第二信使所诱导的原癌基因称为即刻早期基因 ( Immediately Early Genes,IEGs),亦称快速反应基因。这类基因是指细胞经外部刺激后最先表达的一组基因,是联系细胞生化改变与细胞最终对刺激发生特异性反应的中介物。因此,又被认为是第三信使[3]。c-fos属于即刻早期基因 (IEG),近几年来,随着对生物学功能认识的逐渐深入,人们开始从不同的角度探讨影响原癌基因 c-fos表达的因素。c-fos基因作为数十种原癌基因中的一种,在正常情况下参与细胞的生长、分化、信息传递、学习和记忆等生理过程,它通常处于不活动或表达很低的状态,在受到刺激时能做出迅速而短暂的反应 (刺激后数十分钟内即开始表达,数十小时后就恢复正常水平),被认为是研究中枢神经系统最有代表性的即刻早期基因[4-5],且其表达产物 mRNA和核磷蛋白 (P55c-fos,简称 Fos)位于神经元的胞浆或胞核内,人们常将其视作神经元激活的一个重要指标。再之,不同性质和强度刺激时 c-fos表达的脑区、时程、密度和数量不同,用免疫组织化学方法显示在各种刺激条件下 c-fos表达产物所在脑区和强度并结合其时程变化的特点,可对不同刺激在脑内的功能定位和神经通路进行研究[6]。短暂的刺激与长期的表达变化有着一定的联系,这其中需要原癌基因表达的改变,同时也必然存在着一种或多种机制,将细胞表面刺激与神经元转录调节装置偶联起来,从而对细胞分化和可塑性起着重要作用[7]。近期不少学者注意到了这一点,开始研究应激对海马 c-fos蛋白表达的影响。
已有研究证实,运动应激对海马区的 c-fos基因表达有着显著的影响,Dayas[8]和 Oladehin[9]分别发现跑台运动和游泳均能增加海马 c-fos基因表达,研究认为运动不仅能维持海马神经元的活性,而且在运动影响神经系统的过程中起到了调控因子的作用。本研究建立了间歇训练实验动物模型,模拟负荷强度高、瞬间性强的无氧运动。选取海马 CA1区、CA2区和 CA3区为研究脑区,观察间歇训练后,大鼠海马CA1区、CA2区和 CA3区 c-fos蛋白表达规律,探讨不同形式训练脑变化的可能机制。实验结果显示:间歇训练后大鼠海马不同区域 c-fos阳性细胞表达均显著升高。其规律是:间歇训练结束后,在大鼠海马 CA1区域 c-fos阳性细胞表达较平和,逐渐升高至 1 h达最高值,而后缓慢回落;CA2区域 c-fos阳性细胞表达迅速增加,0.5 h即达峰值,1 h时较峰值显著下降 (P<0.05),然后维持在一定水平;CA3区域 c-fos阳性细胞表达密度持续升高,训练后 1 h,c-fos阳性细胞数密度最大,达到峰值,较其他各组表达显著升高 (P<0.05),2 h后表达快速下降。这些结果提示:1)训练应激能使海马神经细胞内的即刻基因信息系统快速激活,使神经细胞处于活化状,并对与海马 c-fos蛋白调节有关的下游靶细胞及信号通路产生较长时间的影响;2)大鼠海马 CA1区、CA2区和 CA3区中 c-fos表达在密度、时相上均存在明显差异,这可能与海马不同区域对缺血、缺氧的耐受能力有关;3)训练应激引起海马 c-fos表达上调的机制可能与NMDA受体的激活和胞内钙离子浓度升高密切相关。Murphy[10]在脑缺血前应用NMDA受体拮抗剂MK-801,结果发现能明显抑制 c-fos基因在脑缺血后的表达,证明NMDA受体参与了 c-fos基因的表达。也有研究认为[11],胞内钙离子浓度升高时,与钙调蛋白(CaM)结合形成 Ca/CaM复合物,对转录因子进行磷酸化修饰,从而启动 c-fos基因的表达。
目前,对于运动训练后 c-fos表达的作用尚有争议,还有待进一步研究证实。我们的后期实验将对c-fos的靶基因及效应进行研究,以揭示运动应激对机体影响的中枢机制。
[1]JACODSON L,SAPOLSKY R.The role of the hippoeampus in feedback regulation of the hypothalamic-pituitary-adrenocortical axis[J].Endocrine Review,1991,12(2):l18-134.
[2]FUCHS E,FLUGGE G.Chronic social stress:effects on limbic brainstructures[J].Physiology&Behavior,2003,79(3):417 -427.
[3]王晓明,韩济生.原癌基因与核内第三信使[M].北京:北京医科大学,中国协和医科大学联合出版社,1993:273.
[4]FUNAHASH IM,YIFEN He.Noxious tooth pulp st imulation suppresses c-fos expression in the rat hippocampal for mation [J].Brain Research,1999,827(1-2):215-220.
[5]KATANO H,FUJ ITA K,KATO T,et al.A metabotropic glutamate receptorantagonist,alpha-methyl-4-car-boxyphenylglycine,attenuates immediate early gene mRNA expression following traumatic injury in cultured rat cortical glial cells[J]. NeurosciLett,2001,306(1-2):101-105.
[6]李占江,林文娟.脑内原癌基因 c-fos与大鼠本能行为的研究[J].心理科学,1998,21(1):75-76.
[7]王雪.神经细胞的生理和病理过程与原癌基因 c-fos的关系[J].ForeginMedical Science of Pathophysiology and ClinicalMedicine,1998,18(4):358-362.
[8]DAYAS CV,BULLER K M,CRANE JW,XU Y,DAY TA. Stressor categorization:acute physical and psychological stressors elicit distinctive recruitmentpatterns in the amygdale and in medullary noradrenergic cell groups[J].European Journal ofNeuroscience,2001,14(7):1143-1152.
[9]OLADEH IN A,WATERS RS.Location and distribution of Fos protein expression in rat hippocampus following actue moderate aerobic exercise[J].Experiment Brain Research, 2001,137(1):26-35.
[10]MURPHY TH,DE LONG MJ,COYEL JT.Enhanced NAD (P)H:quinone reductase activity prevents glutamate toxicity produced by oxidative stress[J].Neurochem,1991,56(3): 990-995.
[11]SHSRP FR,GONZOLEZMF,H ISANAGA K,et al.Induction of the c-fos gene product in rat forebrain following cortical lesions and NGF injection[J].NeurosciLett,1989,100(1-2):117-122.
[责任编辑 江国平]
Study of the Influence of Interm ittent Exercise on the Expression of c-fos Protein in Hippocampus of Rat
YU Fang1,ZHANGAn-min2;L INan3
(1.College of Phydical Education,North Uuniversity of China,Shanxi 030051,China; 2.College of Phydical Education,YanTaiUniversity Yantai Shandong 264005,China; 3.MedicalUniversity of Shanxi,Taiyuan 030001,China)
This is to study the effect of inter mittent exercise on the expression of c-fos protein in hippocampus.Male SD rats were randomly divided into two groups:control group and intermittent exercise group.To establish the intermittent s wimming exercise models in rat,and detect the change of the expression of c-fospositive cells in hippocampus by usingABC immunohistochemistrymeans,then analyze the image and data by imaging analyzing system and statistic software.The result shows that: after exercise,the density of c-fos positive cellswere significantly higher in the different regions of hippocampus,with significant difference as comparedwith the control group(P<0.01);in CA2,the expression of c-fospositive cellswere increased obviously,gets up to the top at 05h,and then descend;In CA3,the express density of c-fos positive cells is the highest,the top at 1h,and then descend rapidly;in CA1,the express density of c-fos positive cells is small relatively,the top at 1h,and then descend slowly.Conclusion:inter mittent exercise could affect the expression of c-fos protein in hippocampus,and the expression of c-fos protein was timelines;the express density and phase of c-fos positive cells in the different regions of hippocampus have significant difference due to the tolerance of ischemia and anoxia.
inter mittent exercise;hippocampus;c-fos protein
G 804.2
A
1007-7413(2010)02-0078-04
2009-12-07
国家自然科学基金项目(30671019)
于芳(1968—),女,山西太原人,副教授。研究方向:运动医学。
