整体煤气化联合循环合成气水合物法分离CO2的分子动力学模拟*
2010-09-08颜克凤李小森陈朝阳徐纯钢
颜克凤 李小森陈朝阳 徐纯钢
(中国科学院广州能源研究所,中国科学院可再生能源与天然气水合物重点实验室,广州510640)
(中国科学院广州天然气水合物研究中心,广州510640)
(2009年8月27日收到;2009年10月26日收到修改稿)
整体煤气化联合循环合成气水合物法分离CO2的分子动力学模拟*
颜克凤 李小森†陈朝阳 徐纯钢
(中国科学院广州能源研究所,中国科学院可再生能源与天然气水合物重点实验室,广州510640)
(中国科学院广州天然气水合物研究中心,广州510640)
(2009年8月27日收到;2009年10月26日收到修改稿)
利用分子动力学(MD)模拟方法研究整体煤气化联合循环(IGCC)合成气(CO2/H2)水合物法分离CO2的分离机理,系统研究了CO2水合物、H2水合物以及合成气水合物法一级分离所得CO2/H2混合气体水合物的微观结构及性质.模拟分析n个CO2或H2与水合物笼状结构的整体结合能ΔEn,得出CO2比H2与笼状结构结合更稳定,易形成水合物.因此,CO2/H2混合气体中CO2更易进入水合物中,从而达到IGCC合成气中CO2分离效果.模拟分析气体水合物(GH)中CO2,H2与单胞腔的结合能ΔEGH,得出采用合成气水合物法分离CO2形成结构Ⅰ型(SⅠ)水合物,CO2首先占据大胞腔,其次占据小胞腔,H2只能占据小胞腔.同时模拟温度为273.7 K和压力为8.5 MPa条件下一级分离所得CO2/H2混合气体水合物构象,分析H2单占据和双占据SⅠ水合物小胞腔的ΔEn和ΔEGH,结果表明H2单占据稳定.通过MD模拟得出一级分离稳定水合物构象,为IGCC合成气水合物法分离CO2提供了理论指导.
水合物法分离,分子动力学模拟,整体煤气化联合循环合成气,CO2分离
PACC:8230L,6185
1. 引言
整体煤气化联合循环(IGCC)发电作为绿色煤电技术被广泛应用,其产出合成气中CO2的捕集,对节能减排具有重要意义[1].传统上分离含CO2气体混合物的方法主要有化学吸收、深冷分离、变压吸附与膜分离等,这些方法普遍存在CO2分离能耗高、成本高的缺点[2].新的低能耗分离方法正在实验研究中[3,4].
水合物法分离混合物气体是利用易生成水合物的气体组分发生相态转移,实现混合气体的分离,具有方法简单、操作条件低等特点,是IGCC合成气中新的CO2分离方法[5].1966年,Glew[6]首次对结构Ⅱ型(SⅡ)水合物中丙烷和丙烯进行分离. Elliot等[7]于1997年通过控制操作条件稍高于某种气体的水合物生成突变点,在20℃时利用水溶液吸收特定的气体组分,实现从天然气中分离特定的烃类组分.Happel等[8]于1994年提出了一种新型分离气体的装置,这种装置可利用生成水合物将N2从CH4中分离出来.Kang等[9]研究了以四氢呋喃为促进剂的CO2/N2混合气体分离实验,基于相平衡条件提出水合物法气体分离工艺,回收超过99%烟气中的CO2.Park等[10]研究硅胶中水合物法分离CO2/N2混合气体,通过三级分离后CO2为96mol%.Linga等[5]通过水合物法分离烟气中的CO2和IGCC合成气中的CO2.在国内,文献[11,12]均提出基于水合物分离技术从含H2的混合气体中分离浓缩氢的方法,并研究了含H2的混合气体水合物法分离技术.李栋梁等[13]在混合气体CO2/N2中添加四丁基溴化铵作为促进剂,利用水合物法分离回收得到45%CO2.李小森等[14]研究促进剂浓度、温度、压力等对水合物法分离烟气(CO2/N2)中CO2的影响,通过二级分离后CO2为95mol%.目前对于水合物法分离混合气体技术的研究还处于探索阶段,这些实验还不足以解释水合物法分离的机理以及分离后的构象变化.
分子模拟是研究微观结构和机理的一种强有力工具[15—17].Alavi等[18]通过分子动力学(MD)研究H2在SⅡ水合物中占据情况,得出H2单占据小胞腔,四占据大胞腔结构最稳定.文献[19]通过分子模拟研究了CH4水合物、CO2水合物、CO2/CH4混合气体水合物的稳定结构,通过稳定能计算解释了实验CO2水合物法置换CH4时,CH4再次进入小胞腔的机理.目前,水合物法分离混合气体的模拟研究还未见文献报道.本文将通过MD模拟CO2水合物、H2水合物,分析水合物法分离机理以及分离后CO2,H2占据情况,得到一级分离CO2/H2稳定构象.
2. 模拟方法及过程
CO2形成结构Ⅰ型(SⅠ)水合物[20],H2形成SⅡ水合物[21],采用文献[22,23]的方法分别搭建SⅠ和SⅡ笼状结构.O原子初始位置来源于X射线单晶衍射实验[24],晶格中的H原子排列无序.因SⅠ水合物单晶胞腔较少(2个小胞腔,6个大胞腔),模拟使用2×2×2(x×y×z)超晶胞,各胞腔中填入一个CO2分子,得到含有552个H2O和96个CO2分子的2.379nm×2.379nm×3.568nm(x×y×z)正交超晶胞.SⅡ水合物单晶胞含16个小胞腔和8个大胞腔,直接模拟单晶胞结构,在每个大胞腔填入4个H2分子,每个小胞腔填入1个H2分子,得到含有369个H2O分子和48个H2分子的2.379nm× 2.379nm×3.568nm(x×y×z)正交单晶胞.
模拟采用NPT系综,有DL_POLY[25]软件进行MD模拟.模拟H2O使用单点电荷(simple point charge)势能模型[26]控制水的相互作用,满足Bernal-Fowler规则[27].控制H2O的H—O键长为0.1nm,H—O—H键角为109.47°[26].CO2分子和H2分子采用相容化合价力场(consistent valence force field)[28],分子对间的非键结van der Waals作用力采用Lennard-Jones势能计算.采用Ewald方法[29]处理长程静电相互作用.各分子起始速度由Maxwell-Boltzmann分布随机产生,在周期性边界条件和时间平均等效于系综平均等假设基础上,运用Velocity Verlet算法[30]求解牛顿运动方程.使用Nose-Hoover热溶方法[31]控制温度和压力,H2的SⅡ水合物模拟温度为234 K,压力为220 MPa[21].为模拟相同温度和压力条件下H2和CO2的水合物构象,CO2的SⅠ水合物模拟温度和压力也选为234 K和220 MPa(低于CO2的SⅠ水合物相平衡条件能形成稳定水合物).模拟时间步长为1 fs,模拟时间为1 ns,其中500 ps平衡结构,水合物体系1 ns模拟时间足够达到模拟稳定[18,20].
3. 结果及讨论
3.1. 模拟力场参数的验证
MD模拟是应用力场并根据牛顿运动力学原理发展的计算方法[32],适合的分子(原子)力场对MD模拟的可靠性具有决定的作用.文献[19,33,34]用MD模拟水合物结构和性质时,采用与本文相同的力场并获得较好的结果.本文MD模拟得到稳定时H2的SⅡ水合物单晶胞长度为17.034nm,与实验结果[21]相符;CO2的SⅠ水合物单晶胞长度为11.857nm,由于温度和压力条件不同,因而略高于文献[35]的实验值.由此可知,本文使用力场适用于CO2,H2以及CO2/H2的水合物MD模拟.同时通过水合物的径向分布函数(RDF)的模拟,所得结果与文献一致,这进一步表明本文模拟力场具有可靠性.
3.2. 纯气体水合物结构分析
模拟得到CO2的SⅠ水合物[001]晶向和H2的SⅡ水合物[111]晶向在1 ns的瞬时稳定构象(图1),该晶向构象能清晰地表现客体分子在笼子中的分布情况.从图1可以看出:H2O之间形成氢键,构成笼状结构.SⅠ水合物中CO2分布于笼子中央.SⅡ水合物的小胞腔中H2分布于笼子中央,大胞腔中4个H2分子围绕笼子中央均匀分布.
质心分布(center of mass probability distributions)是通过模拟大量构象中客体分子质心位置的统计,能表示客体分子在笼子中的运动情况[36—38],与瞬时构象(仅表示该模拟时刻客体分子在笼子中的分布)相比,质心分布图更为直观、准确.因此,我们分析CO2在SⅠ水合物和H2在SⅡ水合物中的质心分布图.模拟平衡阶段每2000步保存一个构象,统计叠加CO2和H2的质心分布,结果如图2所示.从图2(a)能清晰地看出,CO2分布于笼子中央,并在笼子中央运动.从图2(b)可以看出,小胞腔内H2分布于笼子中央,大胞腔中H2围绕笼子中央分布.图2(c)为大胞腔放大后的图像,可以看出胞腔中央出现空洞,表明H2在大胞腔中没有分布于中央,而是围绕中央分布.同时还可以看出,大胞腔中H2在有的方向分布较多,在有的方向分布较少甚至出现分布空洞.这是因为SⅡ水合物大胞腔并不是规整球形,有的笼子表面与笼子中心距离较近且空间较小,有的表面则离笼子中心较远且空间较大.因此,H2倾向在较大空间运动,在该方向分布较多;相反,在空间较小处分布较少,甚至不会运动到该区域.
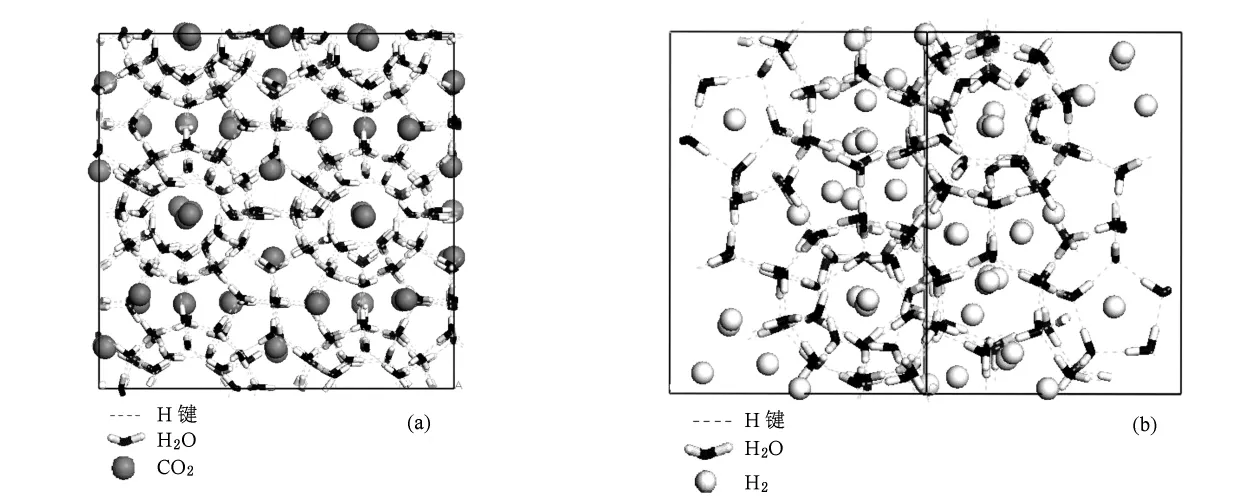
图1 模拟CO2和H2水合物瞬时构象(a)CO2的SⅠ水合物[001]晶向,(b)H2的SⅡ水合物[111]晶向
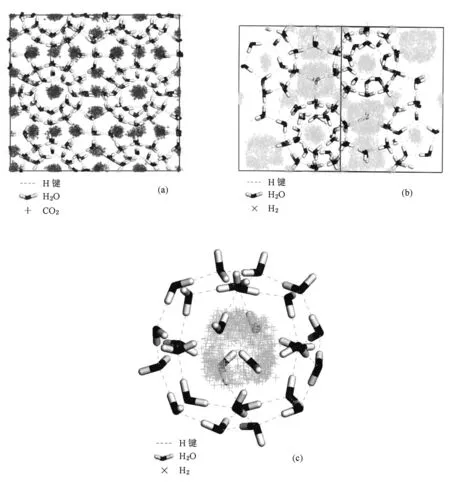
图2 CO2和H2在水合物中的质心分布(a)CO2,(b)H2,(c)放大后SⅡ水合物在大胞腔中的H2
3.3. 纯气体水合物性质分析
RDF是系统的区域密度与平均密度之比,表示分子或原子的分布状况.为了研究CO2的SⅠ水合物和H2的SⅡ水合物稳定构象,分别对模拟稳定构象的RDF进行分析,结果如图3所示.图3(a)表示CO2的SⅠ水合物和H2的SⅡ水合物的H2O中O原子之间的RDF(gO-O(r)).从图3(a)可以看出,第一个峰表示相邻O原子的分布距离,即为笼状结构各顶点距离.SⅠ与SⅡ笼状结构大多是五边形,因此第一个峰出现位置相同,r≈0.278nm,与文献[20]所得结果一致.由于H2O分子数不同,因此统计分布的峰高有所不同.图3(b)表示在SⅠ水合物中CO2的C原子之间RDF(gC-C(r)).从图3(b)可以看出,第一个峰表示相邻C原子之间分布,相邻笼子中心的距离大约为0.683nm,与文献[39]所得结果一致.图3(c)所示为SⅡ水合物中H2的H原子RDF(gH-H(r)),其中第一个峰表示相邻H2的H原子之间距离分布,即为同一个笼子(大胞腔)中H原子的分布距离为0.300nm,与文献[40]中N2双占据大胞腔之间距离相似,第二个峰表示相邻笼子中心距离大约为0.620nm,表明SⅡ水合物的胞腔间距离比SⅠ水合物胞腔间距离略小.
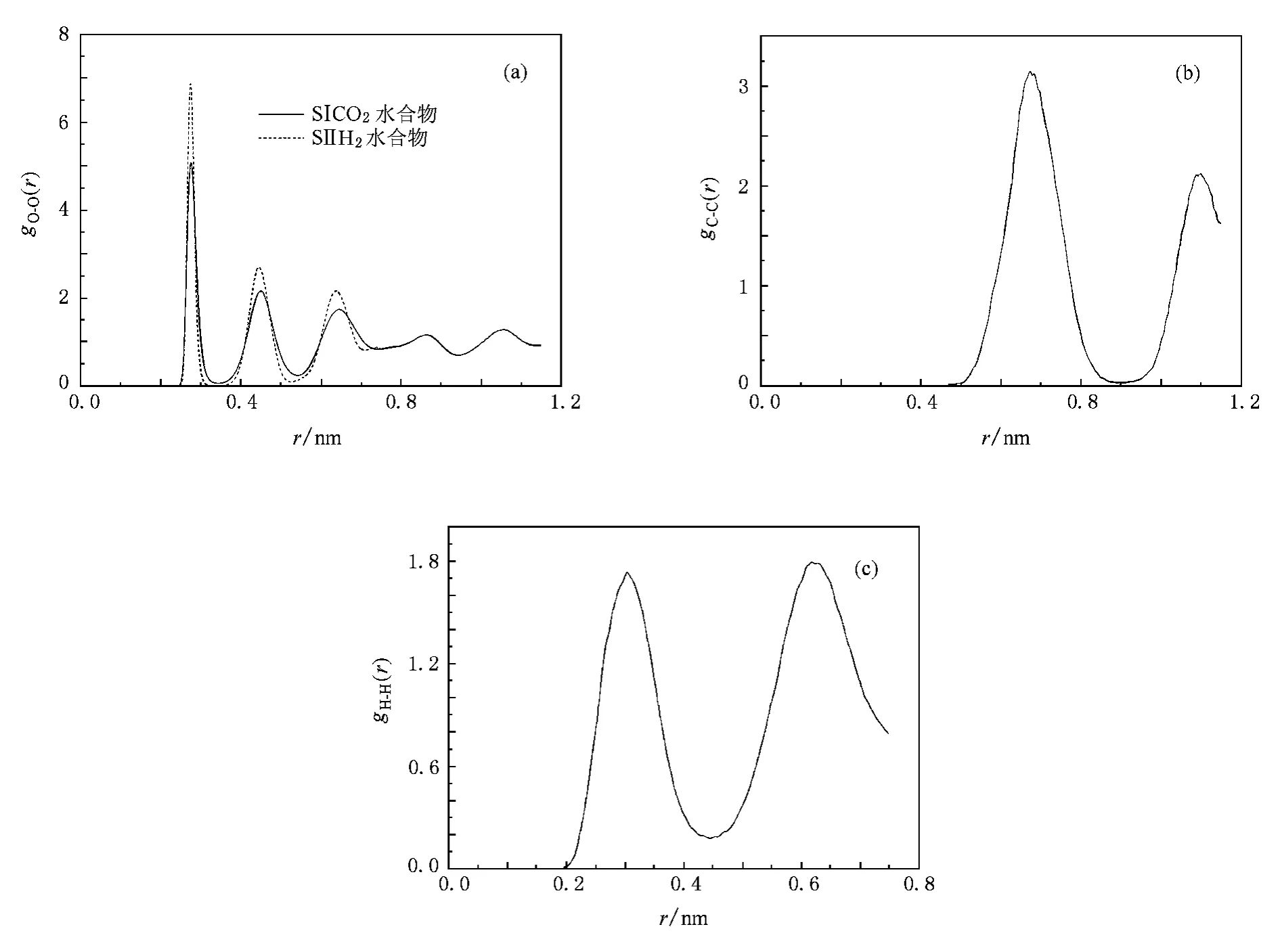
图3 稳定构象的RDF(a)CO2的SⅠ水合物与H2的SⅡ水合物的gO-O(r),(b)CO2的SⅠ水合物的gC-C(r),(c)H2的SⅡ水合物的gH-H(r)
原子i(i=O,H,C)在z方向的密度分布ρi是指在整个模拟期间模拟体系中原子i沿z方向的统计平均.其表达式为
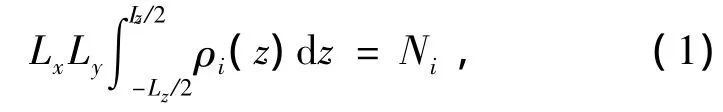
式中Lx,Ly,Lz分别为模拟晶胞在x,y,z方向的长度,Ni为体系中i种原子的总数.分析模拟得到稳定构象的ρi如图4所示.图4(a)表示CO2的SⅠ水合物中H2O的O原子和CO2的C原子的密度分布,图中实线峰表示O原子分布较多,即沿z轴方向笼子表面H2O分布较多,峰谷则表示笼子间空隙H2O分布较少.图4(a)中虚线峰表示C原子分布较多,即笼子中央C原子分布较多.图4(a)中沿z轴方向r为0.3,0.9,1.5,2.1nm处CO2只出现在大胞腔中央,r为0.6,1.2,1.8nm处CO2出现在大胞腔和小胞腔中央,因此分布较多,峰较高.同理,在H2的SⅡ水合物中,曲线峰表明笼子表面H2O的O原子分布较多,而笼子空隙H2O分布较少处出现峰谷; H2则围绕笼子中央分布,H原子的峰高出现在H2O分布较少的峰谷处,如图4(b)所示.
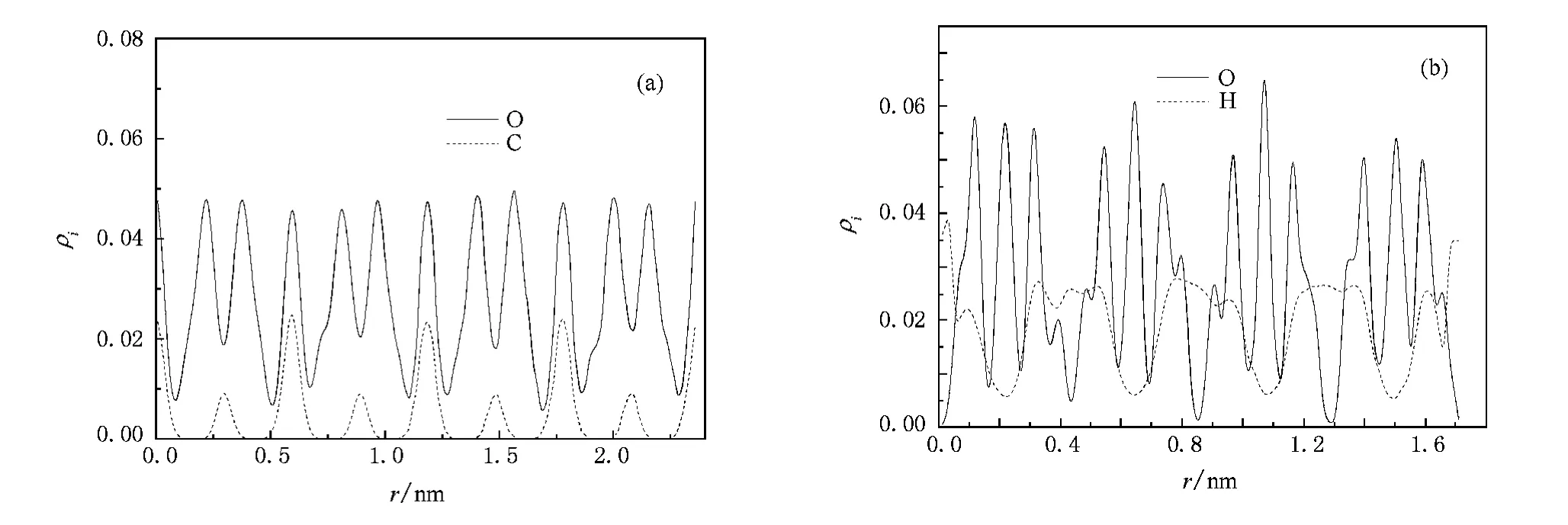
图4 稳定构象的浓度分布(a)CO2的SⅠ水合物,(b)H2的SⅡ水合物
综上所述,通过MD模拟体系瞬时稳定构象、客体分子质心分布、RDF和ρi分析,得出CO2和H2在形成水合物时的分布与微观构象.
3.4. 纯气体水合物结合能
客体分子与水合物笼子之间的结合能ΔEn定义[18]如下:
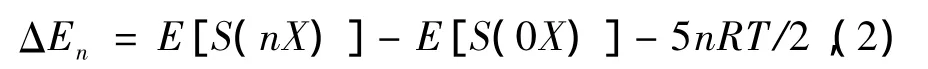
式中X表示客体分子H2,CO2,n为客体分子数,E[S(nX)]和E[S(0X)]分别表示水合物晶胞被n个客体分子和无客体分子占据的能量.模拟得到两个体系的ΔEn如表1所列.从表1可知,每个CO2与水合物笼子的ΔEn/n值比每个H2与水合物笼子的ΔEn/n值更小,表明CO2与水合物笼子结合更稳定.水合物形成中客体分子被H2O包裹,CO2比H2更易于与H2O结合形成稳定构象,即CO2水合物生成条件低于H2水合物生成条件,该结果与文献[20,21]中CO2和H2水合物形成条件一致.因此,由CO2与H2的结合能ΔEn/n可知,CO2/H2混合气体与H2O反应,CO2易与H2O较稳定结合形成CO2水合物,而与H2分离,达到水合物法分离CO2的效果.

表1 纯水合物客体分子与水合物笼子之间的结合能
为了更深入地了解客体分子与水合物笼子的结合情况,在与表1相同温度和压力条件下分别分析了客体分子与各个胞腔的结合能,即气体水合物(GH)中气体分子占据胞腔的稳定能ΔE[19],GH
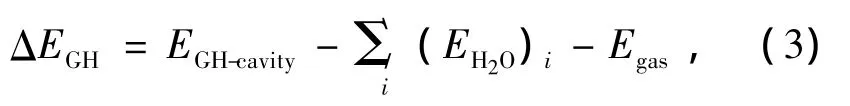
式中EGH-cavity为胞腔与客体分子总能量,EH2O和Egas分别为气体分子占据的胞腔内H2O和气体分子的能量.CO2和H2与大胞腔、小胞腔的结合能ΔEGH如表2所列.对比客体分子与大胞腔、小胞腔的ΔEGH/n可知,CO2的结合能比H2的结合能更小,表明CO2与H2O结合更稳定,易形成水合物.同时得出CO2/H2混合气体形成水合物时,形成SⅠ水合物比SⅡ水合物结构稳定,因此IGCC合成气分离CO2时形成SⅠ水合物.这与X射线衍射实验所得结果[41]一致.
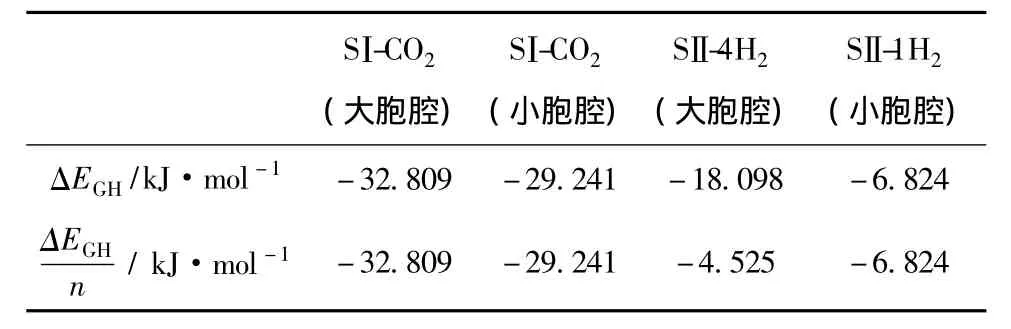
表2 纯水合物客体分子与大胞腔、小胞腔的结合能
对比表2中CO2与SⅠ水合物大胞腔和小胞腔的ΔEGH/n可知,CO2在大胞腔比小胞腔稳定,即形成水合物时,CO2优先与H2O形成大胞腔,然后再形成小胞腔.该模拟结果从微观机理解释了文献[41]通过核磁共振得出的实验结果:CO2/H2混合水合物中CO2存在于SⅠ大胞腔中,H2存在于小胞腔中.
综上所述,通过MD模拟研究得出,CO2与H2相比更易与H2O结合,形成稳定水合物,因此CO2/H2混合气体可通过水合物生成分离CO2,解释IGCC合成气的水合物法分离CO2的分离机理.同时得出合成气水合物法分离CO2时形成SⅠ水合物,CO2首先占据大胞腔,其次占据小胞腔,H2只能占据小胞腔,从微观机理解释了实验现象.
3.5. CO2/H2混合气体一级分离稳定构象
H2单占据和双占据小胞腔对水合物的储氢能力影响较大[18],同时也会影响水合物分离CO2的能力,因此有必要模拟研究单占据和双占据小胞腔对CO2/H2混合气体一级分离所得水合物构象的影响.根据文献[5]搭建一级分离后的混合气体水合物构象,首先搭建SⅠ水合物2×2×2(x×y×z)超晶胞,48个CO2分子填入大胞腔.H2分子双占据小胞腔,因此将11个CO2分子填入小胞腔,10个H2分子填入5个小胞腔中,得到含85mol%CO2的CO2/H2混合水合物.H2单占据小胞腔,因此将7个CO2分子填入小胞腔,9个H2分子填入9个小胞腔中,得到含86mol%CO2的CO2/H2混合水合物.采用NPT系综,模拟温度为273.7 K,压力为8.5 MPa[5],模拟时间步长为1 fs,模拟时间为1 ns,其中500 ps平衡结构.
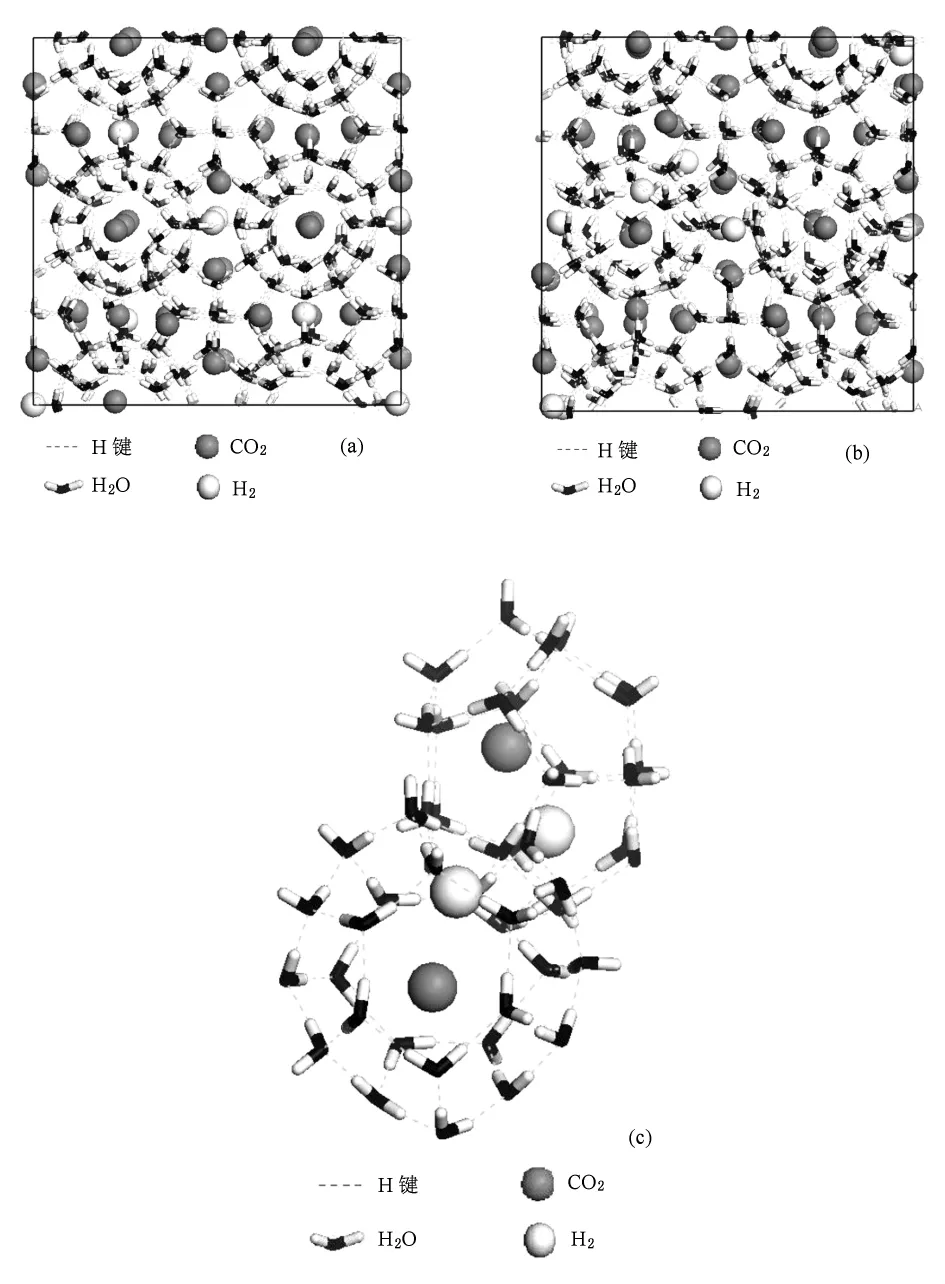
图5 IGCC合成气一级分离后稳定瞬时构象(a)H2单占据小胞腔,(b)H2双占据小胞腔,(c)H2双占据小胞腔中部分胞腔放大后的构象
图5为模拟1 ns瞬时体系构象,图5(a)和(b)分别表示H2单占据和双占据小胞腔的混合气体水合物体系瞬时构象.从图5(a)可以看出,模拟1 ns时体系笼状结构规整,而图5(b)中笼状结构出现部分扭曲.H2双占据小胞腔的情形下,会出现部分H2从小胞腔中逃出,运动到相邻的大胞腔中,与CO2共同占据大胞腔.原来CO2占据大胞腔中心,由于H2的进入而偏离中心,同时使得胞腔发生一定的扭曲.图5(c)为(b)图中部分胞腔放大后的构象,由此可以看出H2进入大胞腔并使CO2偏离胞腔中心位置.
图6为CO2和H2在混合水合物中的质心分布图.从图6(a)可以看出,CO2和H2分布于笼子中央,而图6(b)中的H2分布出现混乱,部分进入CO2占据的胞腔,使得CO2分布也出现混乱.由上述分析得出:H2单占据小胞腔时,CO2和H2分布规律,笼子规整;H2双占据小胞腔时,出现CO2和H2分布混乱,笼子部分变形.分析表明,CO2/H2混合气体水合物中H2单占据水合物结构稳定.
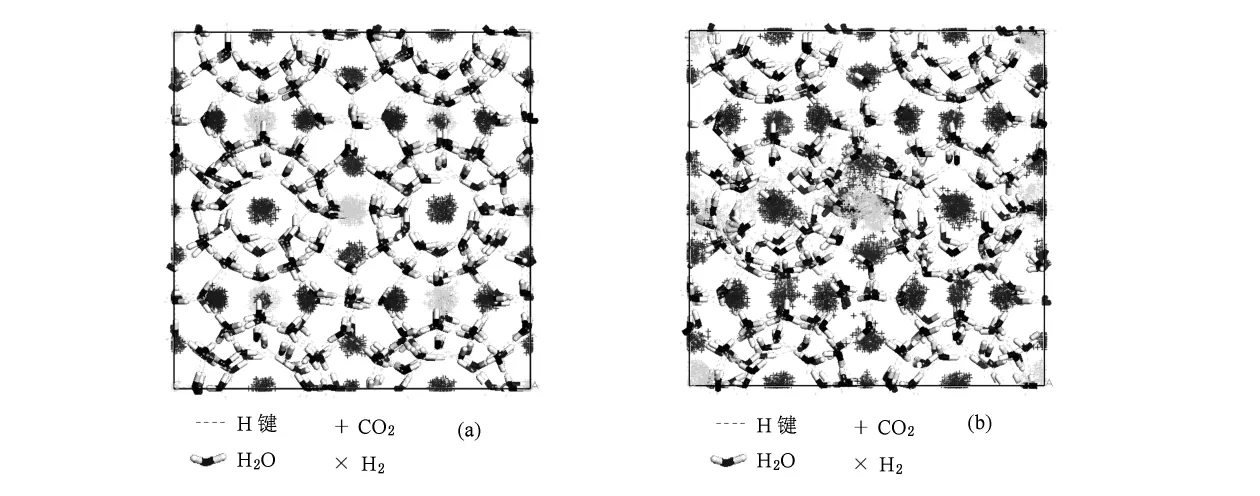
图6 IGCC合成气一级分离后CO2和H2在水合物中的质心分布(a)H2单占据小胞腔,(b)H2双占据小胞腔
表3列出了H2单占据和双占据小胞腔的混合气体水合物体系的ΔEn.从表3中可知,H2单占据小胞腔时混合气体水合物体系中每个H2与笼子之间的ΔEn/n值比双占据时ΔEn/n值更小,表明单占据比双占据稳定.表4是在与表3相同温度和压力条件下得到的混合气体水合物中H2与小胞腔的结合能ΔEGH.从表4可知,1个H2与小胞腔之间的ΔEGH/n比双占据中每个H2与小胞腔的ΔEGH/n更小,这说明单占据小胞腔结构更稳定.

表3 混合气体水合物中客体分子与水合物笼子的结合能

表4 混合气体水合物中H2与小胞腔的结合能
综上所述,CO2/H2混合气体分离后形成混合气体水合物中H2双占据小胞腔会出现部分笼状结构变形,气体分子分布混乱,而H2单占据小胞腔结构稳定.因此,IGCC合成气水合物法一级分离后H2以单分子占据SⅠ水合物小胞腔.
4. 结论
通过MD从微观角度研究了CO2的SⅠ水合物和H2的SⅡ水合物稳定构象和客体分子的质心分布.模拟得出H2O之间形成H键,构成笼状结构; SⅠ水合物中CO2分布于笼子中央;SⅡ水合物小胞腔中H2分布于笼子中央,大胞腔中4个H2分子围绕笼子中央均匀分布.模拟分析稳定构象中H2O分子和气体分子的ρi和RDF,得到CO2和H2气体水合物微观性质.同时,模拟分析了CO2或H2与水合物笼状结构的整体结合能ΔEn/n,结果表明CO2比H2与笼状结构结合稳定,易形成水合物,使得CO2从CO2/H2混合气体中分离出来,从而解释了IGCC合成气水合物法分离CO2的分离机理.采用MD模拟分析了CO2,H2与单胞腔结合能ΔEGH,得出采用合成气水合物法分离CO2形成SⅠ水合物,CO2首先占据大胞腔,其次占据小胞腔,H2只能占据小胞腔,从微观机理解释了实验结果.分析温度为273.7 K和压力为8.5 MPa条件下一级分离所得CO2/H2混合气体水合物构象,模拟得出H2单占据小胞腔比双占据更为稳定,从而得到一级分离稳定水合物构象,这可为IGCC合成气水合物法分离CO2提供理论指导.
[1]Perinline H W,Luebke D R,Jones K L,Myers C R,Morsi B I,Heintz Y J,Ilconich J B 2008 Fuel.Process.Technol.89 897
[2]Aaron D,Tsouris C 2005 Sep.Sci.Technol.40 321
[3]Ishida M,Zheng D,Akehata T 1987 Energy 12 147
[4]Winnick J,Toghiani H,Quattrone P 1982 AICHE J.28 103
[5]Linga P,Kumar R,Englezos P 2007 J.Hazard.Mater.149 625
[6]Glew D N 1966 U.S.Patent 3231630
[7]Elliot D G,Chen J J 1977 U.S.Patent 5660603
[8]Happel J,Hnatow M A,Meyer H 1994 Ann.N.Y.Acad.Sci. 715 412
[9]Kang S P,Lee H,Lee C S,Sung W M 2001 Fluid Phase Equilib.185 101
[10]Park J,Seo Y T,Lee J W,Lee H 2006 Catal.Today.115 279
[11]Ma C F,Chen G J,Zhang S X,Wang F,Guo T M 2001 J. Chem.Ind.Eng.52 1113(in Chinese)[马昌峰、陈光进、张世喜、王峰、郭天民2001化工学报52 1113]
[12]Zhang S X,Chen G J,Guo T M 2004 J.Univ.Petrol.28 95 (in Chinese)[张世喜、陈光进、郭天民2004石油大学学报28 95]
[13]Li D L,Du J W,Fan S S,Liang D Q,Li X S,Huang N S 2007 J.Chem.Eng.Data 52 1916
[14]Li X S,Lu T,Chen Z Y,Yan K F,Li G 2009 Mod.Chem. Ind.29(10)37(in Chinese)[李小森、鲁涛、陈朝阳、颜克凤、李刚2009现代化工29(10)37]
[15]Zhu C Z,Zhang P X,Xu Q M,Liu J H,Ren X Z,Zhang Q L,Hong W L,Li L L 2006 Acta Phys.Sin.55 4795(in Chinese)[朱才镇、张培新、许启明、刘剑洪、任祥忠、张黔玲、洪伟良、李琳琳2006物理学报55 4795]
[16]Geng C Y,Wang C Y,Zhu T 2005 Acta Phys.Sin.54 1320(in Chinese)[耿翠玉、王崇愚、朱弢2005物理学报54 1320]
[17]Chen M J,Liang Y C,Li H Z,Li D 2006 Chin.Phys.15 2087
[18]Alavi S,Ripmeester J A,Klug D D 2005 J.Chem.Phys.123 024507
[19]Geng C Y,Wen H,Zhou H 2009 J.Phys.Chem.A 113 5463
[20]Chialvo A A,Houssa M,Cummings P T 2002 J.Phys.Chem. B 106 442
[21]Mao W L,Mao H K,Goncharov A F,Struzhkin V V,Guo Q Z,Hu J Z,Shu J F,Hemley R J,Somayazulu M,Zhao Y S 2002 Science 297 2247
[22]Storr M T,Taylor P C,Monfort J P,Eodger P M 2004 J.Am. Chem.Soc.126 1569
[23]Yan K F,Li X S,Chen Z Y,Li G,Tang L G,Fan S S 2007 Acta Phys.Sin.56 4994(in Chinese)[颜克凤、李小森、陈朝阳、李刚、唐良广、樊栓狮2007物理学报56 4994]
[24]Kirchner M T,Boese R,Billups W E,Norman L R 2004 J. Am.Chem.Soc.126 9407
[25]Smith W,Yong C W,Rodger P M 2002 Mol.Simul.28 385
[26]Berendsen H J C,Postma J P M,van Gunsteren W F,Hermans J 1981 In Intermolecular Forces:Proceedings of the Fourteenth Jerusalem Symposium on Quantum Chemistry and Biochemistry (Dordrecht:D.Reidel Publishing Co.)p331
[27]Bernal J D,Fowler R H 1933 J.Chem.Phys.1 515
[28]Dauber O P,Roberts V A,Osguthorpe D J,Wolff J,Genest M,Hagler A T 1988 Proteins:Struct.Funct.Genet.4 31
[29]Ewald P P 1921 Ann.Phys.64 253
[30]Allen M P,Tildeslay D J 1987 Computer Simulation of Liquids (Oxford:Clarendon Press)p156
[31]Nose S A 1984 Mol.Phys.52 255
[32]Chen Z L,Xu W R,Tang L D 2007 Practice and Theory of Molecular Simulation(Beijing:Chemical Industry Press)p4(in Chinese)[陈正隆、徐为人、汤立达2007分子模拟的理论与实践(北京:化学工业出版社)第4页]
[33]Cygan R T,Guggenheim S,van Groos A F K 2004 J.Phys. Chem.B 108 15141
[34]Greathouse J A,Cygan R T 2008The 6thInternational Conference on Gas Hydrates(Vancouver:British Columbia) p5529
[35]Udachin K A,Ratcliffc C I,Ripmeester J A 2001 J.Phys. Chem.B 105 4200
[36]Zhou Z E,Xue C Y,Yang Q Y,Zhong C L 2009 Acta Chim. Sin.67 477(in Chinese)[周子娥、薛春瑜、阳庆元、仲崇立2009化学学报67 477]
[37]Zhang L,Wang Q,Liu Y 2007 J.Phys.Chem.B 111 4291
[38]Babarao R,Jiang J W 2008 Langmuir 24 6270
[39]Ota M,Ferdows M 2005 JSME Int.J.48 802
[40]Van Klaveren E P,Michels J P J,Schouten J A 2001 J.Chem. Phys.115 10500
[41]Kim D Y,Lee H 2005 J.Am.Chem.Soc.127 9996
PACC:8230L,6185
*Project supported by the National Natural Science Foundation of China(Grant Nos.20773133,20676133),the Science and Technology Program of Guangdong Province,China(Grant No.2009B050600006),the Main Direction Program of the Knowledge Innovation of Chinese Academy of Sciences(Grant No.KGCX2-YW-3X6),the National High Technology Research and Development Program of China(Grant No. 2006AA05Z319),the Natural Science Foundation of Guangdong Province,China(Grant No.07301638)and the Major Program for the Scientific Research Equipment of Chinese Academy of Sciences(Grant No.YZ200717).
†Corresponding author.E-mail:lixs@ms.giec.ac.cn
Molecular dynamics simulation of CO2separation from integrated gasification combined cycle syngas via the hydrate formation*
Yan Ke-Feng Li Xiao-Sen†Chen Zhao-Yang Xu Chun-Gang
(Key Laboratory of Renewable Energy and Natural Gas Hydrate,Guangzhou Institute of Energy Conversion,Chinese Academy of Sciences,Guangzhou510640,China)
(Guangzhou Center for Gas Hydrate Research,Chinese Academy of Sciences,Guangzhou510640,China)
(Received 27 August 2009;revised manuscript received 26 October 2009)
Molecular dynamics(MD)simulation is used to study the microscopic mechanism of CO2separation from integrated gasification combined cycle(IGCC)syngas(CO2/H2)via the hydrate formation.The stable structures and microscopic properties of CO2hydrate,H2hydrate,and CO2/H2hydrate from one stage separation for IGCC syngas are investigated systematically.The binding energy for loading the hydrate structure with the guest molecules,ΔEn,was analyzed.It was shown that the binding between CO2and water is more stable than that between H2and water.That is,CO2can more easily form the hydrate.Therefore,CO2in the CO2/H2gas mixture more easily transfers into the hydrate phase.Based on this,CO2can be separated from the IGCC syngas.The binding energy for loading the single cavity with the guest molecules,ΔEGH,was analyzed.It was found that the gas mixture can form structureⅠ(SⅠ)hydrate,in which CO2molecules preferably occupy the big cavity and then occupy the small cavity,and H2molecules only occupy the small cavity.The simulation was carried out at pressure of 8.5 MPa and temperature of 273.7 K for the stable structure of the CO2/H2hydrate in one stage separation for IGCC syngas.From the ΔEnand ΔEGHof the systems with H2single and double occupancy in the small cavity,it is concluded that the configurations with the single occupancy is most stable.The stable structure of the hydrate in one stage separation is attained by MD.It provides a theoretical evidence of CO2separation for formation hydrate in IGCC syngas.
separation by forming hydrate,molecular dynamics simulation,integrated gasification combined cycle syngas,CO2separation
book=220,ebook=220
*国家自然科学基金(批准号:20773133,20676133)、广东省科技计划(批准号:2009B050600006)、中国科学院知识创新工程重要方向性项目(批准号:KGCX2-YW-3X6)、国家高技术研究发展计划(批准号:2006AA05Z319)、广东省自然科学基金(批准号:07301638)和中国科学院重大科研装备研制计划(批准号:YZ200717)资助的课题.
†通讯联系人.E-mail:lixs@ms.giec.ac.cn
