eNOS基因多态性与急性高山病低氧运动习服效果的关联研究
2010-09-06周文婷邢亚卫衣龙彦
周文婷,胡 扬,徐 飞,邢亚卫,衣龙彦
eNOS基因多态性与急性高山病低氧运动习服效果的关联研究
周文婷,胡 扬,徐 飞,邢亚卫,衣龙彦
目的:研究eNOS基因的G894 T和4B/4A位点多态性与急性高山病(AMS)的发生及其低氧运动习服效果的关系。方法:阶段1:在模拟海拔4 800 m低氧环境中,61名北方汉族大学生急性暴露6 h,其中,入舱30 min后以恒定负荷蹬车20 min(70 r/min),LLS量表评价AMS。阶段2:恢复1周后,48名受试者在模拟环境下进行3周(2 h/天,4 d/周)渐进式低氧训练,海拔高度分别为2 500 m、3 500 m和4 800 m。恢复1周后,重复阶段1的低氧暴露和运动,LLS量表评价AMS。以PCR-RFLP法检测受试者eNOS基因G894T和4B/4A位点的基因型和等位基因频率。结果:阶段1中,49.2%的受试者发生AMS,G894T不同基因型和等位基因携带者的AMS发生率无显著差异,4A基因携带者的AMS发生率显著高于4B携带者。低氧运动前、后,受试者AMS评分的分布频率具有非常显著性差异, 60.4%的受试者低氧耐受力增强,4A携带者AMS的低氧习服效果更好。结论:间歇性低氧暴露辅以运动对AMS的低氧习服效果显著,4A等位基因是AMS易感性及其低氧习服效果的遗传学标记。
基因多态;急性高山病;发生率;低氧运动习服
1 前言
急性高山病(Acute Mountain Sickness,AMS)指高原暴露时,因高原低氧在数小时至数天内出现的临床综合征,临床表现由轻到重分为急性轻症高原病、高原肺水肿(HAPE)和高原脑水肿(HACE)[4]。研究发现,增加氧摄入量和促进利尿可促进AMS的习服,故当前普遍采用阶梯适应及服药的方法预防AMS[13]。然而,前者耗费大量人力、物力和时间,服药又多伴有各种副作用,故寻找更有效的方法促进高原习服,降低AMS的发生及严重程度具有重要的研究价值。已知急性低氧暴露期内进行运动会加重AMS,而适当剂量的低氧暴露和/或训练对改善、缓解AMS具有积极作用[7]。
研究表明,急进高原人群中AMS的发生率约为30%~80%,以阶梯适应的方式进入高原虽可明显减少AMS的发生,但仍有30%的人发病,可见确有AMS易感者[3]。家族研究发现,AMS具有遗传易感性,一些影响关键酶活性的基因多态性可能涉及其中,从而使个体表现出AMS发生及习服效果的巨大差异。因此,探寻AMS发生及其习服效果的遗传学标记,不仅可深入理解AMS的病理遗传机制,也为未来AMS的个性化预防和控制提供了可行性依据。
世居高原人血浆内NO浓度显著高于世居平原人,表明其肺部内皮具有更高的NO合成水平[6]。NO是内皮毛细血管中已知最主要的舒血管物质,由血管内皮细胞上的eNOS合成分泌,其氧化产物NOx则与个体低氧下的机能紊乱有关[5]。本研究模拟4 800 m低氧环境,急性暴露辅以运动,使受试者出现AMS症状。对受试者施以3周渐进式低氧训练,观察低氧运动对AMS的减缓程度。通过基因解析,本研究首次对我国世居平原北方汉族男性eNOS基因G894 T及4B/4A位点多态性与AMS发生及其低氧运动习服效果的关系进行了探索。
2 材料与方法
2.1 实验对象与样本
61名普通男性大学生参与阶段1的研究,其中,48名参与后续阶段2的研究。受试者身体健康,无神经系统、心肺、心血管系统疾病及吸烟史;均为北方汉族世居平原者(海拔<800 m),主要来自山东、河北以及东北三省。实验前6个月未经高原和(或)低氧暴露(海拔≥1 500 m)。受试者实验前填写PARQ问卷,签署知情同意书。空腹抽取静脉血5 mL,EDTA-Na2抗凝,分离白细胞,-20℃保存。
2.2 方法
2.2.1 运动及低氧暴露
阶段1:受试者于低氧舱(模拟海拔4 800 m,FIO210.4%~10.8%,Tm 20℃~24℃,相对湿度46%~67%,气压1 014 hPa~1 021hPa)暴露6 h。进舱后休息30 min,然后进行30 min的运动测试:在GE Ergoselect 1000 LP型卧式功率车上仰卧休息5 min后,以恒定负荷(80 W,60 rPm)蹬车20 min,恢复5 min,运动终止标准参照[9]。运动结束后,受试者在6 h的剩余时间内静息暴露。采用LLS量表评价AMS[8],运动前和运动后即刻、低氧暴露4 h和6 h结束时记录AMS评分。将受试者6 h急性低氧暴露结束时AMS评分≥3者定为AMS。
阶段2:恢复1周后,受试者进行3周(2 h/天,4 d/周)间歇性低氧暴露(Intermittent Altitude Exposures,IAE)辅以运动,模拟海拔高度分别为2 500 m(1周)、3 500 m (1周)和4 800 m(1周)。控制运动强度,使受试者在上述低氧环境下运动时的SPO2分别处于90%~92%、< 88%和<75%水平,运动形式跑步、蹬车可选。恢复1周,重复阶段1,LLS量表评价AMS。
2.2.2 基因多态分析
采用Promega公司试剂盒提取基因组DNA。PCRRFLP法解析G894T及4B/4A位点基因型。PCR扩增引物应用Primier 5.0软件设计完成。
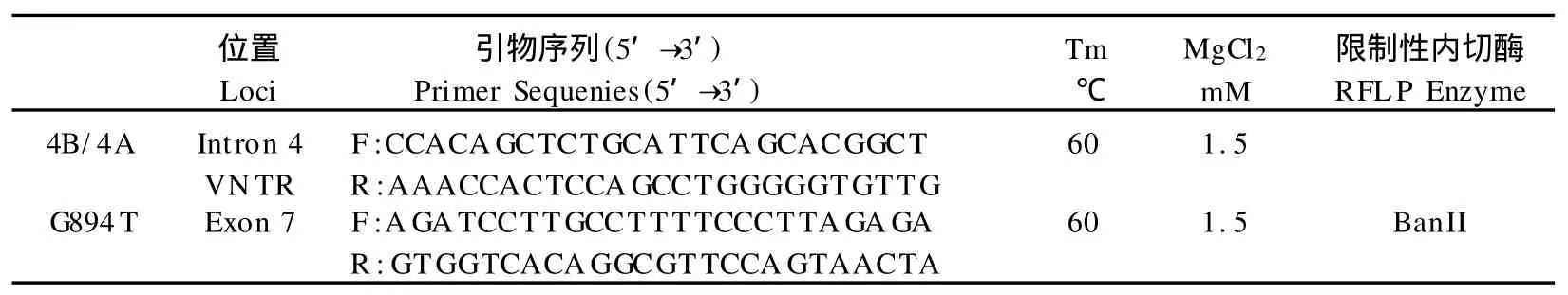
表1 本研究eNOS基因多态分析引物序列及反应条件一览表Table 1 Primers and PCR-RFLP Conditions for Polymorphism Analysis of eNOS G ene
以平均值±标准差(X±S)描述组内的AMS评分水平;基因型及等位基因频率差异用Mantel-Hanenszeχ2检验,应用SPSS 16.0软件包完成统计分析,统计学显著性水平定为0.05,非常显著性水平定为0.01。
2.3 统计方法
3 结果
阶段1中,受试者的AMS评分为2.7±2.1,发生AMS与未发生AMS受试者的AMS评分分别为4.3±1.7和1.1±0.9。49.2%(30/61)受试者发生AMS,评分值区间为0~10。受试者G894T及4B/4A位点的基因型和等位基因分布均符合Hardy-Weinberg平衡(P<0.05),不同基因型和等位基因携带者AMS的发生比率见表2。在G894T位点,GG、GT和TT基因型携带者的AMS评分分别为4.0±1.4、2.1±1.5和2.8±2.2,不同基因型和等位基因携带者的AMS发生率无显著差异;在4B/4A位点,BB、4B/4A和AA基因型携带者的AMS评分分别为3.0±2.1、3.0±0.0和2.6±2.1,4A基因携带者的AMS发生率显著高于4B携带者(χ2=5.15,df=1,P<0.05)。
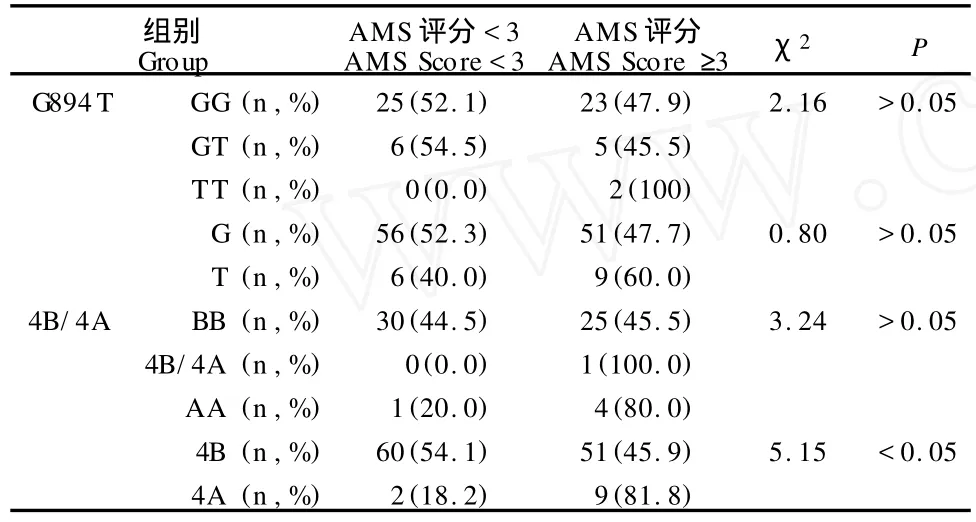
表2 本研究G894T和4B/4A位点不同基因型和等位基因携带者AMS的发生比率一览表Table 2 AMS Frequencies in Different G enotypes and Alleles at G894Tand 4B/4A Loci
受试者低氧运动前后的AMS评分分布参见表3,受试者的AMS评分为1.4±1.6,发生与未发生AMS受试者的AMS评分分别为4.0±1.2和0.8±0.8,18.7%(9/ 48)的受试者发生AMS,评分值区间为0~6,评分分布频率在低氧运动前、后差异非常显著(χ2=10.83,df=1, P<0.01)。低氧运动后,受试者的AMS评分60.4%(29/ 48)出现下降,27.1%(13/48)不变,12.5%(6/48)出现上升。G894T和4B/4A位点不同基因型和等位基因携带者AMS评分变化分布见表4。在G894T位点,低氧运动后基因型GG、GT和TT携带者的AMS评分分别为2.0± 1.4、0.9±1.1和1.5±1.7,不同基因型和等位基因携带者的AMS评分变化趋势间无显著差异;在4B/4A位点,低氧运动后基因型BB、4B/4A和AA携带者的AMS评分分别为1.5±1.6、0.0±0.0和0.6±1.3,4A和4B等位基因携带者的AMS评分变化趋势差异显著(χ2=8.14,df =1,P<0.05),且4A携带者的AMS评分均出现下降。

表3 本研究受试者低氧运动前后AMS评分分布一览表Table 3 Distribution of AMS Scores in Subjects before and after Exercise in Hypoxia
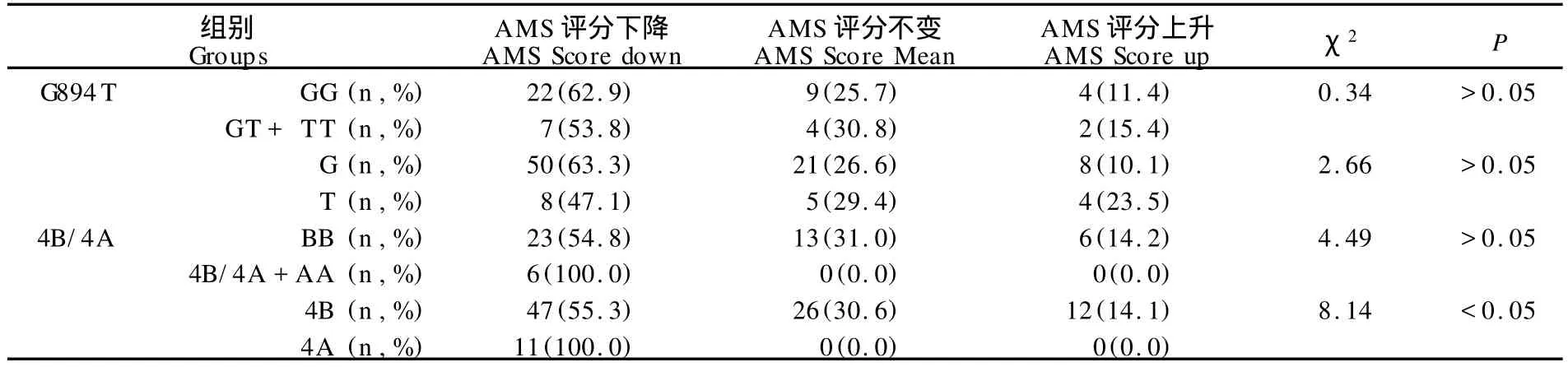
表4 本研究G894T和4B/4A位点不同基因型和等位基因携带者AMS评分变化分布一览表Table 4 Distribution of Changes in AMS Scores of Different G enotypes and Alleles at G894Tand 4B/4A Loci
4 讨论与分析
运动量和爬升速度与AMS的发生有关。研究发现,与快速进入高原的主动参与者相比,被动参与者和缓慢进入高原的主动参与者其AMS发生率要低得多[1]。Roach等研究了模拟海拔4 300 m低氧暴露初期间歇运动对AMS发生及程度的影响。结果发现,受试者在间歇训练时比在静息时,无论AMS发生率还是其严重程度都较高,其中,86.0%受训者出现AMS,而静息时该比例仅为14.0%[1]。Beidleman等研究了低氧环境下运动对SPO2的影响,结果发现,在海拔4 300 m环境中以60%~70% ˙VO2max强度运动时,受试者SPO2的下降水平与在5 000~5 500 m静息时相似,推断低氧下的运动可在不增加海拔高度的前提下加重受试者的低氧负担[7]。鉴于上述原因,本实验采用模拟海拔高度4 800 m暴露6 h的低氧剂量,辅以30 min的恒定负荷运动。结果发现,49.2%的受试者发生AMS,与海拔3 000 m真实高原中AMS发生率相似[4],成功构建了适于AMS研究的急性低氧暴露模型。
虽然,研究发现世居平原人通过IAE可完全对AMS免疫[11,12],但Beidleman等的研究首次对IAE在AMS习服中的作用进行了定量分析[7]。结果发现,模拟海拔4 300 m环境下,3周IAE辅以运动可提高世居平原人的安静通气量和SaO2,降低AMS的发生率和严重程度。本研究同样采用3周IAE辅以运动的实验计划。结果发现,运动前、后受试者的AMS评分由2.7±2.1变为1.4±1.6,发生与未发生AMS的受试者其AMS评分由4.3±1.7和1.1 ±0.9变为4.0±1.2和0.8±0.8;受试者的AMS评分在低氧运动前、后的分布频率发生非常显著性差异(χ2= 10.83,df=1,P<0.01),发生AMS的受试者比率显著减少(49.2%→18.7%),60.4%的受试者AMS评分出现下降,说明本研究方案对世居平原人适应低氧环境、减轻AMS程度效果明显,可作为预防和控制AMS的可行方法。当然,我们也注意到本研究中受试者表现出的个体差异,尤其是12.5%的受试者在低氧运动后出现AMS评分的上升,指出了本研究方案的局限性。针对个体差异调整IAE剂量和运动强度,使运动方案更具个性化,这无疑是未来AMS防控研究的重点,而基因多态研究似乎为此指明了方向。
世居高原人血浆内的NO浓度显著高于世居平原人,表明其肺部内皮具有更高的NO合成水平[3]。eNOS通过“精氨酸-NOS-瓜氨酸”途经合成NO,其基因突变可能影响eNOS的功能及活性,降低NO的生成[11]。研究发现,在G894T位点,GG基因型频率较高者其血清NO水平明显高于GG基因型频率较低者,且具有更好的低氧适应能力[5]。在4B/4A位点,因其多态性影响了eNOS转录后mRNA的转录剪接过程,导致AA基因型携带者的血清NO水平较BB型携带者显著降低了23.0%,从而使4B基因携带者表现出更好的低氧适应能力[1]。
本研究中,G894 T位点基因型GG、GT和TT在受试者中的比率分别为78.7%、18.0%和3.3%,等位基因G和T的比率分别为87.7%和12.3%,与本实验室保存的北方汉族人遗传数据库(未发表)及文献报道的日本普通人相比差异不显著[2],与我国普通汉族人及英国普通白人相比均有显著性差异[2],说明G894 T突变存在地域和种族差异。在4B/4A位点,基因型BB、4B/4A+AA在所有受试者中的比率分别为90.2%和9.7%,等位基因4B和4A的比率分别为91.0%和9.0%,与中国南方人及文献报道的日本人结果基本一致[1],但等位基因4A的比率非常显著低于白种人[2],说明eNOS基因4B/4A多态性存在种族差异,但在中国人中无地域差异。
本研究首次对G894T和4B/4A位点多态性与AMS发生及其低氧习服的关系进行了探索。结果发现,在G894T位点,不同基因型和等位基因携带者的AMS发生率无显著性差异,GG、GT和TT基因型携带者的AMS评分在低氧运动前、后的变化趋势亦不显著(χ2=0.19,df= 2,P>0.05),说明该位点与AMS的发生和低氧习服效果无关,不支持“GG基因型频率较高者低氧适应能力较高”的结论[5]。究其原因,可能与研究的样本数量、种族和地域因素有关,故需要更多、更深入的研究以明确该位点与低氧敏感性的关联。而在4B/4A位点,等位基因4B和4A携带者的AMS发生率分别为45.9%和81.8%,后者的AMS发生率显著高于前者,表明4A基因是AMS易感性的遗传学标记,4A基因携带者是低氧敏感者,与“4B等位基因携带者具有更好的低氧适应能力”的说法[1]不谋而合。本研究还发现,低氧运动前、后该位点不同基因型携带者的AMS评分下降趋势非常显著(χ2=12.70,df=2, P<0.01),其中,4A携带者的AMS评分均出现下降,推测4A携带者更易受IAE与运动的影响,从而具有更好的习服效果,故可作为未来AMS研究的重点关注人群,通过设计适合其特点的低氧运动计划,可有效控制此人群的AMS发生和程度,从而为AMS防控的个性化实施提供了可能。
[1]刘学军,陈盛强,柳息洪.广东汉族人群内皮细胞型一氧化氮合酶4b/a基因多态性[J].国际医药卫生导报,2003,9(8):24-26.
[2]魏丹宏,李伟胡,颖红,等.我国汉族正常人群一氧化氮合酶基因G894T突变的观察[J].淅江大学学报,2003,32(5):415-418.
[3]郑然.急性高原病易感人群预测模型、方法研究[D].重庆:第三军医大学硕士学位论文,2005.
[4]周文婷,胡扬.内分泌、遗传及运动——急性高原病发病机理、预测、诊断和干预[J].北京体育大学学报,2008,31(10):1342-1345.
[5]AHSAN A,NORBOO T,BAIG MA,et al.Simultaneous selection of the wild-type genotypes of the G894T and 4B/4A Polymorphisms of NOS3 associates with high-altitude adaptation[J]. Ann Hum Genet,2005,69:260-267.
[6]BEALL C M.,LASKOWSKI D,STROHL K P,et al.Pulmonary nitric oxide in mountain dwellers[J].Nature,2001,414:411-412.
[7]BEIDLEMAN B A,ROCK P B,MUZA S R,et al.Exercise Ve and physical performance are not affected by menstrual cycle phase at altitude[J].J Appl Physiol,1999,86:1519-1526.
[8]BEIDLEMAN B A,MUZA S R,FULCO C S,et al.Intermittent altitude exposures reduce acute mountain sickness at 4300m[J]. Clin Sci(Lond),2004,106(3):321-328.
[9]CASAS M,CASAS H,PAGES T,et al.Intermittent hypobaric hypoxia induces altitude acclimation and improves the lactate threshold[J].Aviat Space Environ Med,2000,71:125-130.
[10]HONIGMAN B,THESIS M K,KOZIOL-MCLAIN J.Acute mountain sickness in a general tourist PoPulation at moderate altitude[J].Ann Intern Med,1993,118:587-592.
[11]MONCADA S.The L-arginine-nitricoxide pathway[J].New Engl J Med,1993,329(27):2002-2012.
[12]MILLEDGE J S.Altitude medicine and Physiology including heat and cold:A review[J].Travel Med Infect Dis,2006,4(3-4):223-237.
[13]PURKAYASTHA S S,RAY U S,ARORA B S,et al.Acclimatization at high altitude in gradual and acute induction[J].J Appl Physiol,1995,79:487-492.
[14]ROACH R C,MAES D,SANDOVAL D,et al.Exercise exacerbates acute mountain sickness at simulated high altitude[J].J Appl Physiol,2000,88(2):581-585.
[15]RODRIGUEZ F A,CASAS H,CASAS M,et al.Intermittent hypobaric hypoxia stimulates erythropoiesis and improves aerobic capacity[J].Med Sci Sports Exercise,1999,31:264-268.
[16]TSUKADA T,YOKOYAMA K,ARAI T,et al.Evidence of association of the ecNOS gene Polymorphism with Plasma NO metabolite levels in humans[J].Biochem Biophys Res Commun,1998,245(1):190-193.
Research Related to the Effects of Polymorphisms of eNOS on the Sports Hypoxia Acclimatization to Acute Mountain Sickness
ZHOU Wen-ting,HU Yang,XU Fei,XIN G Ya-wei,YI Long-yan
Objectives:To study the effects of polymorphisms of eNOS at G894 T and 4B/4A loci on incidence and the sports hypoxia acclimation to Acute Mountain Sickness(AMS).Methods:Phase 1:61 students,all male Chinese Han origin lowlanders,were involved in a 6h acute exposure to 4800m altitude-equivalent.Within 30 min of arriving at altitude,volunteers exercised at constant work rate for 20min on a cycle ergometer(70r/min),then rested for the remainder of the 6h altitude exposure.Incidence and severity of AMS symptoms were determined using the LLS.Phase 2:After 1wk of rest,48 volunteers completed an exercise performance testing in a 3wk period of intermittent altitude exposures(IAE)(2h/d,4d/wk)which was undertaken in 2500m,3500m and 4800m,respectively.Restore 1wk,repeat Phase 1.Incidence and severity of AMS symptoms were determined using the LLS.PCR-RFLP was used to determine the genotypes and alleles frequencies of eNOS at G894 T and 4B/4A loci.Results:In Phase 1,49.2%individuals satisfied the diagnostic criteria for AMS.No significant differences of AMS incidence were detected in different genotypes and alleles at G894 T loci,while AMS incidence in 4A allele carriers was remarkably higher than that in 4B carriers.Before and after exercising in hypoxia,the frequency distribution of AMS scores in subjects was significant different.60.4%volunteers won better hypoxia tolerance and 4A allele carriers had better hypoxia acclimation to AMS.Conclusions:Training in IAE is remarkable effective for the hypoxia acclimation to AMS.Allele 4A is one of the genetic marks for the incidence and the hypoxia acclimation to AMS.
polymorphism;acute mountain sickness;incidence f requency;sports hy poxia acclimation
G804.7 文献标识码:A
1000-677X(2010)06-0072-04
2010-03-22;
2010-05-12
周文婷(1979-),女,黑龙江哈尔滨人,讲师,主要研究方向为运动分子生物学及低氧训练,Tel:(010)62989210, E-mail:springzwt@126.com;胡扬(1958-),男,江苏扬州人,教授,博士,博士研究生导师,主要研究方向为运动分子生物学及低氧训练,Tel:(010)62989208,E-mail: hyyr1@163.com。
北京体育大学,北京100084 Beijing Sport University,Beijing 100084,China.
