不同龋敏感儿童变异链球菌临床分离株合成胞外多糖能力的实验研究
2010-09-05杨江华曹元书刘兴容
杨江华,曹元书,刘兴容
(泸州医学院附属口腔医院,四川 泸州 646000)
变异链球菌是乳牙龋患儿口腔中的主要致龋菌,合成胞外多糖的能力是其致龋的重要条件之一。变异链球菌的葡糖基转移酶(Glucosyl transferases,GTF)可利用蔗糖合成细胞外多糖,包括水溶性葡聚糖和水不溶性葡聚糖。细胞外多糖对细菌在载体表面的附着以及细菌之间的集聚、维持生物膜的结构、提供营养等方面均起着十分重要的作用[1]。因此,研究细菌合成胞外多糖的能力对于细菌的致龋性研究有着重要意义。本实验拟采用蒽酮法[2]比较不同龋敏感儿童变异链球菌临床分离株合成水溶性及水不溶性葡聚糖的能力,为进一步研究儿童龋病的发病特点和预防措施奠定基础。
1 资料与方法
1.1 主要的仪器和设备 厌氧培养箱YQX型(上海跃进医疗器械厂);紫外可见分光光度计UV-1100型(北京瑞利分析仪器公司);定时磁力搅拌器JB-90-1型(上海天平仪器厂);低频离心机TDL-40B型(上海安亭科学仪器厂)。
1.2 实验菌株及细菌培养 变异链球菌国际标准菌株(S.mutans)ATCC 25175(血清型C)由四川大学华西口腔医学院教育部口腔生物医学工程重点实验室提供。变异链球菌临床分离株前期实验分离得到的不同龋敏感儿童口腔变异链球菌111株,其中高龋组44株,中龋组36株,无龋组31株[高龋者:龋失补指数(dmft)≥6,中龋者:6>dmft≥4,无龋者:dmft=0]。变异链球菌临床分离株和国际标准株常规复苏,经鉴定为纯培养后,挑取单个菌落转种于脑心浸液肉汤(BHI)液体培养基,厌氧(80%N2、10%H2、10%CO2)培养24 h,镜检无污染后,3000 r/min,离心15 min,弃上清,收集细菌,无菌生理盐水洗菌两次,用无菌生理盐水调整为于紫外分光光度计540 nm处吸光度A=1.0的菌悬液,备用。
1.3 实验方法
1.3.1 样品的制备 取各变异链球菌临床分离株菌悬液,按菌液与含1%蔗糖的BHI液体培养基1:10(v/v)比例接种细菌,37℃厌氧培养24 h后,3000 r/min,离心20 min,收集上清液,细菌沉淀物用5 ml蒸馏水洗涤、离心两次,三次上清液合并;水洗后的细菌加入0.5 mol/L NaOH 5 ml洗涤、离心三次,合并上清液。两部分上清液各取适量,分别加入三倍体积无水乙醇,4℃冰箱放置过夜,离心,弃水相,沉淀分别加入5 ml蒸馏水及5 ml 0.1 mol/L NaOH溶液溶解,备用。
1.3.2 蒽酮试剂和葡聚糖标准储存液的制备 蒽酮试剂的配制:取200 mg蒽酮(Anthrone,上海生工生物有限公司)溶解于100 ml的浓硫酸中,搅拌溶解,放入4℃冰箱保存。葡聚糖标准储存液的配制:称取1.0 g分子量为9000 Da的葡聚糖(北京天佑达生物工程有限公司)溶于100 ml蒸溜水中做储存液,使用时取1.0 ml稀释至100 ml,保存于4℃冰箱中。
1.3.3 标准曲线的绘制 分别取葡聚糖稀释液0.00 ml、0.05 ml、0.10 ml、0.20 ml、0.30 ml、0.40 ml、0.60 ml、0.80 ml,加入蒸馏水至1.00 ml,在 15℃水浴中加入蒽酮试剂3.00 ml,搅拌3 min后放入95℃水浴中煮6 min,冷却,分别在分光光度计625 nm处比色,绘制标准曲线。
1.3.4 样品的测定 取样品1.0 ml,加蒽酮试剂3 ml,95℃水浴6 min,冷却,紫外光分光光度计测定625 nm处的吸光度。
1.4 统计学方法 采用SPSS11.0统计软件中的one-way ANVOA分别对不同细菌合成水溶性葡聚糖和水不溶性葡聚糖能力进行统计分析(α=0.05)。
2 结果
2.1 标准曲线回归方程的估计 用葡聚糖标准品溶液和蒽酮法测标准曲线进行葡聚糖浓度标准曲线回归方程估计。回归公式:y(葡聚糖量)=A+Bx,系数A=-0.00136,回归系数B=0.07306,判定相关系数 R2=0.999。y=0.07306x-0.00136,P<0.05,差异有统计学意义。
2.2 合成胞外多糖的测定 不同龋敏感儿童变异链球菌菌株合成胞外多糖的结果如表1。
表1数据显示,不同菌株之间无论是合成水溶性葡聚糖还是水不溶性葡聚糖能力差异均有统计学意义(P<0.05)。组间进行两两比较,发现高、中龋组细菌合成细胞外多糖的量和标准株合成细胞外多糖的量无明显不同,但是与无龋组之间的差异有统计学意义(P<0.05)。
表1 不同龋敏感儿童变异链球菌合成胞外多糖的比较(±s,mg/L)
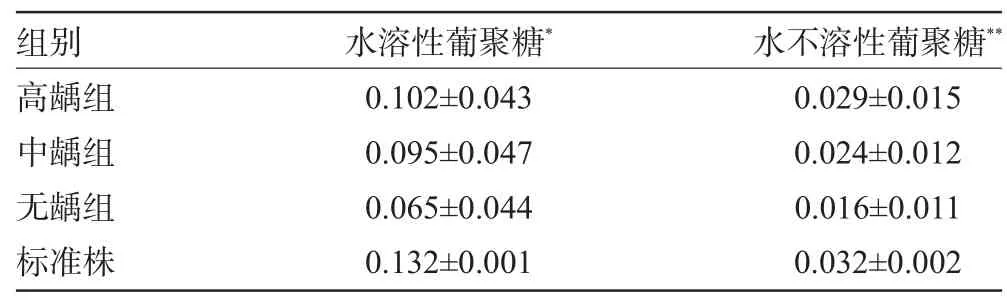
表1 不同龋敏感儿童变异链球菌合成胞外多糖的比较(±s,mg/L)
注:*F=4.504,P<0.05,**F=6.958,P<0.05。
组别水不溶性葡聚糖*水溶性葡聚糖*高龋组中龋组无龋组标准株0.029±0.0150.024±0.0120.016±0.0110.032±0.0020.102±0.0430.095±0.0470.065±0.0440.132±0.001
在高龋组发现有部分菌株无论是合成水溶性葡聚糖还是水不溶性葡聚糖的量均高于其他菌株,如16-1、20-3、18-2、11-1号菌株。来自中龋组的15-2、1-1号菌株合成胞外多糖的能力也高于其他菌株;有部分菌株合成水溶性葡聚糖的量明显高于其他菌株,如高龋组和中龋组中间的2-3、16-3、20-1、12-1号菌株。但是来自无龋组的菌株6-3号合成水溶性葡聚糖的量也很高。实验还发现无论是高、中龋组变异链球菌还是无龋组变异链球菌合成水溶性葡聚糖的量均多于水不溶性葡聚糖的量。
3 讨论
变异链球菌是牙菌斑生物膜中的优势菌,与龋病的发生有密切关系[3]。它能利用蔗糖合成胞外多糖,促使牙菌斑生物膜的形成和稳定的维持。因此细胞外多糖的产量是变异链球菌致龋能力的一个衡量指标。
本研究发现高龋和中龋组儿童变异链球菌临床分离株在体外合成的水溶性和水不溶性葡聚糖量均显著高于无龋组变异链球菌。而且研究还发现有部分菌株合成的水溶性和水不溶性葡聚糖量都明显高于其他菌株,这些菌株大多来自高龋组,中龋组也有少量的几株,这提示有变异链球菌高致龋毒力株存在的可能,而且高毒力株主要存在于高龋组中,这与前期产酸耐酸实验结果一致[4];同时,还发现有一株来自无龋组,可能是无龋组菌株发生了基因突变。国内黄晓晶等[5]对恒牙龋的研究显示高龋组个体定植的合成水不溶性及水溶性葡聚糖能力强的菌株所占比例显著高于无龋组,本实验结果与其一致。Alaluusua等[6]的研究发现龋活跃幼儿与无龋幼儿口腔中不同基因型变异链球菌合成细胞外多糖的能力不同,但细胞外多糖合成能力不同的菌株在两组的分布差异没有统计学意义。Mattos-Graner等[7]的研究结果则显示变异链球菌水不溶性葡聚糖合成与乳牙龋发病率呈正相关。
本实验还发现无论是高、中龋组变异链球菌还是无龋组变异链球菌合成的水溶性葡聚糖均多于水不溶性葡聚糖,这与国内学者研究结果一致。程茜等[8]通过酚硫酸法研究变异链球菌胞外多糖合成的能力,结果表明变异链球菌水溶性葡聚糖合成能力强于水不溶性葡聚糖。刘琪等[9]用Seff蒽酮定糖法对变异链球菌Ⅰ型Mutans和Ⅲ型Sobrious合成葡聚糖进行研究,结果发现变异链球菌Ⅰ型Mutans合成水溶性葡聚糖的能力高于水不溶性葡聚糖。
迄今已证实变异链球菌具有3种葡萄糖耐量因子(GTF),分别合成水溶性及水不溶性葡聚糖。并且,不同血清型变异链球菌产生的GTF在结构、性质上都存在差异。各种血清型中,C型合成的水溶性葡聚糖较多,D型合成的水不溶性葡聚糖较多[10]。变异链球菌还可以按遗传性分为Ⅰ-Ⅵ型,而在人类口腔中血清型C的遗传Ⅰ型变异链球菌最多,检出率高达80%[11]。这可能是导致本实验不同龋敏感儿童口腔变链菌临床分离株合成水溶性葡聚糖含量多于水不溶性葡聚糖的原因。
有研究表明,GTF及其合成的水不溶性葡聚糖在变链粘附中起重要作用。而Ⅰ型变异链球菌的粘附主要由变异链球菌表面的粘附素和唾液的受体介导完成,不依赖GTF及其合成的水不溶性葡聚糖。由此可以推测,在变异链球菌在牙面的粘附作用中,可能主要依赖唾液的介导,较少依赖于葡聚糖。对于不同基因型致龋能力不同的原因,变异链球菌致龋高毒力株在龋病发生过程中的具体作用机制以及合成水溶性和水不溶性葡聚糖的差异是否对变异链球菌的粘附产生影响,有待进一步的研究。
[1]徐蓉蓉,葛剑平,胡 涛,等.不同生存状态下变异链球菌合成胞外多糖的研究[J].临床口腔医学杂志,2005,21(2):79-81.
[2]周学东.口腔生物化学[M].成都:四川大学出版社,2002:254-255.
[3]周学东,肖晓蓉.口腔微生物学[M].成都:四川大学出版社,2002:202-224.
[4]曹元书,刘兴容.不同龋敏感儿童变异链球菌临床分离株产酸、耐酸能力的实验研究[J].口腔医学杂志,2009,25(1):103-106.
[5]黄晓晶,刘天佳,杨锦波,等.高龋及无龋者变异链球菌临床分离株致龋性研究Ⅱ合成细胞外多糖能力的实验研究[J].华西口腔医学杂志,2000,18(6):419-421.
[6]Van Ruyven FOJ,Lingstrom P,Van Houte J,et a1.Relationship among mutans streptococci,“low-pH”bacteria,and lodophilic polysaccharide producing bacteria in dental plaque and early enamel caries in humans[J].J Dent Res,2000,79(2):778-784.
[7]Mattos-Graner RO,Smith DJ,King WF,et a1.Water-insoluble glucan synthesis by mutans streptococcal strains correlates with caries incidence in l2-to 30-month-old children[J].J Dent Res.2000,79(6):l37l-l377.
[8]程 茜,刘艳玲.变异链球菌和远缘链球菌的可溶性多糖和不溶性多糖的测定[J].口腔医学,2000,20(3):124-125.
[9]刘 琪,罗宗莲,周学东.变异链球菌I型和Ⅲ型合成葡聚糖的研究[J].广东牙病防治,2000,8(1):10-12.
[10]Tsumori H,Kuramitsu H.The role of the Streptococcus mutans glucosyltransferases in the sucrose-dependent attachment to smooth surfaces:essential role of the GtfC enzyme[J].Oral Microbiol Immunol,1997,12(5):274-277.
[11]Kozai K,Nakayama R,Tedjosasongko U,et al.Intrafamilial distrib-ution of mutans Streptococci in Japanese families and possibility of father-to-child transmission[J],Microbiol Immunol,1999,43(2):99-106.
