组织工程化软骨分泌蛋白的初步蛋白质组学分析
2010-09-02刘霞周广东刘伟曹谊林
刘霞 周广东 刘伟 曹谊林
组织工程化软骨分泌蛋白的初步蛋白质组学分析
刘霞 周广东 刘伟 曹谊林
目的通过蛋白质组学筛选组织工程化软骨分泌的可溶性蛋白中具有软骨诱导作用的因子。方法分别培养人软骨细胞与皮肤成纤维细胞,接种到PGA上,两种细胞-材料复合物培养2周后,移至无血清培养基中培养6 d,并收集所有培养液,用于差异蛋白质组学分析。结果蛋白组学分析显示有21个差异点。对其中差异最大的点作质谱分析,显示该蛋白与Col2A1异构体2最为匹配。结论用蛋白质组学方法,可以高通量筛选软骨细胞分泌的,与软骨分化相关的重要蛋白;Col2A1异构体2可能与软骨分化有关。
组织工程化软骨蛋白质组学诱导因子
我们的前期研究已证实,软骨细胞提供的组织微环境能够诱导骨髓间充质干细胞(BMSCs)向软骨分化[1-2],特别是软骨细胞分泌的可溶性因子发挥了重要的诱导作用[3]。但是,尚不清楚究竟是哪些可溶性因子在发挥作用。
可溶性因子成分种类繁多,需要采用大容量、多因素的方法进行分析,蛋白质组学是比较合适的研究手段[4]。因此,我们收集软骨细胞-材料复合物和成纤维细胞-材料复合物的培养液,期望通过蛋白质组学分析,比较两者分泌蛋白的差异,初步筛选可能具有诱导作用的因子。
1 材料与方法
1.1 取材来源
流产胎儿,4~6月龄,性别不限,由411医院提供,获家属知情同意。
1.2 三维支架材料制备
[5]的方法,将聚羟基乙酸(PGA)均匀地嵌入圆柱状硅胶模具内定型,消毒后置于六孔板内备用。
1.3 胎儿关节软骨细胞的分离、培养、扩增及接种
于无菌条件下切取胎儿部分关节软骨,切成约2mm×2mm×1mm大小的软骨块。加入0.1%胶原酶NB4,37℃下消化2 h,弃上清,换0.05%胶原酶NB4消化过夜,过滤、离心、洗涤,以含10%FBS的低糖DMEM培养液制成细胞悬液。以3×104cells/cm2密度接种于培养皿内,置于37℃、5%CO2、100%饱和湿度的培养箱中培养,每3天换液1次。细胞生长达到90%融合时,以0.25%胰蛋白酶+0.02%EDTA消化、传代。将第一代细胞接种到PGA支架材料,每个培养孔内加入5 mL常规培养液,于37℃、5% CO2、100%饱和湿度的培养箱中培养。
1.4 胎儿皮肤成纤维细胞的分离、培养、扩增及接种
取胎儿背部皮肤组织,去除皮下脂肪后加入0.1%中性蛋白酶,4℃下消化过夜,揭去表皮层。真皮组织以0.1%胶原酶NB4于37℃下消化8 h,过滤、离心、洗涤,加入含10%FBS的低糖DMEM培养液制成细胞悬液,以2×104cells/cm2的密度接种于培养皿,置于37℃、5%CO2、100%饱和湿度的培养箱中培养,每3天换液1次,细胞生长达85%融合后传代。将第二代细胞接种到PGA支架,每个培养孔内加入5 mL常规培养液,于37℃、5%CO2、100%饱和湿度的培养箱中培养。
1.5 蛋白质组学分析
1.5.1 培养液收集
细胞-材料复合物培养2周后,用PBS冲洗3次,换成无血清培养液培养,48 h收集一次培养液,收集3次。收集的培养液以2 000 r/min离心8min,取上清置于-80℃冰箱备用。由中国科学院上海生命科学研究院蛋白质组研究分析中心完成蛋白质组学研究。
1.5.2 样品的蛋白浓缩
样品经超滤、除盐和浓缩后,进行蛋白定量。双向电泳采用12.5%聚丙烯酰胺凝胶(SDS-PAGE),上样量50μg,IEF为pH值3~10非线性胶条(电泳条件:30 V、10 h,500 V、1 h,1 000V、1 h,8 000 V、8 h,500 V、4 h),电泳至溴酚蓝距离胶下沿0.5 cm,然后银染、扫描,获得图谱。对样品之间量变情况进行分析,采用Image Master软件分析报告(C lass report ratio≥1.5),所有差异点比较均为P<0.05。
1.5.3 质谱分析
取分泌差异最大的蛋白点作质谱分析。胶内胰酶酶解20 h,抽提酶解肽段。Zip Tip脱盐后,液相色谱-电喷雾离子化质谱(ESI-MS)检测。全扫描后采集10个碎片图谱(MS2 scan),用Bioworkers软件搜索IPIhuman蛋白库,得到鉴定的蛋白质结果。过滤参数为:当Charge+1,Xcorr≥1.9;当Charge+2,Xcorr≥2.2;当Charge+3,Xcorr≥3.75;其中DelCN≥0.1。
2 实验结果
2.1 胎儿软骨细胞与成纤维细胞的生长情况
原代软骨细胞12~24 h贴壁,贴壁时呈圆形,伸展后呈多角形,以类似同源细胞群的生长方式形成独立小群体,5 d左右可达90%汇合,传代后成多角形,细胞增大。
原代成纤维细胞约48 h贴壁,贴壁时呈小三角形或长梭形,约7 d达到85%以上汇合,传代后增殖速度加快,呈长梭形或细长纺锤形,细胞排列有一定方向性(图1)。
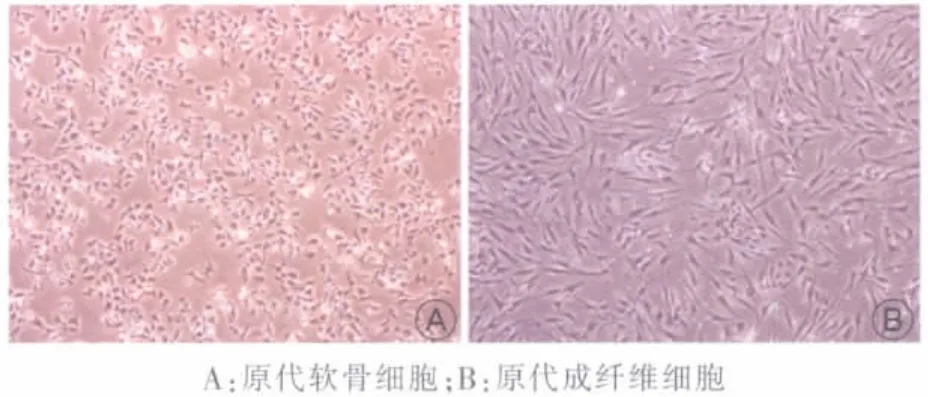
图1 倒置显微镜下细胞形态(40×)
2.2 二维电泳
取50μg蛋白上样,得到比较理想的二维电泳图谱,背景较好,蛋白点的迁移也基本稳定。取软骨细胞-材料复合物的培养液浓缩蛋白,重复3次二维电泳实验,分别分离出1 670、2 194和2 076点;同法处理成纤维细胞-材料复合物的培养液浓缩蛋白,分别分离出1 984、2 296和1 847点(图2)。以软骨细胞-材料复合物分泌蛋白的电泳胶作为参考胶,与成纤维细胞-材料复合物分泌蛋白的电泳胶比较,找到21个差异点。

图2 二维电泳结果显示两者比较有21个差异点
2.3 质谱分析
取软骨细胞较成纤维细胞分泌差异最大的蛋白点进行质谱分析,显示该蛋白与Col2A1异构体2最为匹配。
3 讨论
既往研究证实,软骨细胞-材料复合物分泌的可溶性因子作为一个整体诱导因素,能够单独诱导BMSCs向软骨分化、并形成软骨组织[3]。我们认为,这些可溶性因子是软骨微环境发挥软骨诱导作用的重要因素之一。软骨细胞能够分泌TGF-β、IGF等多种生长因子,在软骨细胞的增殖与分化中发挥重要作用[6-7]。但是,尚不清楚这些因子或其他因子,在诱导BMSCs向软骨分化中是否也发挥重要作用。
蛋白质组学是对基因组编码的所有蛋白质,即蛋白质组进行大规模研究的一门科学[5]。蛋白质组学技术具有大规模、高通量等优点,可用于研究复杂的多种细胞因子和蛋白质的变化,因而已逐渐成为干细胞和组织工程领域新的研究热点[8-9]。前期研究中,我们发现软骨细胞-材料复合物分泌的可溶性因子能够诱导BMSCs向软骨分化,而成纤维细胞-材料复合物分泌的可溶性因子却没有成软骨诱导作用。因此,我们希望通过对这两种细胞-材料复合物所分泌可溶性蛋白的差异蛋白质组学研究,筛选软骨细胞分泌的、具有软骨诱导作用的可溶性因子。
软骨细胞高表达的蛋白对软骨分化有正向诱导作用的可能性较大,因此以软骨细胞分泌蛋白的2-D胶作为参考胶,与成纤维细胞分泌蛋白比较,共找到21个差异点。我们取软骨细胞较成纤维细胞高表达,且分泌水平差异最大的蛋白进行质谱分析,发现其与Col2A1异构体2的同源性最高。
Ⅱ型胶原为软骨细胞特异性分泌的蛋白。Ⅱ型前胶原根据不同的剪接方式有两种表达形式,Col2A和Col2B。其中Col2A仅在软骨前体细胞和软骨聚集和生长区域表达,而已分化的软骨细胞仅分泌Col2B[10-11]。Col2A前胶原的氨基端能够与BMP-2、TGF-β相结合,诱导体内、外软骨形成[12-13]。关于Col2A1异构体2在软骨细胞中的表达情况及其在软骨分化中的作用,迄今尚无报道。我们发现,Col2A1异构体2在软骨细胞-材料复合物分泌的蛋白中特异性高表达,推测它可能在软骨分化中也具有一定的诱导作用。
在后续研究中,我们将对其他差异蛋白进行分析,并在此基础上通过诱导实验和中和抗体阻断实验,进一步筛选出能诱导BMSCs向软骨分化的因子。此外,Col2A1异构体2在软骨分化中的作用,也是我们今后的研究重点之一。
参考文献
[1]周广东,苗春雷,曹谊林,等.软骨细胞与骨髓基质细胞共培养体外软骨形成的实验研究[J].中华医学杂志,2004,84(20):1716-1720.
[2]刘霞,周广东,曹谊林,等.软骨细胞与骨髓基质干细胞共培养软骨构建的体内评价[J].中华医学杂志,2007,87(27):1929-1933.
[3]刘霞,周广东,曹谊林,等.组织工程化软骨分泌的可溶性因子对骨髓基质干细胞诱导作用的实验研究[J].中华整形外科杂志, 2010,26(3):215-220.
[4]James P.Protein identification in the post-genome era:the rapid rise of proteomics[J].Q Rev Biophys,1997,30(4):279-331.
[5]刘霞,周广东,曹谊林,等.人真皮成纤维细胞体外构建组织工程化软骨的初步探索[J].中华整形外科杂志,2009,25(6):447-450.
[6]Grimaud E,Heymann D,Redini F.Recent advances in TGF-beta effects on chondrocyte metabolism.Potential therapeutic roles of TGF-beta in cartilage disorders[J].Cytokine Growth Factor Rev, 2002,13(3):241-257.
[7]Trippel SB.Growth factor actions on articular cartilage[J].J Rheumatol Suppl,1995,43:129-132.
[8]PrudhommeW,Daley GQ,Zandstra P,et al.Multivariate proteomic analysis of murine embryonic stem cell self-renewal versus differentiation signaling[J].Proc Natl Acad Sci USA,2004,101(9): 2900-2905.
[9]Wang D,Park JS,Chu JS,etal.Proteomic profiling ofbonemarrow mesenchymal stem cells upon transforming growth factor beta1 stimulation[J].JBiol Chem,2004,279(42):43725-43734.
[10]Zhu Y,Oganesian A,Keene DR,et al.Type IIA Procollagen containing the cysteine-rich amino propeptide is deposited in the extracellularmatrix of prechondrogenic tissue and binds to TGF-beta 1 and BMP-2[J].JCell Biol,1999,144(5):1069-1080.
[11]Sandell LJ,Morris N,Robbins JR,etal.Alternatively spliced typeⅡprocollagen mRNAs define distinct populations of cells during vertebraldevelopment:differential expression of theamino-propeptide [J].JCell Biol,1991,114(6):1307-1319.
[12]Denker AE,Nicoll SB,Tuan RS.Formation of cartilage-like spheroids bymicromass cultures ofmurine C3H10T1/2 cells upon treatmentwith transforming growth factor-beta1[J].Differentiation, 1995,59(1):25-34.
[13]Wang EA,Rosen V,D’Alessandro JS,et al.Recombinant human bonemorphogenetic protein induces bone formation[J].Proc Natl Acad Sci USA,1990,87(6):2220-2224.
Prelim inary Proteom ic Analysis of Proteins Secreted by Tissue-engineered Cartilage
LIU Xia1,ZHOU Guangdong2, LIUWei2,CAO Yilin1,2.
1 Plastic Surgery Institute,Plastic Surgery Hospital,Chinese Academy of Medical Science,Beijing 100144,China;2 Department of Plastic and Reconstructive Surgery,Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School ofMedicine,Shanghai200011,China.Corresponding author:ZHOU Guangdong.
ObjectiveTo screen the chondrogenic factors in soluble proteins secreted by the engineered cartilage using proteomic approach.M ethodsHuman chondrocytes and dermal fibroblastswere collected,and then seeded onto the PGA scaffolds.At 2 weeks,the two types of cell-scaffold constructswere cultured in serum-freemedia for 6 days.All the serumfree media were collected for proteomic analysis.ResultsThe proteome maps showed 21 difference spots.On mass spectrometry(MS),the protein showing the most significant difference of expression matched best with alpha 1 typeⅡcollagen isoform 2.ConclusionProteomic approach is a high throughoutmethod to screen the important chondrogenic factors secreted by the tissue-engineered cartilage.Alpha 1 typeⅡcollagen isoform 2 may be related to chondrogenic differentiation.
Tissue engineered cartilage;Proteomics;Inductive factors
book=145,ebook=17
Q816
A
1673-0364(2010)03-0145-03
10.3969/j.issn.1673-0364.2010.03.006
2010年3月3日;
2010年4月10日)
国家重点基础研究发展规划项目(973项目)(2005CB522702);国家高技术发展计划项目(863项目)重大专项(2006AA02A126);高等学校博士学科点专项科研基金(200800231078);国家自然科学基金项目(30801192,30973131,30772264);上海市曙光计划(08SG19);上海市启明星跟踪计划(09QH1401600)。
100144北京市中国医学科学院整形外科医院(刘霞,曹谊林);200011上海交通大学医学院附属第九人民医院整复外科(周广东,刘伟,曹谊林)。
周广东。
