纳米镍粉催化剂上硝基苯加氢还原反应性能研究
2010-09-01刘红,姜坤
刘 红,姜 坤
(淮南联合大学 化工系,安徽 淮南,232038)
纳米镍粉催化剂上硝基苯加氢还原反应性能研究
刘 红,姜 坤
(淮南联合大学 化工系,安徽 淮南,232038)
本文以NiSO4.6H2O、NaOH和H2为原料,采用低温固相法制备了分布均匀、平均粒径在20~35nm纳米镍粉,并采用XRD、TEM、SEM和XPS等微观分析手段对产物表面结构和价态进行了表征.研究了纳米镍粉加氢还原硝基苯制备苯胺体系中温度、氢压力、催化剂用量等因素对转化率的影响,并和Raney Ni做了比较.结果表明:纳米镍粉催化加氢活性高于Raney Ni,是同条件下Raney Ni的 9倍左右;催化剂用量在4%wt~6%wt之间,温度为120℃为还原的最佳条件,同时也发现氢压力对转化率也有着较大影响.当压力达到0.8Mpa时,硝基苯转化为苯胺的转化率率高达76.42%.
固相合成;纳米镍粉;硝基苯;加氢还原
1 引言
超细镍粉、特别是纳米镍粉具有极大的体积效应和表面效应,在磁性、内压、热阻、光吸收、化学活性剂等方面显示出许多特殊性质.它作为一种新型材料,越来越备受关注.目前,纳米镍粉的独特性能引起了研究者的关注.制备纳米镍粉的方法也多种多样,如:辐射法[1]、低压喷雾热解法[2]、液相还原法[3、4]、水热合成法[5]等都已经报道.而固相合成纳米镍粉至今尚无相关报道.
固相合成是最近发展的新研究领域,它以操作简单,不需要溶剂、几乎无污染和收率高等优点备受关注[6].但是目前固相合成主要用于有机合成,其次是无机合成,而在纳米材料的合成中还没有被广泛应用.本文采用固相法合成纳米镍粉,成功的制备了分布均匀、平均粒径在20~35nm纳米镍粉.由于此方法操作简单,不需要溶剂、几乎无污染等优点而具有广泛的应用前景.另外,本文也考察了纳米镍粉对硝基苯催化加氢的活性,并同Raney Ni做了比较.
2 实验部分
2.1 催化剂制备
实验所用NiSO4.6H2O、NaOH等均为分析纯(AR),H2由氢气发生器制备.取一定量的NiSO4.6H2O和NaOH,以摩尔比为1:2在研钵中研磨20min,试样在研磨过程中先逐渐变成草绿色粘块状,然后变干,最后变为草绿色粉末.粉末经过去离子水和95%乙醇交替洗,其中去离子水洗涤至无SO42-离子(用0.01mol/L的BaCl2检测),最后一次用95%乙醇洗去其中的水,得到草绿色粉末.绿色粉末经过烘箱110℃烘干8个小时,然后在马弗炉中350℃焙烧4h,得到的是黑色纳米NiO粉末作为前驱体.最后利用还原装置,在400℃条件下,对NiO粉末加H2还原4h,得到灰黑色粉末状产物.
2.2 催化剂表征
所得样品采用日本 MAC Science公司生产的M03XHF22型全自动X射线仪进行XRD分析,选用Cu靶 X射线,功率为3KVA,管压为30KV,管流为20mA,扫描速度是0.03°/s,并用Scherrer公式D=Kλ/βCOSθ进行粒径大小计算,其中K常数为0.9,仪器宽化0.2,λ=1.54178θ的X光,β为半峰宽θ是衍射角.TEM采用荷兰Philips公司TECNAI12型透射电子显微镜,试样超声分散在无水乙醇中,然后沉积在铜网上干燥后观察并计算粒径尺寸;XPS分析采用美国PHI公司生产的5300型X光电子能谱仪进行分析,条件:以C1S的电子结合能284.6eV作为内表,
2.3 催化剂活性评价
纳米镍粉催化剂的催化加氢活性评价是在大连通产高压釜容器制造有限公司生产的0.5LFDK型高压釜中进行,所采用的催化剂是在400℃条件下,NiO粉末加H2还原4h得到的产物,加H2还原硝基苯制备苯胺,反应体系压力在0.23MPa~0.80MPa.还原硝基苯实验,选用适量的镍纳米粉和100ml的硝基苯依次加入高压釜,其中催化剂用量在2% wt~12%wt之间.实验前均用H2将釜内的空气置换三次,在设定温度80℃~160℃下加氢还原.在同样的条件下,以Raney Ni做催化剂加H2还原硝基苯制备苯胺,比较两者催化活性.同时实验还考察了反应温度、氢压力、催化剂用量等因素对硝基苯加氢制备苯胺转化率的影响.还原产物分别采用TRACE GC 2000-DSQ气质联用和美国Agilent公司生产的6890N GC进行定性和定量分析.
3 结果与讨论
3.1 XRD结果
样品XRD谱如图1所示.参照JCPDS卡可知产物分别为β-Ni(OH)2、六方晶系NiO和立方晶系Ni粉.由图1(1)的衍射峰可以看出Ni(OH)2的为纳米级,并且粒径很小,采用Scherrer公式估算出其平均粒径为5.7nm.图1(2)衍射峰显示经过350℃焙烧4h得到的产物黑色NiO仍为颗粒比较小的纳米粒子,由Scherrer公式估算其平均粒径为8.8nm纳米.图1(3)的衍射峰显示,经过还原得到的灰黑色Ni粒子仍为纳米级,同样计算出平均粒径约为34.0nm.由XRD图可以看出,随着实验的进行,得到的各步产物粒径逐渐增大如表1所示.同时经大量实验证明:第一步制备出的粒径小、分布均匀的纳米Ni(OH)2是制备纳米NiO和纳米Ni粉的关键步骤.此过程中,结晶水和研磨时间是室温固反应的关键.反应过程中,结晶水在粒子的表面形成一个液膜,给分子生长创造了一个微型溶液环境,这一步是整个室温固相反应的重要因素;另外,大量的研磨也为分子间结合提供机会[6].


表1 产物的颜色和粒径比较
3.2 TEM和SEM结果
样品的TEM和SEM结果如图2所示,由图2(a)可以看出制备出的Ni(OH)2是纳米线,由图2(b)的TEM图可以看出制备的Ni(OH)2疏松多孔,并且以团聚的方式存在,这是因为纳材料的表面能大的原因.从图2(c)可以看出制备的NiO颗粒很小、难分散,平均粒径在8nm左右,和XRD的结果一致.图2(d)显示NiO颗粒也是疏松多孔,团聚成球形,但是比Ni(OH)2较为紧凑.图2(e)是制备的Ni粉的TEM结果,由图可以看出,制得的纳米镍粉分散均匀、球形、粒径在30nm左右,和XRD的结果一致.同时图2(f)SEM显示纳米镍粉比Ni团聚的更为紧凑.通过一系列的TEM和SEM可以得到,经过每一步处理以后的样品粒径逐渐增大,并且团聚的方式越来越紧凑,说明处理过程的温度,时间等条件对产物的形貌和颗粒的大小有影响.
3.3 XPS结果
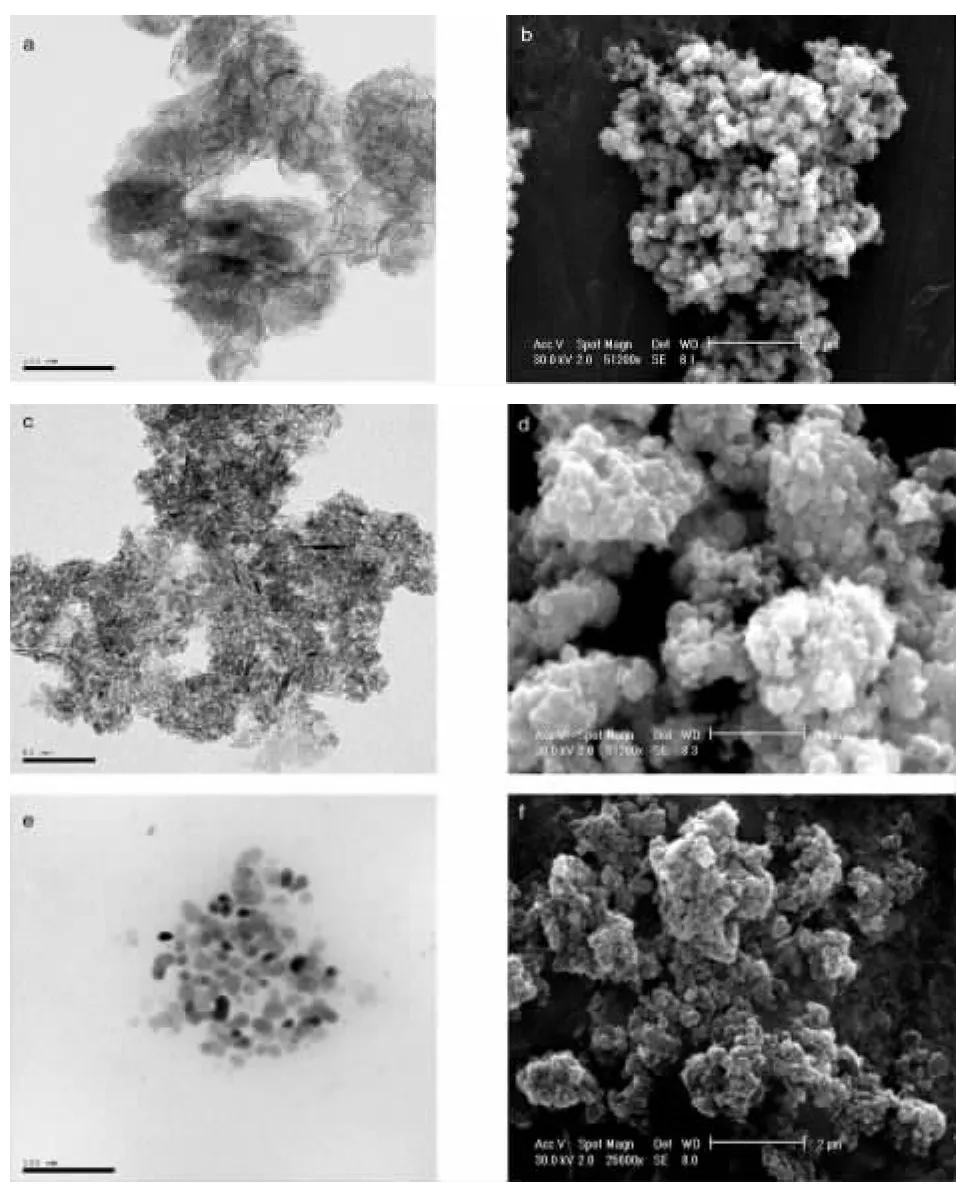
图2 产物T E M和S E M图a.b-N i(O H)2T E M和S E M c.d-N i O的T E M和S E M e.f-N i的T E M和S E M
图3是制备的纳米镍粉的光电子能谱.以C1s的电子结合能285.2eV作为内表,得到镍的Ni(2p3/2)、Ni(2p1/2)相对应光电子结合能分别为852.2eV、870.5eV,比标准的XAES数据库的Ni(2p3/2)852.7eV特征电子结合能略小.但谱图的特征峰不是以对称形式存在,说明产物不是单一零价镍粉,这是因为我们制备的纳米镍粉活性很高,还原以后没有用惰性气体保护而表面被氧化,其中有可能存在着氧化态的Ni.由此光电子能谱可以得出,制备的纳米镍粉主要是零价镍,在与空气接触后表面出现氧化,有少量高价镍存在.

图3400 ℃还原4 h N i粉的X P S谱
3.4 催化剂活性评价

图4 催化剂用量与转化率关系
图4是反应温度为120℃,反应时间为10h,催化剂用量对转化率的影响.由图可以看出在催化剂用量在2.0% wt~6.0%wt之间,转化率随催化剂用量增加几乎成直线关系上升,催化剂用量6.0%wt时转化率为44.55%.当用量超过6%wt以后转化率增大的趋势变小,最后几乎成无太大影响,催化剂用量在10%wt以后转化率不随用量变化.图5是催化剂用量在4.13%wt,反应时间为10h的温度与转化率的关系.图上表明温度升高有利于转化率增加,当温度达到160℃时,转化率为52.15%,考虑设备的综合条件,120℃转化率为26.82%为反应的最佳温度.以下实验均在120℃条件下进行.
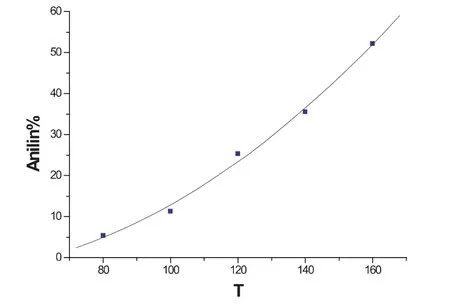
图5 反应温度与转化率关系
表2是催化剂用量为4.13%wt,反应温度120℃,反应时间为10h及H2压力与硝基苯转化率的关系.由表2可以看出,H2压力对硝基苯转化率有着显著的影响,随着H2压力的增大,硝基苯转化率增大,这因为转化率与溶解在溶液的H2有关系,压力越大,溶解H2越多,越有利于硝基苯催化加氢.

表2 氢气压力和硝基苯转化率关系
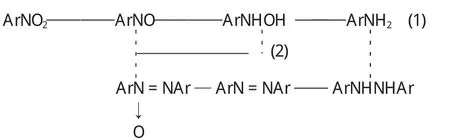
另外,我们比较了纳米镍粉和Raney Ni的催化活性.由实验结果可知,纳米镍粉加H2还原硝基苯选择性良好无副产物,400℃还原4h的催化剂用量为4.13%wt反应10h转化率最高达25.26%,是同条件下Raney Ni催化活性的9倍左右,并且Raney Ni的反应中有相对大量的副产物生成.一方面,因为Raney Ni制备中含有杂质和苛性碱处理存在大量微孔影响了其催化活性及选择性,另一方面,可能因为两者的反应机理不同的原因如上:纳米镍粉反应是按路线(1),而Raney Ni作为加氢催化剂反应沿路线(2).其中,Raney Ni作为加氢催化剂反应由于产生连二苯胺是其选择性不如纳米镍粉选择性高的原因[7].
4 结论
4.1 采用固相法合成纳米镍粉,通过对还原影响因素研究和数据处理得到:在400℃下还原4h是制备的最佳条件,得到的纳米分为均匀、球形颗粒,平均粒径为30nm;
4.2 自制纳米镍催化剂活性好、选择性高,400℃还原4h产物含量 4.13wt%催化加 H2还原硝基苯转化率最高为
26.82 %,是同条件Raney Ni活性的9倍左右;氢气压力对转化率有较大影响,转化率随压力增大很明显,压力为0.8MPa时,硝基苯转化率高达76.42%.
〔1〕S.Kapoor,H.G.Salunke,A.K.Tripathi,S.K.Kulshreshtha,J.P.Mittal;Materials Research Bulletin 35 (2000):143-148.
〔2〕Wei-Ning Wang,Yoshifumi Itoh,I.Wuled Lenggoro, Kikuo Okuyama;Materials Science and Engineering B 111(2004):69-76.
〔3〕Kwang Ho Kim,Yoon Bok Lee,Eun Young Choi, Hee Chan Park,Seong Soo Park;Materials Chemistry and Physics 86(2004):420-424.
〔4〕KwangHoKim,YoonBokLee,SangGeunLee, HeeChan Park,Seong Soo Park;Materials Science and Engineering A 381(2004):337-342.
〔5〕C.Wang,X.M.Zhang,X.F.Qian,Y.Xie,W.Z. Wang,and Y.T.Qian;PII S0025-5408(98):00180-9.
〔6〕Xiaohong Liu,Lan Yu;Materials Letters 58(2004):1327-1330.
〔7〕左东华,张志琨,崔作林等;纳米镍在硝基苯加氢中催化性能的研究[J].分子催化,1995,9(4):298—302.
T Q 426.81
A
1673-260X(2010)08-0016-03
项目来源:安徽省高校青年教师资助项目(2008jq1173),淮南联大校级项目(LYB0802)
