微生物谷氨酰胺转胺酶对大豆分离蛋白凝胶性的影响
2010-08-31何冬兰彭宝玉欧阳林兰
何冬兰,彭宝玉,张 莹,欧阳林兰
(中南民族大学微生物与生物转化重点实验室,武汉430074)
微生物谷氨酰胺转胺酶对大豆分离蛋白凝胶性的影响
何冬兰,彭宝玉,张 莹,欧阳林兰
(中南民族大学微生物与生物转化重点实验室,武汉430074)
利用Strep toverticilliumsp.CJ3033菌株发酵得到发酵液,经过滤、离心、冷冻浓缩、乙醇沉淀和冷冻干燥后,制得的谷氨酰胺转胺酶粗酶作用于大豆分离蛋白,利用物性分析仪研究了MTG对大豆分离蛋白形成凝胶的特性及持水性的作用.通过二次回归正交组合设计的方法研究了MTG的添加浓度、作用时间、处理温度对SPI凝胶形成及保水性的影响,结果显示:MTGase对大豆分离蛋白有显著改善作用,在51℃、反应1.5 h、酶浓度9.82 U/g时,SPI的凝胶强度最大,达74.95 g/mm2;在49℃、反应1.3 h、酶浓度7.78 U/g时,SPI的持水率为96.47%.
谷氨酰胺转氨酶;大豆分离蛋白;凝胶强度;持水性
大豆分离蛋白(Soybean Protein Isolate,SPI)主要用于食品生产的原料或添加剂,改善食品的营养和品质.因其具有较高的营养价值和独特的功能性质,已被广泛应用于食品加工各个领域.SPI本身虽具有一定的功能,但理想与否,需通过各种物理、化学手段对其进行改性和修饰,从而使其功能性质得到显著改善,以满足市场需求[1].
响应面分析法(Response SurfaceM ethodology,RSM),由一组数学和统计学方法组成,可用于确定各因素及其交互作用在加工过程中对非独立变量的影响,精确地表述因素和响应值之间的关系,是一种优化反应条件和加工工艺参数的有效方法,由于其合理的设计和优良的结果,已被越来越多的生物工程行业工作者采用[2].但目前还没有应用该方法研究谷氨酰胺转胺酶对大豆分离蛋白形成凝胶的影响的报道.
本实验采用酶法对植物蛋白SPI进行改性,采用响应面分析法对谷氨酰胺转胺酶对大豆分离蛋白凝胶性能及保水性的影响因素进行优化,以获得性能较好同时保水性亦好的凝胶,对SPI的工业化转化有现实的指导意义,同时为TGase进一步在食品及医药领域的广泛研究奠定基础.
1 材料与方法
1.1 材料
1.1.1 实验材料
大豆分离蛋白(SPI):购自天福园绿色健康产业有限公司;菌种:Strep toverticilliumsp.CJ3033,由中南民族大学生命科学学院分子微生物学实验室提供.
1.1.2 主要试剂和仪器
Nα-CBZ-Gln-Gly;L-glutam ic acid-r-monohydroxamate均购自Sigma公司;MTG作用于SPI后,利用TA.XT Plus物性测试仪(LLOYD英国劳埃德仪器公司)对SPI的凝胶强度进行测定.
1.2 方法
1.2.1 酶液的制备
菌种活化后转接至含25 mL发酵培养液的250 mL三角瓶中,于30℃、200 r/m in培养3 d后转接至10 L发酵罐发酵,接种量为5%~10%(体积比),于30℃、罐压0.02~0.03 M Pa、搅拌转速250 r/m in、pH 7.0~ 7.5、通气量 0.06 vvm(m3/(m3·m in))条件下发酵2.5 d,发酵液经过滤、真空泵抽滤、离心(4℃、12 000 r/m in,离心15 m in)得到发酵酶液,发酵酶液经真空冷冻干燥、乙醇沉淀、蒸馏水悬浮、冷冻干燥得到酶粉,-20℃贮存备用.
1.2.2 MTGase酶活测定
按照Grossw icz等方法[3]进行,以CBZ-Gln-Gly、盐酸羟胺为底物,以37℃催化形成氧肟酸1 μmol/m in所得酶量定义为一个酶活单位.
1.2.3 二次回归正交组合设计试验(响应面分析法)[4-8]
以反应时间、反应温度和酶活性为影响因素,各设5个水平(见表1).
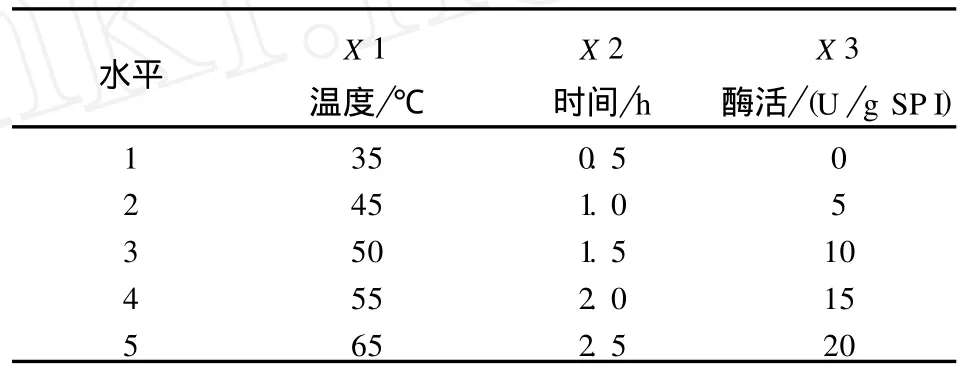
表1 因素水平编码表Tab.1 Factors and levels of testing
按表2进行正交试验(正交试验组合共安排20组,其中8组正交实验,6组星号实验,6组零水平实验).
1.2.4 SPI凝胶性测定
利用10%(质量/体积)的SPI溶液按表2组合进行实验.反应完毕后用保鲜膜封口,90℃下处理30 m in后于4℃冰水中迅速冷却,最后置于4℃冰箱中保存16 h.16 h后采用TA.XT2物性测试仪,用穿刺实验法测定.
室温下采用质构仪进行穿刺实验,探头为P/0.5平端柱形探头,轴向压缩2次/样品,压缩比45%;测试前速度5.0mm/s,测试速度3mm/s,测试后返回速度3 mm/s;中间间隔5 s,测试总时间150 s.
凝胶强度定义:单位面积凝胶破裂所需的力(g).
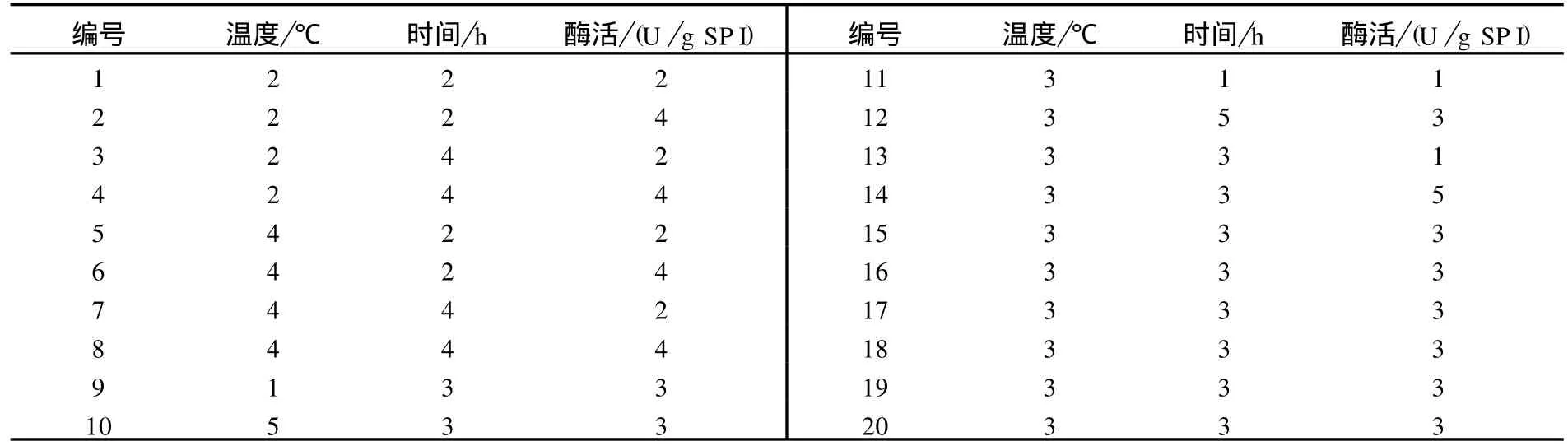
表2 MTGase处理正交表Tab.2 O rthogonal table onMTG treatment
1.2.5 SPI持水性测定
用餐巾纸拭去凝胶表面的水分,按下式计算各组的持水量:
W HC=1-(W1-W2)/(W1-W0),其中,W0为烧杯重量,W1为酶反应前烧杯和酶溶液总重,W2为酶反应后烧杯和SPI凝胶总重.
2 结果与分析
2.1 酶活测定结果
根据L-谷氨酸γ-单羟肟酸的标准曲线,500 nm吸光值与氧肟酸浓度的线性关系:Y=0.002 76+0.098 63X,相关系数:R2=0.999 9,线性关系良好.通过公式计算可知该酶液的酶活为7.3 U/(mL·m in),粗酶粉酶活为3 650 U/(g·m in).
2.2 三因素五水平二次回归正交组合设计试验结果
根据表1设计的响应面实验条件,进行了20组实验,得到相应的凝胶强度数据(见表3).
保存16 h后观察各组凝胶形成情况,发现未加酶的13号几乎不能形成凝胶.呈流动状,其它的凝胶呈淡黄色且形成情况较好.
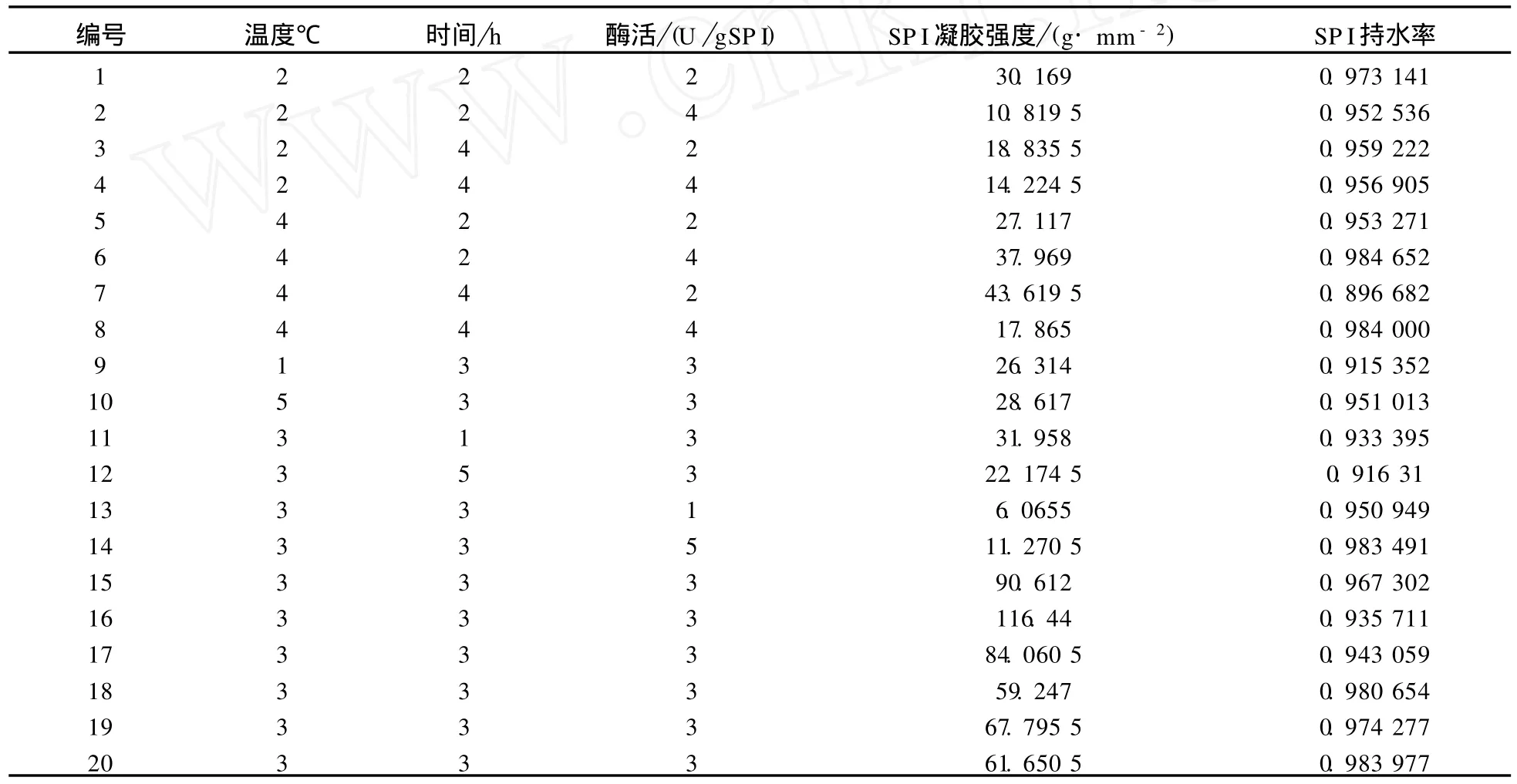
表3 二次回归通用旋转实验方案及结果Tab.3 Experimental plan and results of quadratic rotation-regression-combination design
2.3 MTG酶处理SPI凝胶强度SA S分析结果
2.3.1 SPI凝胶强度数学模型的建立
利用SA S软件对结果分析,经回归拟合后,各试验因子对凝胶强度y的影响可用下列函数表示:

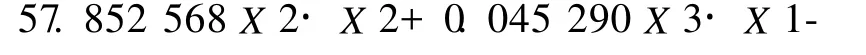
1.093 400X3·X2-0.762 508X3·X3,其中:X1,X2,X3分别为反应温度、反应时间、酶浓度.
利用SA S软件对结果运行SA S-RSR程序对20个实验点响应值进行回归分析,同时对回归得到的数学模型进行显著性分析(见表4).
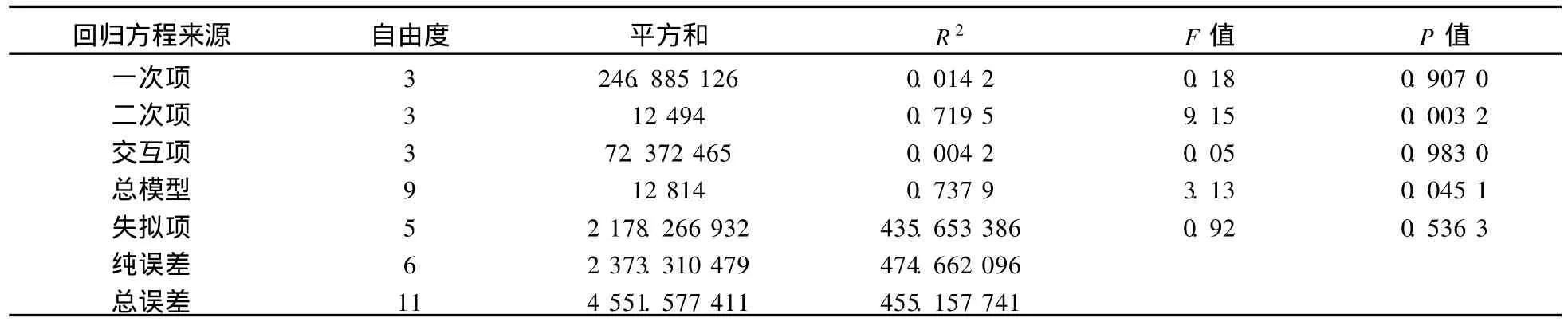
表4 回归方程各项的方差分析表(回归系数)Tab.4 Analysis of variance to the test result of the gel of SPI(regression coefficient)
回归方程的显著性F检验在0.01水平上不显著,方程的决定系数R2=0.737 9,说明试验所选因素对弹性有显著影响.拟合度F检验:F=0.92,P=0.536 3,结果不显著,说明本试验建立的回归模型是适合的,拟合不足被否定.
2.3.2 对各因素显著性的比较
由于各因素都对大豆分离蛋白凝胶强度值有贡献,比较各因素显著性结果见表5.
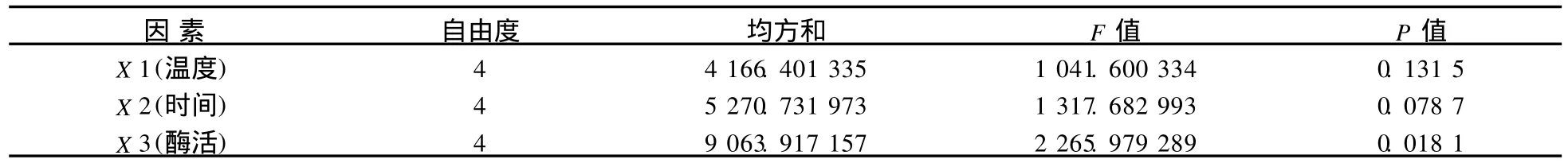
表5 影响大豆分离蛋白凝胶强度因素显著性的比较结果Tab.5 Variance analysis of factors affected SPIwater holding capacity
分析结果表明,在所选水平范围内,三因素对经MTG作用的SPI的凝胶性的影响从大到小依次为加酶量、反应时间、反应温度.
通过实验得出的酶最佳处理条件为50.961 841℃,反应1.469 934 h,加酶量9.816 903 U/g时大豆分离蛋白凝胶有最大凝胶强度即74.946 339 g/mm2(见表6).
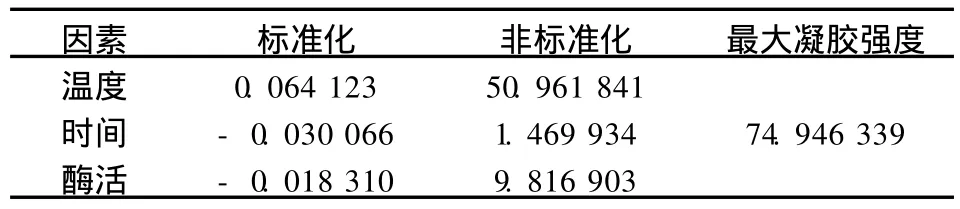
表6 SPI凝胶性在各因素下的优化值和最优条件下的最佳组合Tab.6 Best combination under the optim ization condition of the gel of SPI in each factor
2.4 MTG酶处理对SPI持水性SA S分析
利用SA S软件对结果分析,经回归拟合后,各试验因子对持水性Y的影响可用下列函数表示:

0.000 0467 72X3·X3,其中:X1,X2,X3分别为反应温度、反应时间、酶浓度.
根据设计的响应面实验条件(见表1),进行了20组实验,得到相应的凝胶保水率数据(见表3),找到各因素对TGase参与保持水分反应的相互影响,得到各因素之间的最佳组合.
利用SA S软件的结果运行SA S-RSR程序对20个实验点响应值进行回归分析,同时对回归得到的数学模型进行显著性分析(见表7).

表7 MTG对大豆分离蛋白持水性试验结果方差分析(回归系数)Tab.7 Analysis of variance in the testedWHC SPI byMTG(regression coefficient)
回归方程的显著性F检验在0.05水平上显著,方程的决定系数R2=0.763 9,说明试验所选因素对持水性有显著影响.拟合度F检验:F=0.44,P=0.805 6,结果不显著,说明本试验建立的回归模型是适合的,拟合不足被否定.
由于各因素都对大豆分离蛋白的W HC值有贡献,比较各因素显著性结果见表8.
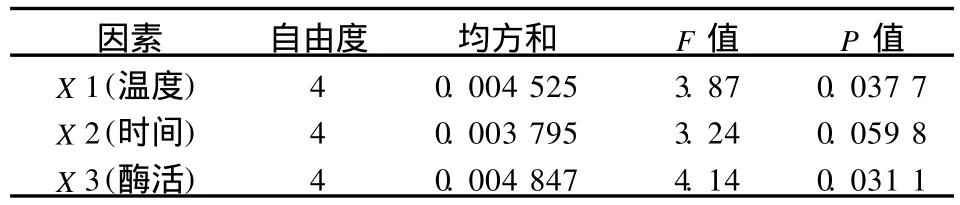
表8 影响大豆分离蛋白持水性因素显著性比较结果Tab.8 Variance analysis of factors affected SPI gel strength
分析结果表明,在所选水平范围内,三因素对经MTG作用的SPI持水性的影响从大到小依次为酶活量、反应温度、反应时间(见表9).
大豆分离蛋白凝胶持水性受酶作用条件的影响,当49℃、反应1.27 h、酶浓度为7.78U/g时,SPI的持水率最高,达到96.47%.
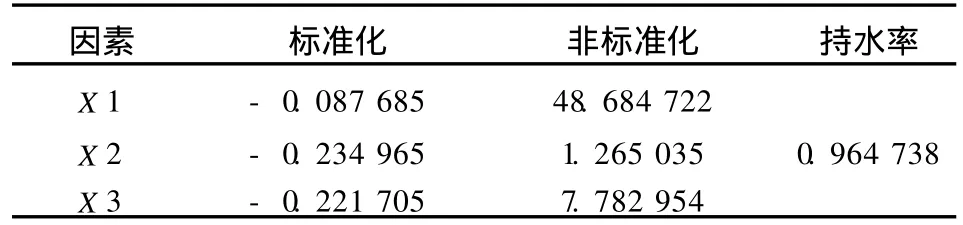
表9 最佳组合条件下的大豆分离蛋白凝胶持水性Tab.9 WHC of SPI gel under the optimum combination
3 结论
本实验证明响应面分析法能快速有效地从3种影响MTG对SPI凝胶形成的重要因素中实现条件优化并得出优化结果.研究表明:加酶量、反应时间、反应温度均对SPI凝胶的形成具有重要影响.MTG酶在一定范围内有助于SPI凝胶的形成.在51℃、反应1.5 h,酶浓度9.82 U/g时SPI有最大凝胶强度值74.95 g/mm2;在49℃,反应1.3 h,酶浓度7.78 U/g时SPI的持水率为96.47%.
[1]孙 焕,张春红,陈海英,等.复合改性提高大豆分离蛋白功能性的研究[J].生物技术通讯,2006,17(1):49-51.
[2]幕运动.响应面方法及其在食品加工业中的应用[J].郑州工程学院学报,2001,22(3):91-94.
[3]Grossow icz N,W ainfan E,Borek E.The enzymatic formation of hydroxam ic acids from glutam ine and asparagine[J].Biol Chem,1950,7(1):111-125.
[4]林德光.SA S教程[M].儋州:华南热带农业大学,1998:152.
[5]林德光.试验的设计与分析[M].儋州:华南热带农业大学,2000:255.
[6]杨 德.试验设计与分析[M].北京:中国农业出版社,2002:239-241.
[7]樊 欣,邵谦谦.SA S.8.X经济统计[M].北京:希望电子出版社,2003:186.
[8]潘丽军,陈锦权.试验设计与数据处理[M].南京:东南大学出版社,2008:260-290.
Effect of Microbial Transglutam inase on Gelation and Water Holding Capacity of Soy Protein Isolate
He Dong lan,Peng Baoyu,Zhang Ying,Ou′yang Linlan
(Key L aboratory for Microorganism and Biotransformation,South-CentralU niversity for Nationalities,Wuhan 430074,China)
Them icrobial transglutam inase(MTG)used for food processing was obtained from the fermentation solution ofStrep toverticilliumsp.CJ3033 by filtration,centrifugation,freeze-concentration,ethanol precipitation and freeze-dried.The effect forMTG on the gel formation characteristics and water holding capacity of soy protein isolate(SPI)were studied by physical analyzer.The MTG concentration added,acting time and processing temperature were tested on the SPI gel formation and water retention through the composite design of quadratic regression.The results showed thatMTGase could improve the SPI quality distinctly.The best SPI gel strength of 74.95 g/mm2was obtained at 51℃,processing time of 1.5 h and 9.82 U/g enzyme addition.The best water holding capacity ratio at 96.47%was obtained at the reaction temperate of 49℃for 1.3 h and enzyme concentration of about 7.78 U/g.
transglutam inase;soy protein isolate(SPI);gel strength;water holding capacity
Q 556
A
1672-4321(2010)01-0041-04
2010-01-14
何冬兰(1964-),女,教授,研究方向:分子微生物学及酶学,E-mail:ymhlh@yahoo.com.cn
湖北工业大学湖北省工业微生物重点实验室开放基金项目(301,21619);中南民族大学重点实验室项目(XJS09002)
