分子光谱法研究恩替卡韦和牛血清白蛋白之间的相互作用
2010-02-06吴云华
吴云华
(中南民族大学生命科学学院,武汉430074)
研究药物分子与血清白蛋白之间的相互作用对于研究药物代谢学以及蛋白质构象学具有重要意义[1,2].恩替卡韦(2-氨基-9-[(1S,3R,4S)-4-羟基-3-羟甲基-2-亚甲基环戊基]-1,9-二氢-6-嘌呤-6-酮;分子式C12H 15N 5O3;分子量277.28.化学结构式见图1)是一种有效的、选择性抑制乙型肝炎病毒复制的核苷类似物,由美国百时美施贵宝公司自主研发,FDA于2005年批准它用于慢性乙肝类型的治疗[3].本文采用紫外-可见光谱法、荧光光谱法和圆二色光谱法研究恩替卡韦与BSA的结合作用,确定了荧光猝灭机理,测定了结合反应的各种常数,探讨了恩替卡韦与BSA构象的影响以及结合作用机理.
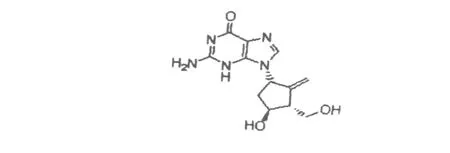
图1 恩替卡韦化学结构式Fig.1 Structu re o f en tecav ir
1 实验部分
1.1 仪器与试剂
F-2500型荧光光度计(日本日立公司);J-810圆二色光谱仪(日本分光JA SCO 公司);UV 757CRT紫外可见分光光度计;pHS-3C精密pH计.
9.02×10-3m o l/L恩替卡韦储备液的配置:准确称取恩替卡韦0.010 g,用4m L甲醇溶解;5.45×10-5m o l/L BSA储备液的配置:准确称取BSA 180 m g,用50m L的高纯水配置,储存在4℃冰箱中;缓冲溶液(pH=6.90)的配置:将 1/15 m o l/L N aH2PO4与1/15m o l/L N a2HPO4配置为VN aH 2PO4∶
VNa2HPO4=4∶6;所用试剂均为分析纯,水为二次蒸馏水.
1.2 试验方法
在10m L荧光杯中加入一定体积的BSA储备液,再加入适量的恩替卡韦溶液,用缓冲液定容至10 m L,分别测25,35,45℃的荧光猝灭光谱.固定激发波长在280 nm,扫描混合物在220~450 nm 范围内的荧光光谱.340 nm处的发射荧光强度用于定量分析.固定波长差Δλ=15和60 nm,做同步扫描荧光光谱.扫描BSA以及BSA与恩替卡韦混合液,在220~450 nm 范围内的紫外-可见光谱.扫描BSA 以及BSA与恩替卡韦混合液,在190~350 nm范围的圆二色谱.
2 结果与讨论
2.1 恩替卡韦和BSA的结合物常数K和结合数n
2.1.1 紫外-可见吸收光谱
在pH 6.9磷酸盐缓冲液中,将BSA和恩替卡韦按比例混合后测量250~350 nm紫外-可见光吸收光谱(见图2).图2中保持曲线1~3的BSA 的浓度不变,恩替卡韦浓度不断增加,光谱显示BSA在280 nm处有最大吸收峰,BSA的吸收峰随着恩替卡韦浓度的增加而升高,但最大吸收峰位置不变;曲线4为不加入BSA,仅含恩替卡韦紫外光吸收谱,在280 nm处未显示峰,表明此处的吸收峰为BSA吸收峰.

图2 BSA和恩替卡韦的紫外光吸收光谱Fig.2 A bso rp tion spectra of entecavir bound to BSA atpH 6.9
2.1.2 恩替卡韦对BSA荧光光谱的影响及猝灭机理
不同浓度恩替卡韦对BSA荧光光谱影响见图3.随着恩替卡韦浓度的增大,BSA的荧光光谱呈规律性降低,表明二者之间有可能形成了复合物.随着恩替卡韦浓度的增大,复合物的最大发射波长蓝移,表明BSA中生色氨基酸残基的疏水环境可能发生了改变.
动态猝灭因猝灭及分子和荧光物质的激发态分子间相互碰撞而导致荧光猝灭,其猝灭随着温度升高而加强;而静态猝灭因猝灭剂分子和荧光物质分子之间形成了非荧光的复合物,其猝灭随温度升高而减弱;假设该猝灭过程是动态猝灭,应该满足Stern-V o lm er方程[4],即:
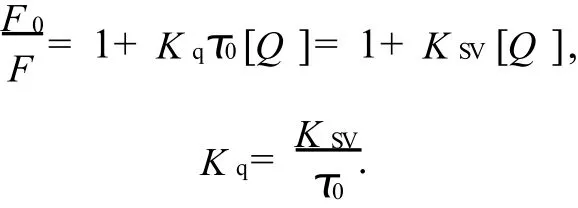
式中,F0和F分别为不加入和加入恩替卡韦时BSA的荧光强度;Kq为双分子猝灭速率常数;Ksv为动力猝灭常数;τ0为猝灭剂分子不存在时荧光物质分子的寿命(生物大分子荧光寿命约为10-8s);Q为猝灭剂的浓度.

图3 不同浓度恩替卡韦对BSA荧光强度的影响Fig.3 Effectof en tecaviron fluo rescence spectra of BSA
根据不同温度下的荧光猝灭光谱,计算出3个温度下的Ksv和Kq(见图4和表1).生物大分子动态猝灭过程的最大Kq=2.0×1010L/(m o l·s),Ksv随温度升高而减小.比较试验结果可知:恩替卡韦猝灭BSA荧光的过程为静态猝灭过程.
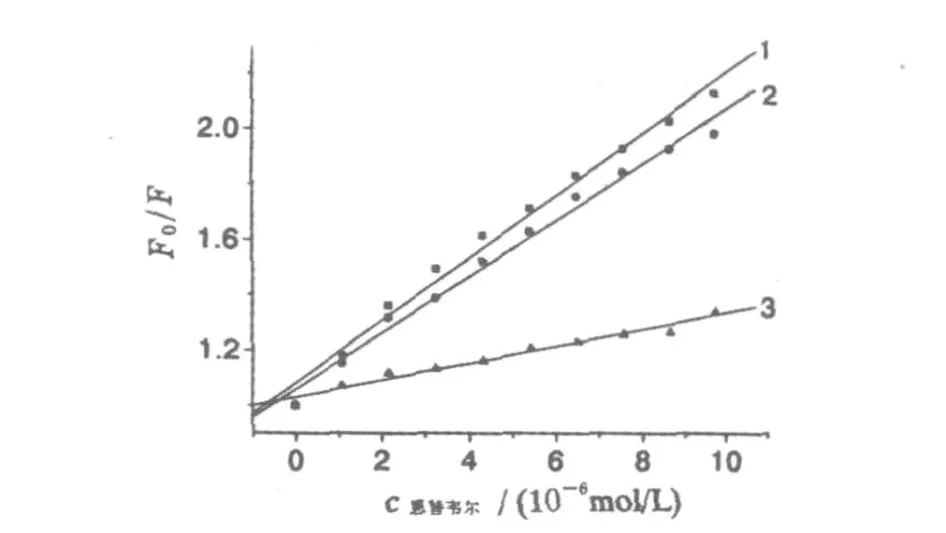
图4 不同温度下的恩替卡韦与牛血清白蛋白猝灭的Stern-Vo lm er图Fig.4 Stern-Vo lm er curvesof quench ing of BSA w ith en tecavir at various tem peratu res
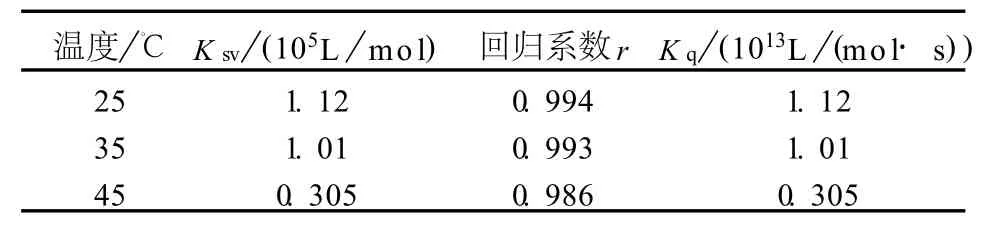
表1 不同温度下的Stern-V o lm erTab.1 Stern-Vo lm er quench ing constan tso f en tecacir to BSA at various tem peratu res
2.1.3 结合常数和结合位点数的确定
对于静态猝灭,荧光强度和猝灭剂浓度之间的关系为[5]
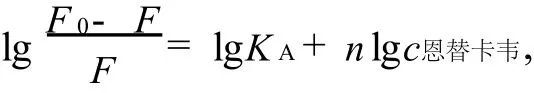
式中,KA为结合常数.lg(F0-F)/F对lgQ作图,所得直线的斜率是结合位点n,截距为lgKA.根据荧光猝灭实验,分别得到25,35,45℃下的结合常数和结合位点数(见图5和表2).数据表明,结合物常数随温度的增加而减少,结合位点数基本不随温度变化.说明恩替卡韦在BSA的某个位点上通过一种强的结合作用和BSA形成了复合物.
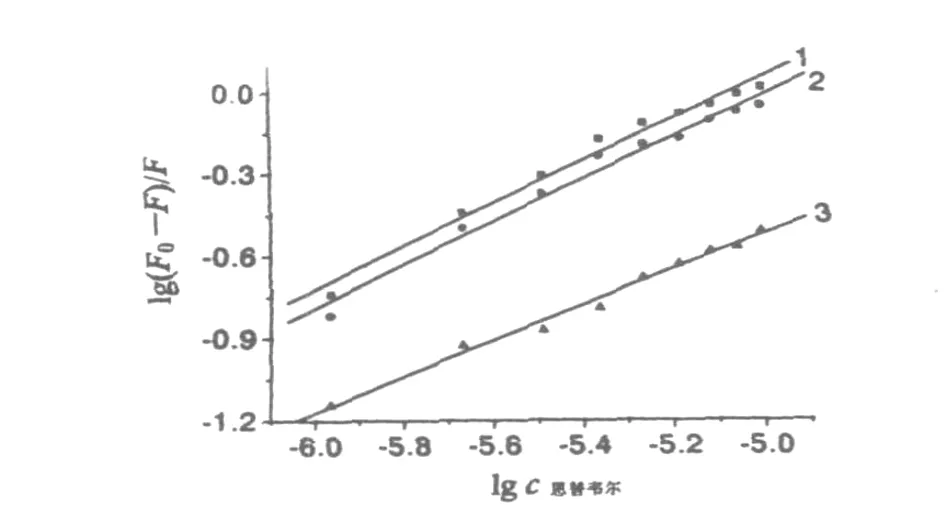
图5 不同温度下的双对数图Fig.5 Plo to f lg(F0-F)/F vs.lg[Q]fo r quench ing o f en tecavir to BSA at various tem peratu res

表2 恩替卡韦和BSA作用时的结合常数和结合位点Tab.2 B ind ing constan ts and the b ind ing num bers o f En ticavir and BSA at d ifferen t tem peratu res
2.2 恩替卡韦和BSA作用距离的计算
根据Fo rster非辐射能量转移理论[6],当供体发荧光时,供体的荧光发射光谱与受体的吸收光谱有足够的重叠,供体与受体的最大距离不超过7 nm,能量转移效率E与供体-受体间距离r及临界能量转移距离R0存在式(1)关系.
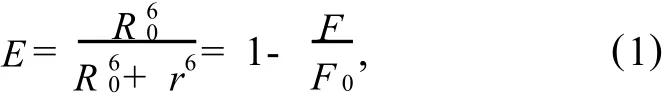
式(1)中,k为供体-受体各项随机分布的取向因子;n为介质的折射指数;Φ为供体的荧光量子产率,J为供体的荧光发射光谱和受能体的吸收光谱之间的光谱重叠积分,即
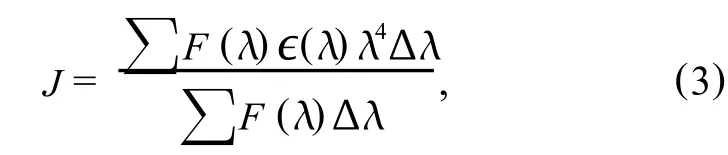
式(3)中,F(λ)为供体在波长为λ时的荧光强度;∈(λ)为受体在波长λ时摩尔吸光系数.
BSA荧光光谱与恩替卡韦紫外吸收光谱的重叠图谱见图6.根据式(3),将图6中290~450 nm 光谱重叠部分分割成极小的矩形面积求和,得到光谱的重叠积分J=1.16×10-14cm3·L/m o l.
在上述实验条件下,取向因子用供体-受体各向随机分布的平均值K=2/3,折射指数取水和有机物平均值n=1.336,Φ=0.118.将上述值代入式(2),求得R0=2.6 nm.结合式(1),得到r=2.7 nm(25℃).供体-受体之间的距离小于7 nm,表明BSA容易向恩替卡韦发生能量转移.

图6 恩替卡韦的紫外吸收光谱和BSA的荧光光谱Fig.6 O verlap of theUV spectrum of en tecavirw ith the fluo rescence em ission spectrum of BSA
2.3 作用力类型的确定
药物小分子和生物大分子间的相互作用力可为氢键或范德华力、静电作用力和疏水作用力.根据Ross理论[7],结合作用力类型可通过结合反应的热力学参数变化确定:ΔH>0,ΔS>0时为疏水作用力;ΔH<0,ΔS>0时为氢键或范德华力;ΔH<0,ΔS>0时为静电作用力.恩替卡韦和BSA结合作用的热力学参数满足式(3)~ (5)关系.
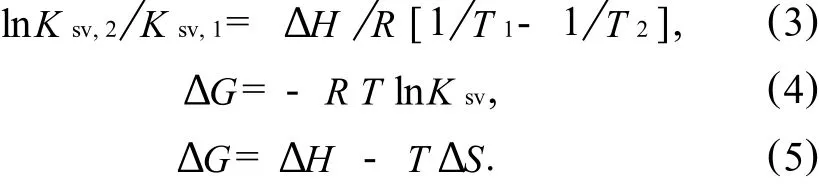
由恩替卡韦和BSA在不同温度下的结合常数Ka可求得结合作用的热力学参数(见表3).ΔG<0时结合反应为自发;ΔH>0,ΔS>0时结合作用力类型为疏水作用力,熵变化驱动该结合反应而焓变化不利于该结合反应.

表3 恩替卡韦和BSA结合作用的热力学参数Tab.3 Therm odynam ic param eterso f En ticavir-BSA system
2.4 恩替卡韦对BSA构象的影响及结合机理
2.4.1 同步荧光光谱
蛋白质的荧光主要来自色氨酸和酪氨酸残基.同步荧光光谱法用于蛋白质构象的分析,主要基于Δλ的变化考察.当Δλ=15 nm 时,所得同步荧光光谱仅显示酪氨酸残基特征荧光;Δλ=60 nm 时,所得同步荧光光谱只显示色氨酸残基特征荧光.而色氨酸和酪氨酸残基的最大发射波长与其所处的微环境紧密相关,因而可以此考察蛋白质构象变化情况.固定BSA的浓度,逐渐增加恩替卡韦的浓度,以Δλ=15 nm和60 nm扫描BSA的同步荧光光谱(见图7).
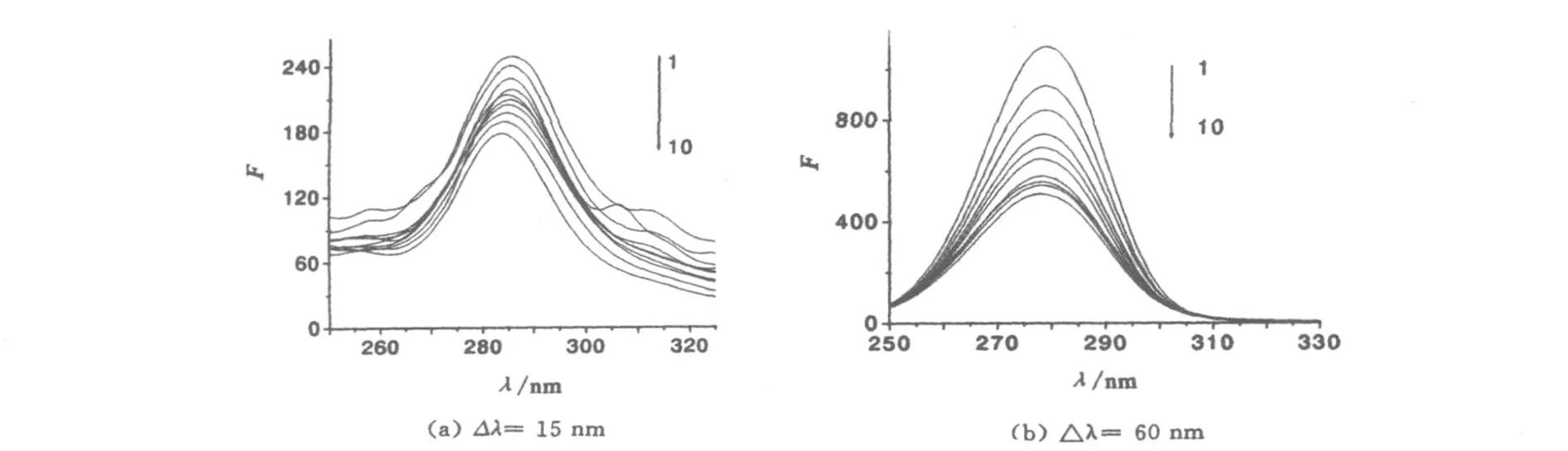
图7 不同浓度的恩替卡韦对BSA同步荧光光谱的影响Fig.7 Synch ronous fluo rescen t spectra o f BSA in the p resence of entecavir
由图7知,随着恩替卡韦浓度的增加,酪氨酸残基荧光强度变化较小,色氨酸荧光强度明显降低,但峰位置基本无变化,说明恩替卡韦的加入主要改变了BSA中色氨酸残基附近的微环境,色氨酸所处微环境的疏水性降低,表明BSA内部的疏水腔结构有所瓦解,肽链的伸展程度有所增加,从而推断出BSA的构象发生了一定程度的变化.
2.4.2 圆二色谱光谱
CD光谱法是研究蛋白质构象变化的有效手段.BSA以及BSA与恩替卡韦相互作用的CD光谱见图8.单纯的BSA溶液显示出了BSA中α-螺旋结构的3个特征峰,192 nm处1个正峰,208,222 nm处2个负峰.加入恩替卡韦后,原208,222 nm 处的负峰也略微移向低波数且振幅减弱显著.CD光谱的测定结果根据公式可转化为平均残基椭圆率(M RE/(deg cm2/dm o l)).
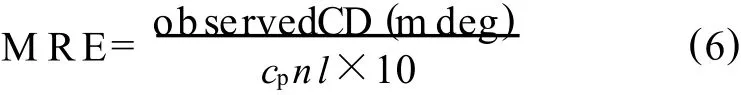
式(6)中:cp为BSA的摩尔浓度,n为BSA的氨基酸残基数目,l为测定池的厚度.根据式(7)求出单纯的BSA及与恩替卡韦相互作用BSA的α-螺旋结的比例度


图8 恩替卡韦和BSA CD光谱图Fig.8 CD spectra of the BSA-entecavir system
式(7)中:M RE208为BSA 在208 nm 的M RE,4 000为BSA在208 nm的β-折叠以及无规卷曲的M RE,33 000为BSA 在208 nm 纯粹α-螺旋的M RE.
根据式(6)和(7)求得单纯的BSAα-螺旋结构的比例为86.2%,与恩替卡韦相互作用BSA的α-螺旋结构的比例减小到77.7%,说明恩替卡韦溶液与BSA的结合反应的主要作用力类型为疏水力作用,使BSA肽腱伸展,改变了BSA的二级结构,导致α-螺旋结构的减少.由此可知恩替卡韦与BSA的相互作用以疏水作用为主[8],与荧光测得结果相符.
3 结论
恩替卡韦对BSA荧光的猝灭机制属静态猝灭过程,在25,35,45℃下,恩替卡韦和BSA之间的Ka分别为9.13×103,7.96×103,5.46×102L/m o l,结合位点数分别为0.781,0.780,0.751.结合反应的主要作用力类型为疏水作用力.恩替卡韦与BSA之间的结合距离为2.7 nm(25℃).BSA与恩替卡韦结合位点接近BSA的Th r色氨酸残基.
[1] Kandagal PB,Seetharam J,A shoka S.Study o f the in teraction betw een doxep in hyd rovh lo ride and bov ine serum album in by spectroscop ic techniques[J].In t J B io lM acrom o l,2006,39:234-239.
[2] T ian JN,L iu JQ,Hu Z.In teraction o fw ogoninw ith bovine serum album in[J].B ioo rgM ed Chem,2005,13:4 124-4 129.
[3] 蒋银妹.恩替卡韦分散片的处方工艺和质量标准研究[D].沈阳:沈阳药科大学,2008.
[4] Hook DW A,Harding J.A lpha-crystallin acting as a m o lecu lar chaperone p ro tects catalase against stero idinduced inactivation[J].FEBSL ett,1996,382:281-284.
[5] W ang Y Q,Zhang H M,Zhang Q C.Spectroscop ic studies on the in teraction betw een silico tungstic acid and bov ine serum album in[J].J Pharm B iom ed A nal,2007,43:1 869-1 875.
[6] Fo rster T,Sinanog lu O.M odern quan tum chem istry[M].N ew Yo rk:A cadem ic Press,1996.
[7] Ross PD,Subam anian S.Therm odynam icso f p ro tein association relation:fo rces con tribu tion to stability[J].B iochem,1981,20:3 096-3 102.
[8] Kang J,L iuY,X iaM,et al.In teractions o f hum an serum album in w ith ch lo rogenic acid and feru lic acid[J].B ioch im B iophysA cta,2004,1674:205-214.
