AMP激活的蛋白激酶及其对肉类生产的意义
2010-08-27李泽靳烨
李泽, 靳烨
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018)
AMP激活的蛋白激酶及其对肉类生产的意义
李泽, 靳烨*
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018)
AMP激活的蛋白激酶(AMPK)广泛存在于真核生物细胞中,其活性主要受AMP/ATP比例的调节,AMPK可以通过控制ATP的合成和分解调节机体的能量代谢,是机体能量状态的传感器。作者综述了AMPK的结构、特点和活性调节,并对其在肉类生产中的应用前景进行了展望,AMPK调节糖酵解的深入研究有可能成为改善肉品质的有效靶点。
AMPK;糖酵解;肉;品质
AMP激活的蛋白激酶(AMPK)是一种能被一磷酸腺苷(AMP)激活的蛋白激酶,是蛋白激酶级联的下游组件[1]。AMPK的研究最早始于1973年, Beg等报道在三磷酸腺苷(ATP)存在的同时,大鼠肝脏细胞中的一种可溶性物质可导致肝脏微粒体HMGR呈时间依赖性失活,后来的研究发现这种失活现象是因某个酶的磷酸化而产生的,Hardie等1988年首次将该酶命名为AMP激活的蛋白激酶(AMP-activated protein kinase,AMPK),因为这种酶在机体A TP含量减少,AMP含量升高时被激活,它的功能是协调机体能量和代谢的需要,对其十多年的研究发现,AMPK能感知机体细胞能量代谢状态的改变,并通过影响物质代谢的多个环节来维持细胞能量的供求平衡,能够根据机体的需能状况而调节产能和耗能(A TP的生成与消耗)代谢,当机体ATP减少时,AMPK一方面可以通过抑制糖原、脂肪和胆固醇的合成减少A TP的利用,另一方面可以通过促进脂肪酸氧化、葡萄糖转运等促进ATP的生成,其活性受细胞内AMP/A TP比值的调控,因此被称为真核细胞的“代谢感受器”,或是调控细胞ATP、AMP水平的“燃料开关”[2]。
1 AMPK的结构
AMPK是由α、β和γ亚基组成的异源三聚体酶[3]。其中α为催化亚基,β和γ为调节亚基[4]。α和β亚基各自分别由两种基因型编码(α1、α2和β1、β2),γ亚基由3种基因型编码(γ1、γ2和γ3)[5]。α、β和γ3种亚基各司其职,α亚基是激酶的主要催化部位,负责将A TP的磷酸传递至目标蛋白,其含有2个功能区:N末端是催化核心部位,C末端主要负责活性调节及与其它亚基的联系[6]。β和γ亚基各自参与了亚细胞的靶向作用和调节功能[7]。以往认为α、β、γ3个亚基对于AMPK活性都是必需的,近年研究发现,未与β和γ亚基结合的α激酶结构域,仍具有激酶活性,这说明α亚基对于AMPK活化才是必需的,β和γ亚基主要是调节AMPK活性,对激酶的最适酶活力是必需的。而α亚基中的数个位点(苏氨酸172、苏氨酸258、丝氨酸485等)均可被磷酸化,其中苏氨酸172位点(Thr 172)对AMPK活性调节最为重要,这一位点的磷酸化对AMPK的活化是充分和必需的[8]。所以无论是α、β、γ形成的AMPK复合物,还是单独的α激酶结构域,都需要α亚基Thr 172的磷酸化才具有活性。
2 AMPK的特点
AMPK在动物机体中具有进化保守性、分布广泛性、组织特异性和功能专一性的特点,研究发现AMPK具有高度保守性,几乎所有真核细胞(包括哺乳动物、真菌和植物)都存在AMPK系统[2]。近年来的研究表明,AMPK广泛存在于真核生物的细胞中,但具有组织特异性,在不同动物各组织中AMPK的活性也有很大不同。Davies(1989)在小鼠中研究表明,AMPK存在于肝、乳腺、心、肌肉、肺、肾、大脑等组织器官[9]。秦玉辉(2003)研究表明,蛋鸡在正常生理条件下,体内各组织器官AMPK酶活分布为肝脏中AMPK活性比较低,骨骼肌、心肌、小肠中有较高的AMPK酶活[10]。余冰(2003)试验发现AMPK分布于仔猪的肝脏、骨骼肌、心脏和十二指肠,仔猪体内骨骼肌中AMPK活性最高,分别是心脏和十二指肠中AMPK活性的3.66倍和6.28倍,而肝脏中AMPK活性最低是骨骼肌AMPK活性的9.9%[11]。另外,AMPK的不同亚基在动物不同组织中分布也不相同。Proszkowiec-Weglarz(2006)通过RT-PCR的基因表达分析表明来自3周龄肉鸡的肝脏、脑、肾、脾、胰、十二指肠、腹部脂肪和下丘脑优先地表达AMPKα1、β2、γ1亚基亚型。心脏主要表达α2、β2、γ1,骨骼肌优先表达α2、β2、γ3,AMPKγ3只在心脏和骨骼肌表达[12]。在大鼠肝脏中,AMPK主要以α1、α2、β1、γ1为主[13],而在骨骼肌中以α2、β2、γ1为主[14]。这些分布的差异可能是因为不同种类动物的组织功能不同导致的,一般代谢越高的组织AMPK活性越高。虽然AMPK在不同物种不同组织中分布不同,但是AMPK所起的作用是同一的,即协调机体的能量和代谢。
3 AMPK的活性调节
AMPK的激活主要有两种途径,通过AMP途径和不依赖AMP的途径。
3.1 AMP途径激活
多种因素可激活AMPK,如运动、热应激、缺氧、缺血和营养不良等。当体内能量被耗竭,细胞内ATP水平降低、AMP水平增加时,AMPK的活性就升高,所以AMP是AMPK的特异性激活剂[15]。但是AMP对AMPK的激活受到高浓度ATP的抑制,AMP与AMPK的亲和力也会因ATP浓度的升高而下降,因为A TP可与AMP竞争AMPK上的变构位点[16]。因此,调控AMPK的信号不是AMP,而是AMP/ATP比值,AMP/ATP比值的升高可激活AMPK。
AMP途径激活的AMPK可能通过以下4种方式被激活:AMP直接作用于AMPK,变构激活AMPK;AMP和AMPK结合使之成为其上游激酶AMPKK(AMP激活的蛋白激酶激酶)的良好底物,容易被AMPKK磷酸化;AMP变构激活AMPKK,后者通过磷酸化作用激活AMPK;降低与抑制蛋白磷酸化酶的亲和力[17]。目前对AMPK的上游激酶AMPKK的认识还很贫乏,仅发现了两种:肿瘤抑制性激酶L KB1和钙调节依赖蛋白激酶激酶(CaMKK)[18-19]。
3.2 通过激活剂和抑制剂的调节
近年研究较多的AMPK激活剂是5-氨基-4-咪唑羧基酰胺核苷(5-amino-4-imidazolecarboxamide, AICAR)和抗糖尿病药物二甲双胍(metformin)。AICAR被动物摄取后,可转化为单核苷衍生物ZMP,Henin比较了ZMP和AMP的作用动力学特征,结果表明两者都影响酶与其专一底物SAMS肽的饱和曲线,与AMPK的亲和力都随ATP的降低而增加,都结合在同一变构位点,并且作用具有可加性和竞争性,两者对大鼠肝脏AMPK的作用具有高度相似性,具有相同的最大激活效应[20]。因而AICAR被视为AMPK的特异性激活剂。二甲双胍是一种治疗糖尿病的药物,是最近研究发现的对AMPK有激活作用的制剂。在分离的大鼠肌肉中二甲双胍剧烈地激活AMPKα1和α2,伴随着肌肉葡萄糖摄取的提高[21]。但是它对AMPK的激活不依赖于AMP,无AMP/ATP比值的升高,所以它不属于AMPK的特异性激活剂。
目前尚未发现AMPK的特异性抑制剂,Davies等(1989)研究发现8Br-AMP是AMPK的抑制剂,用20μmol/L的AMP激活AMPK,2 mmol/L Br-AMP可使AMPK活性的80%受到抑制[9]。廖波(2003)在猪肝细胞中加入0.2 mmol/L 8Br-AMP,培养30、60 min后,得出结论在体外研究中抑制剂8Br-AMP可以有效的抑制猪肝细胞AMPK的活性[22]。有研究向腹腔内注射复合物(Compound C)可抑制宰后大鼠骨骼肌AMPK活性[1],但对其性质并没有叙述。另外,殷仁富等(2000)报道腺嘌呤-9-β-D-阿糖呋喃腺苷(araA)能够抑制心肌的AMPK活力和葡萄糖摄取[23]。
AMPK激活剂和抑制剂种类繁多,但是大部分的作用机制还不十分清楚,有待更深入的研究。
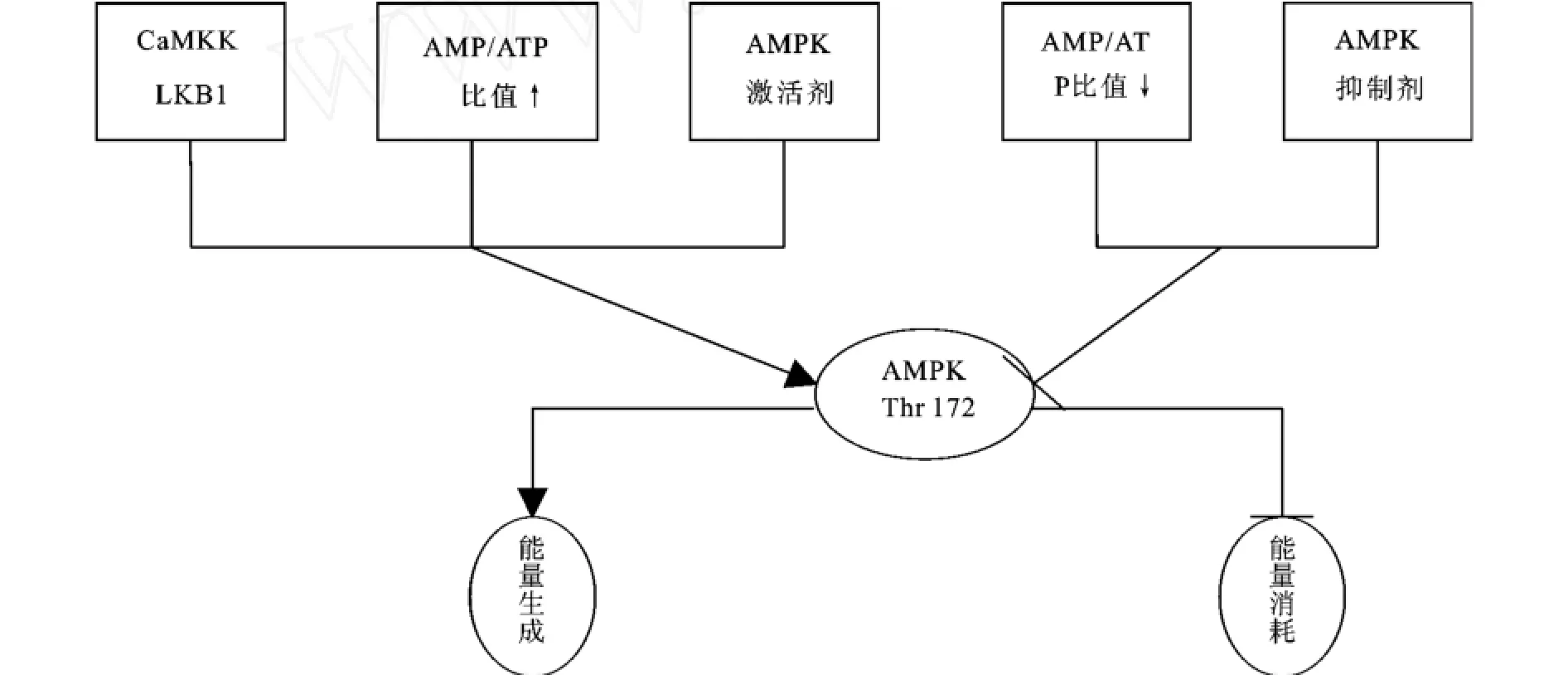
图1 AMPK活性调节示意图Fig.1 The conceptual diagram of AMPKactivity regulation
4 AMPK调节糖酵解及其对肉类生产的意义
AMPK能够调节动物机体糖代谢和肌肉葡萄糖摄入,当AMPK活化以后可以通过促进糖酵解和糖原分解来提高细胞的A TP水平,抑制糖原合成和糖异生来阻止A TP的消耗。
牲畜宰后血液循环和氧气供应中断,肌肉不能再进行有氧氧化,糖原不能再彻底转化成二氧化碳和水来获取能量。肌肉组织的物质供应停止,原来复杂的平衡关系被打破,因此就开始发生一系列与活体完全不同的变化。由于刚屠宰后的肌肉组织细胞并不马上死亡,这些组织仍具有活体时的一些功能,如肌浆网继续执行其钙泵机能等,这些功能的执行需要消耗ATP,所需的能量只有通过肌肉的无氧酵解来提供,而无氧酵解产生的A TP显然大大少于有氧氧化,这种能量状态的改变会激活AMPK。AMPK活化后可通过直接磷酸化糖酵解关键酶提高其活性,进而促进糖酵解,甚至可通过增强糖酵解关键酶的基因表达来发挥其作用[24]。无氧酵解的最终产物是乳酸,宰后生成的乳酸不会再通过血液循环排除或在肝中再合成肝糖元,乳酸的蓄积导致肌肉p H值的下降,另外磷酸肌酸缓冲系统产生的肌酸和ATP分解产生的磷酸也会使p H值下降,因此p H值的下降与动物死亡时肌肉内的ATP、磷酸肌酸和糖原含量有很大关系。
畜禽宰后一定时间内p H值的变化速度与幅度是改变肉品品质的主要因素,动物宰后肌肉p H值下降速度可影响肌肉肉色、系水力、多汁性、货架寿命[25]。佟辉等(2008)报道,较高的肉色评分与肌肉高的临界p H值紧密相关[26];冯京海等(2006)报道,p H值的下降速度过快影响了肌肉的肉色和持水力,从而影响肉鸡胸肌品质[27]。因此p H值下降速度和幅度决定了肉质的优劣。
糖酵解是宰后肌肉p H值下降的主要原因,因此糖酵解影响宰后肉质。Shen等(2006)报道宰前运输提高了猪肉中A TP的消耗,与对照组相比,这导致宰后猪肉较低的能量状态,使AMPK被激活,导致了迅速的糖酵解[4]。随后Shen等(2008)又研究了向试验小鼠腹腔注射一种AMPK的抑制剂-复合物C后产生的效应,数据显示复合物C抑制了宰后小鼠背最长肌中AMPK的活性和糖酵解,提高了肌肉的p H值[1]。由此证明了AMPK能够调节宰后肌肉的糖酵解。
综上所述,AMPK能够调节宰后肌肉的糖酵解,而糖酵解的程度又可以影响到动物肉质的优劣,因此推测AMPK也能影响肉质。已有研究表明,氟烷基因阳性猪宰后早期A TP即迅速被消耗,使AMPK较早被活化,糖酵解提高,乳酸蓄积,导致了较高的PSE肉发生率[28]。宰后早期未成熟猪具有肉质性状差异,是由骨骼肌能量代谢造成的,最长肌具有较低AMPK活性的猪种具有较好的肉质性状[29]。通过控制宰后肌肉的糖酵解来改善肉质的各项指标,能够调节能量代谢的AMPK无疑是一个有效的研究靶点。而且AMPK的活性又是可调节的,调节AMPK活性→糖酵解发生改变→改善肉质这一路线的细化研究,以及AMPK改善肉质的机理,都有待更深入的实验研究进行确定。
[1]Shen Q W,Gerrard D E,Du M,et al.An inhibitor of AMP-activated protein kinase,inhibits glycolysis in mouse longissimus dorsi postmortem[J].Meat Science,2008,78:323-330.
[2]Hardie D G,Carling D.The AMP-activated protein kinase-fuel gauge of the mammalian cell?[J].European Journal of Biochemistry,1997,246(2):259-273.
[3]Hardie D G.AMP-activated protein kinase:A key system mediating metabolic responses to exercise[J].Medicine and Science in Sports and Exercise,2004,36(1):28-34.
[4]Shen Q W,Means W J,Thompson S A,et al.Pre-slaughter transport,AMP-activated protein kinase,glycolysis,and quality of pork loin[J].Meat Science,2006,74:388-395.
[5]Long Y C,Zierath J R.AMP-activated protein kinase signaling in metabolic regulation[J].The Journal of Clinical Investigation,2006,116(7):1776-1783.
[6]蔡明春,黄庆愿.AMPK与能量代谢[J].重庆医学,2005,34(1):120-122.
CAI Ming-chun,HUANG Qing-yuan.AMPK and energy metabolism[J].Chongqing Medicine,2005,34(1):120-122. (in Chinese)
[7]Gregory R S,Sebastian Beck Jogensen.The AMP-activated protein kinase:Role in regulation of skeletal muscle metabolism and insulin sensitivity[J].Mini Reviews in Medicinal Chemistry,2007,7(5):521-528.
[8]Horman S,Hussain N,Dilworth S M,et al.Evaluation of the role of AMP-activated protein kinase and its downstream targets in mammalian hibernation[J].Comparative Biochemistry and Physiology,2005,142(8):374-382.
[9]Davies S P,Carling D,Hardie D G.Tissue distrlbution of the AMP-activated protein kinase,and lack of activation by cyclic-AMP-dependent protein kinase,studied using a specific and sensitive peptide assay[J].European Journal of Biochemistry,1989,186(1-2):123-128.
[10]秦玉辉.蛋鸡体内AMPK酶活分布及应激对AMPK酶活影响研究[D].雅安:四川农业大学,2003.
[11]余冰.AMPK对应激状态下仔猪脂质代谢的调节作用[D].雅安:四川农业大学,2003.
[12]Proszkowiec-Weglarz M,Richards M P,Ramachandran R,et al.Characterization of the AMP-activated protein kinase pathway in chickens[J].Comparative Biochemistry and Physiology,2006,143(1):92-106.
[13]Stapleton D,Woollatt E,Mitchelhill K I,et al.AMP-activated protein kinase isoenzyme family:subunit structure and chromosomal location[J].FEBS Letters,1997,409(3):452-456.
[14]Thornton C,Snowden M A,Carling D.Identification of a novel AMP-activated protein kinase beta subunit isoform that is highly expressed in skeletal muscle[J].Journal of Biological Chemistry,1998,273(20):12443-12450.
[15]李梦云.猪基因表达规律及其与肉质关系的研究[D].雅安:四川农业大学,2006.
[16]Carling D,Hardie D G.The substrate and sequence specificity of the AMP-aetivated protein kinase.Phosphorylation of glycogen synthase and phosphorylase kinase[J].Biochemica et BioPhysica Acta,1989,1012(1):81-86.
[17]Hardie D G,Salt I P,Hawley S A,et al.AMP-activated protein kinase:an ultrasensitive system for monitoring celluar energy charge[J].Biochemical Journal,1999,338(3):717-722.
[18]Woods A,Johnstone S R,Dickerson K,et al.L KB1 is the upstream kinase in the AMP-activated protein kinase cascade [J].Current Biology,2003,13(22):2004-2008.
[19]Woods A,Dickerson K,Heath R,et al.Ca2+/calmodulin-dependent protein kinase kinase-βacts upstream of AMP-activated protein kinase in mammalian cells[J].Cell Metabolism,2005,2(6):21-33.
[20]Henin N,Vincent M F,Van den Berghe G.Stimulation of rat liver AMP-activated protein kinase by AMP analogues[J]. Biochemica et BioPhysica Acta,1996,1290(2):197-203.
[21]Musi N,Goodyear L J.AMP-activated protein kinase and muscle glucose uptake[J].Acta Physiolgica Scandinavica,2003, 178:337-345.
[22]廖波.猪肝细胞的分离培养和AMPK活性调控研究[D].雅安:四川农业大学,2003.
[23]殷仁富,陈金明,吴宗贵,等.心肌细胞缺氧通过激活AMPK促进GLUT4移位和葡萄糖摄取[J].第二军医大学学报, 2000,21(11):1065-1067.
YIN Ren-fu,CHEN Jin-ming,WU Zong-gui,et al.Myocardial hypoxia facilitates translocation of GLUT4 and glucose uptake by activation of AMPK[J].Academic Journal of Second Military Medical University,2000,21(11):1065-1067. (in Chinese)
[24]郭金玲,李梦云,刘延贺,等.AMPK对骨骼肌中糖代谢的调节作用及对肉质的影响[J].饲料工业.2008,29(10):51-53.
GUO Jin-ling,LI Meng-yun,LIU Yan-he,et al.The regulate action of AMPKon glycometabolism and its effect on meat quality[J].Feed Industry,2008,29(10):51-53.(in Chinese)
[25]刘正远,袁缨.影响肉质的生物化学和组织学因素[J].饲料工业,2005,26(11):44-46. LIU Zheng-yuan,YUAN Ying.Analyse and application of the histology and biochemistry factors determinating meat quality[J].Feed Industry,2005,26(11):44-46.(in Chinese)
[26]佟辉,陈杰,杨晓静,等.背最长肌肌红蛋白mRNA表达与肉色表观性状之间的相关[J].食品与生物技术学报,2008,27 (3):94-98.
TONG Hui,CHEN Jie,YANG Xiao-jing,et al.Relationship between level of myoglobin mRNA and phenotypic parameters of meat colour in longissimus dorsi[J].Journal of Food Science and Biotechnology,2008,27(3):94-98.(in Chinese)
[27]冯京海,张敏红,郑姗姗,等.日循环高温对肉鸡线粒体活性氧产生量、钙泵活性及胸肌品质的影响[J].畜牧兽医学报, 2006,37(12):1304-1311.
FENGJing-hai,ZHANG Min-hong,ZHENG Shan-shan,et al.The effect of cyclic high temperature on mitochondrial ROS production,Ca2+-ATPase activity and breast meat quality of broilers[J].Acta Veterinaria et Zootechnica Sinica, 2006,37(12):1304-1311.(in Chinese)
[28]Shen Q W,Underwood K R,Means W J,et al.The halothane gene,energy metabolism,adenosine monophosphate-activated protein kinase,and glycolysis in postmortem pig longissimus dorsi muscle[J].Journal of Animal Science,2007,85 (4):1054-1061.
[29]Li X,Yang X,Shan B,et al.Meat quality is associated with muscle metabolic status but not contractile myofiber type composition in premature pigs[J].Meat Science,2009(81):218-223.
(责任编辑:朱明)
Role of AMP-Activated Protein Kinase(AMPK)on Meat Production
LI Ze, J IN Ye*
(College of Food Science and Engineering,Inner Mongolia Agricultural University,huhhot 010018,China)
AMP-activated protein kinase(AMPK)is a kind of kinase that regulated by the AMP/ ATP ratio and wildly exist in eukaryote cell.AMPK could regulate the energy metabolism through controlling the synthesis and decomposition of ATP,an index of energy state.In this review,the structure,characteristic and activity regulation ofAMPK weresummarized, furthermore,the potential application of it on meat production was also suggested.
AMPK;glycolysis;meat;quality
Q 591.8
:A
1673-1689(2010)01-0009-05
2009-04-16
内蒙自治区科技厅科技专项(20050203)。
李泽(1984-),女,蒙古族,内蒙古赤峰人,农产品加工与贮藏工程博士研究生。Email:lize561@sina.com
*通讯作者:靳烨(1964-),男,内蒙古呼和浩特人,教授,工学博士,博士生导师,主要从事畜产品加工方面的研究。Email:jinyeyc@yahoo.com.cn
