川芎有效成分的体外抗氧化研究
2010-08-27李文明刘洪涛李佳佳张吉石磊于超
李文明, 刘洪涛, 李佳佳, 张吉, 石磊, 于超*
(1.重庆医科大学生命科学研究院,重庆 400016;2.中国科学院大连化学物理研究所,辽宁大连 116023)
川芎有效成分的体外抗氧化研究
李文明1, 刘洪涛2, 李佳佳1, 张吉1, 石磊1, 于超*1
(1.重庆医科大学生命科学研究院,重庆 400016;2.中国科学院大连化学物理研究所,辽宁大连 116023)
探讨研究了天然药用植物川芎(L igusticum chuanxiongHort.)根茎内有效成分—川芎嗪的体外自由基清除活性,以及对过氧化氢诱导的内皮细胞氧化损伤的抑制作用。流式细胞仪检测川芎嗪对H2O2诱导内皮细胞内活性氧(ROS)产生的抑制作用;Griess法测定川芎嗪对一氧化氮(NO)的清除能力;比色法测定川芎嗪对羟自由基(·OH)、过氧化氢(H2O2)、DPPH自由基(· DPPH)及脂质过氧化的清除能力。川芎嗪可抑制H2O2诱导的内皮细胞内ROS的产生(P< 0.05),具有显著的OH·清除能力,并且对DPPH·、NO、H2O2及脂质过氧化反应均具有一定的清除能力。具有一定的自由基清除活性并可抑制内皮细胞的氧化损伤。
川芎嗪;氧化应激;自由基;血管内皮细胞
自由基是人体组织中许多生化反应的中间代谢物,一般情况下,自由基的产生和清除处于动态平衡,机体存在着完善的自由基清除系统,但在某些病理情况下(如动脉粥样硬化),这种平衡被打破,致使机体损伤,机体产生的的自由基不能被及时消除,活泼的自由基与不饱和脂肪酸反应,最终导致疾病的发生。
因此改善细胞功能,保护内皮细胞免受损伤,是预防和治疗血管性疾病的一种重要手段。在诸多因素导致内皮细胞损伤的过程中,氧化应激参与了其中的多个环节,所以天然药用植物来源的有效抗氧化成分在防治细胞损伤方面的特性和作用一直备受重视。
川芎为天然药用植物川芎L igusticum chuanxiongHort.的根茎,属伞形科藁本属,多产于四川、江西、湖北等一带,具有活血化淤作用。川芎嗪(tetramenthylpyrazine)是川芎中的有效单体之一,属生物碱类,可降低人体的血脂质过氧化物[1],抑制2,2-联苯-1-苦基肼(DPPH)或次黄嘌呤(HX)+黄嘌呤氧化酶(XO)诱导内、外源性自由基对大鼠离体心脏模型所致的心肌损伤[2];抑制家兔红细胞自氧化和H2O2所致红细胞溶血,并能抑制肝匀浆自发性和Fe2+诱导的脂质过氧化反应[3]。川芎嗪具有一定的体内抗氧化功效,但川芎嗪对自由基清除作用原理尚不十分清楚,为进一步探索其对各种自由基的作用方式,通过建立体外抗氧化模拟体系及细胞学实验模型,研究了其有效成分川芎嗪对自由基的清除能力,为揭示川芎嗪的抗氧化机理提供一定的理论依据与实验基础。
1 材料与方法
1.1 试剂与材料
川芎嗪、DMSO购于美国Sigma公司;DMEMF12培养基和胎牛血清购自美国Gibco公司;胞内ROS荧光探针(DCFH-DA)购于碧云天生物技术研究所;2,2-联苯-1-苦基肼贮存液(DPPH)、磷酸氢二钠、磷酸二氢钠、2-脱氧核糖、亚麻酸、硝普钠、硫氰酸铵、氯化亚铁、2-硫代巴比妥酸(TBA)、三氯乙酸、乙二胺四乙酸(EDTA)、抗坏血酸、过氧化氢购于阿拉丁试剂(中国)有限公司,其它试剂均为分析纯购于商业试剂公司。
1.2 实验方法
1.2.1 NO清除能力试验 川芎嗪对NO清除能力参照文献[4]的方法。取不同质量浓度的川芎嗪甲醇溶液(50~800 mg/L,以下相同)1.8 mL与0.2 mL硝普钠(2.5 mmol/L)充分混匀,25℃光照下准确反应2 h,之后取上清液,采用Griess法于540 nm波长下测定川芎嗪对NO清除能力,空白管为1.8 mL双蒸水加0.2 mL硝普钠(1.2.2 OH·清除能力的试验 2.5 mmol/L)。
参照文献[5-7]并略加以改进,采用比色法测定川芎嗪对Fenton体系产生的·OH清除作用。将不同浓度的川芎嗪(50~800 mg/L)加入Fenton体系(终浓度为3 mmol/L 2-脱氧核糖、0.1 mmol/ L FeCl2、1 mmol/L H2O2、0.1 mmol/L EDTA、0.1 mmol/L抗坏血酸)中充分混匀并用0.02 mol/L PBS补足3 mL,于37℃准确反应1 h。反应完毕,分别加入1 mL三氯乙酸(2.8%)及1 mL TBA (1%),充分混匀后将各样品管于100℃加热20 min。加热完毕,取出各样品管,流水冷却后,于532 nm下测定其吸光度值,并按下述公式计算川芎嗪对OH·的百分清除率。
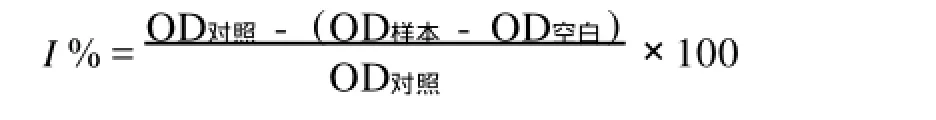
OD对照为未加TMP时测得的OD值;OD空白为Fenton体系中只加2-脱氧核糖时测得的OD值; OD样本为加入不同浓度TMP时测得的OD值。
1.2.3 DPPH·自由基清除试验 参照文献[8-9]的方法,采用比色法测定川芎嗪对DPPH·清除作用。将不同的浓度川芎嗪(50~800 mg/L)与1 mL浓度为90μmol/L的DPPH溶液混匀后加甲醇至4 mL,室温准确反应60 min后于515 nm下测定其吸光度值,并按下述公式计算川芎嗪对DPPH ·的百分清除率。

OD对照为未加TMP时测得的OD值;OD空白为未加DPPH时测得的OD值;OD样本为加入不同浓度TMP时测得的OD值。
1.2.4 抑制脂质过氧化反应的试验 川芎嗪抑制脂质过氧化反应的测定参照文献[10]采用比色法。将1 mL乙醇(99.5%)与13μL亚麻酸于10 mL离心管中混匀后,加入1 mL待测样品(对照管加入1mL去离子水)与0.5 mL PBS(p H 7.0),混匀,40℃,避光孵育24 h,之后取反应混合物100μL与4.9 mL硫氰酸铁反应体系(4.7 mL 75%的乙醇、0.1 mL 30%的硫氰酸铵及0.1 mL的2×10-2mol/ L氯化亚铁)充分混匀,准确反应3 min后于500 nm下测定其吸光度值,并按下述公式计算川芎嗪对脂质过氧化反应的抑制率(A及A0分别代表样品及空白对照的吸光度)。
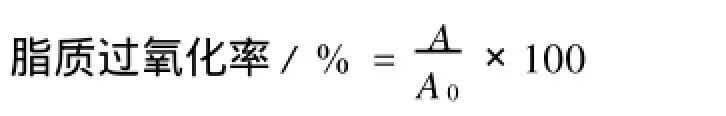
1.2.5 过氧化氢的清除率试验 过氧化氢清除率的测定按照文献[11]的方法进行。取不同质量浓度的川芎嗪(50~800 mg/L)各200μL与0.6 mL H2O2(40 mmol/L)混匀,室温准确反应10 min后于230 nm波长下测定其吸光度值,并按下述公式计算川芎嗪对H2O2的百分清除率。
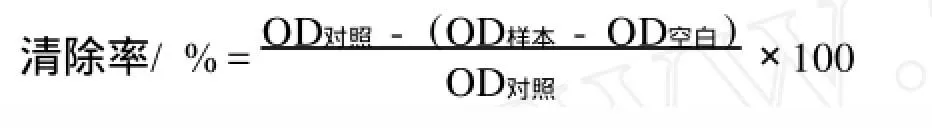
OD对照为未加TMP时测得的OD值;OD空白为未加H2O2时测得的OD值;OD样本为加入不同浓度TMP时测得的OD值。
1.2.6 内皮细胞的培养 人脐静脉内皮细胞生长于含10%胎牛血清的DMEM-F12培养基(含105U/L青霉素,105U/L链霉素,30 mg/L内生长因子添加物及5×103U/L肝素)中,置于37°C,5% CO2培养箱中贴壁培养,待细胞80%融合时,用0.125%胰酶(含0.02%EDTA)消化传代。
1.2.7 胞内ROS的清除能力试验 细胞内总ROS水平采用ROS的特异性荧光探针DCFH-DA测定[12],当DCFH-DA进入细胞内后可与细胞内活性氧结合生成具有荧光的DCFH。细胞接种于50 mL培养瓶,培养24 h,加入不同浓度的川芎嗪(50、100、200 mg/L)孵育4 h后,加H2O2(750μmol/L)继续培养20 h,去除培养液,PBS(p H 7.4)洗2遍,加20μM的ROS荧光探针(DCFH-DA)37℃避光孵育2 h,用PBS(p H 7.4)洗2遍,收集细胞后流式细胞仪(FACS Vantage SE,Becton Dickinson, USA)分析细胞内的荧光强度,选择激发波长485 nm,发射波长530 nm,之后做细胞滴片于荧光显微镜下观测ROS荧光变化。
在哲学常识课的教学过程中,如何做到哲理教育与情趣教育的有机结合呢?在教学实践中,我主要从以下几个方面进行了尝试,收到了较好的教育、教学效果。
1.2.8 统计分析 每批试验至少重复3次,数据以均数±标准差表示,采用SPSS11.0软件分析,两组间差异用Student’s.t.检验分析,多组间比较用方差分析法处理数据,P<0.01或P<0.05表示差异有统计学意义。
2 结果与分析
2.1 分析川芎嗪体外抗氧化试验
川芎嗪甲醇溶液的紫外可见吸收光谱图见图1。从图1可以看出,在230 nm波长处川芎嗪光吸收微弱,根据公式计算清除率时,可以排除干扰。川芎嗪在500、515、532及540 nm处均无明显吸收,因此在上述波长下测定时,不会对测定结果造成干扰,故可用比色法测定川芎嗪对H2O2、脂质过氧化、DPPH·、OH·和NO清除能力。
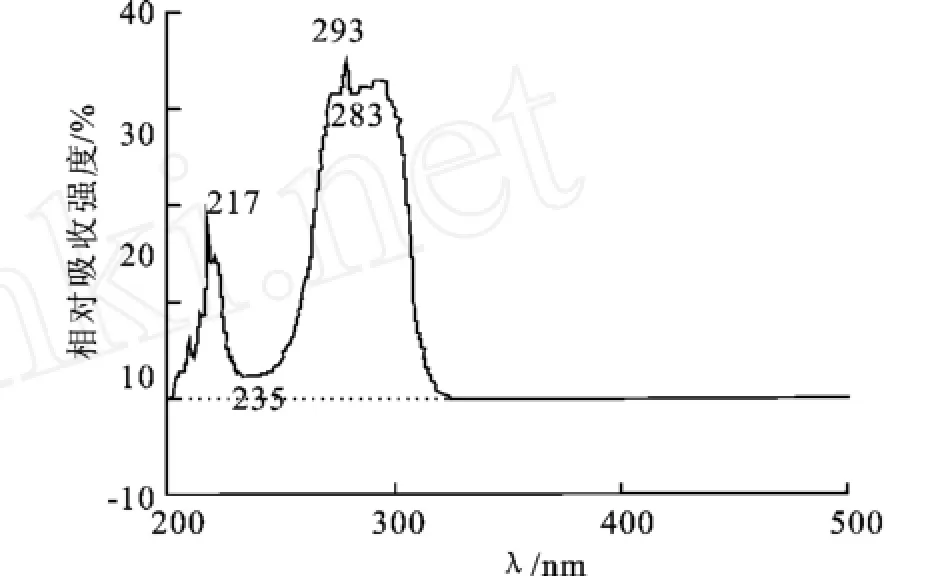
图1 川芎嗪波长扫描图Fig.1 Wavelength scanogram of TMP
2.2 NO的清除能力分析
NO在体内由一氧化氮合酶催化L-精氨酸生成,正常情况下,NO作为第二信使发挥其生理功能,当机体处于病理情况(如氧化应激),NO可与体内其它自由基结合生成氧化性更强的过氧化亚硝基阴离子,从而对机体造成更大的危害[13],因此,要考察川芎嗪的抗氧化能力,测定其对NO的清除能力是非常必要的。本研究采用硝普钠作为NO供体,前者在光照条件下产生NO+形式存在的NO,产生NO的量用Griess法测定。如图2所示,在所取的质量浓度范围(50~800 mg/L)内,川芎嗪对NO具有一定的清除作用,且具有一定的浓度依赖性。
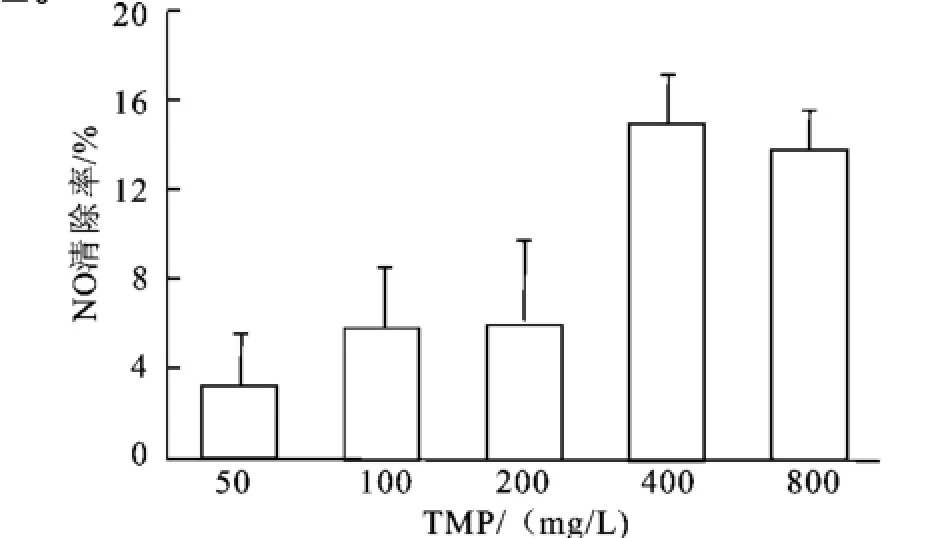
图2 川芎嗪对NO的清除Fig.2 NO scavenging activity of TMP
2.3 自由基的清除能力分析测定
2.3.2 DPPH·的清除能力分析 二苯基苦味肼自由基(DPPH·)是一种稳定的以氮为中心的自由基,其甲醇溶液呈紫色,在515 nm波长处有最大吸收峰。由于自由基清除剂与其单电子配对而使其吸收逐渐消失,在一定范围内褪色程度与其所接受的电子有定量关系,可以反映出试样清除稳定自由基的能力,因此已经成为评价抗氧化剂清除自由基能力的常用方法[14-16]。
本研究采用比色法,测定了50~800 mg/L不同质量浓度下川芎嗪对DPPH·的清除能力,实验结果见图3 B。由图3 B可知,川芎嗪在实验质量浓度范围内对DPPH·具有一定的清除作用,且对DPPH·的清除能力具有典型的量效关系。与川芎嗪的清除羟自由基能力相比,其对DPPH·清除能力较弱。
2.3.3 抗脂质过氧化能力分析 亚麻酸属多不饱和脂肪酸,是构成人体组织细胞的主要成分,常用于脂质氧化与抗氧化相关分析。本研究中,如图3 C所示,川芎嗪对脂质过氧化反应抑制效果不明显。这与张兆辉[17]等人结果有些矛盾,可能是由于所用的川芎嗪的剂量、脂质过氧化系统以及检测方法不同而造成的。
2.3.4 H2O2的清除能力分析 川芎嗪对H2O2的清除能力采用比色法测定。川芎嗪的质量浓度为50、100、200、400、800 mg/L。如图3 D所示,在所取的质量浓度范围内,川芎嗪对H2O2清除作用不明显,提示前者在用于H2O2所致的氧化应激损伤研究中,可与H2O2同时给药而不影响结果的可靠性。

图3 川芎嗪对自由基的清除Fig.3 Free radical scavenging activity of TMP
2.4 抑制胞内ROS的产生分析
目前被普遍接受的Ross修正的“炎症学说”认为,动脉粥样硬化是一种炎症性疾病,如氧化应激、高血压、炎症以及感染等因素均可导致血管损伤,促使动脉粥样硬化的发生和发展,而内皮细胞功能障碍又是动脉粥样硬化形成早期的始动环节。因此选用被普遍接受的研究动脉粥样硬化内皮细胞模型——人脐静脉内皮细胞作为研究对象。
过氧化氢作为胞内ROS的一种,经常作为外源性刺激制造氧化应激损伤模型,以此来考察氧化应激损伤发生时细胞以至机体发生的一系列应激改变,同时由于体外化学模型证实川芎嗪与H2O2不产生交叉反应,因此,川芎嗪完全可以应用于过氧化氢所致的氧化应激损伤模型中。基于此,本研究采用过氧化氢刺激的内皮细胞作为模型,考察川芎嗪对氧化应激损伤的保护作用。如图4流式检测发现当H2O2(750μmol/L)刺激20 h后,胞内ROS水平比正常增高约4.7倍(P<0.01),而预先加入不同浓度的川芎嗪(50~200 mg/L)预保护4 h后再加H2O2(750μmol/L),胞内ROS水平与模型组相比则有不同程度的下降,分别下降16.11%(P <0.05)、35.64%(P<0.01)、19.26%(P<0.05)。另外通过荧光显微镜观察发现荧光强度变化与流式所得结果相同(见图5)。
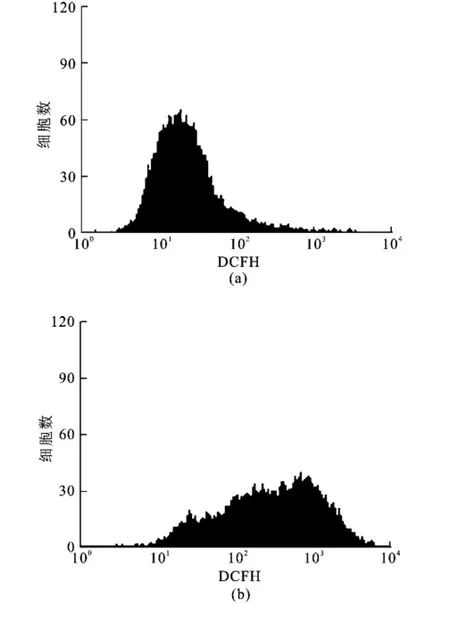
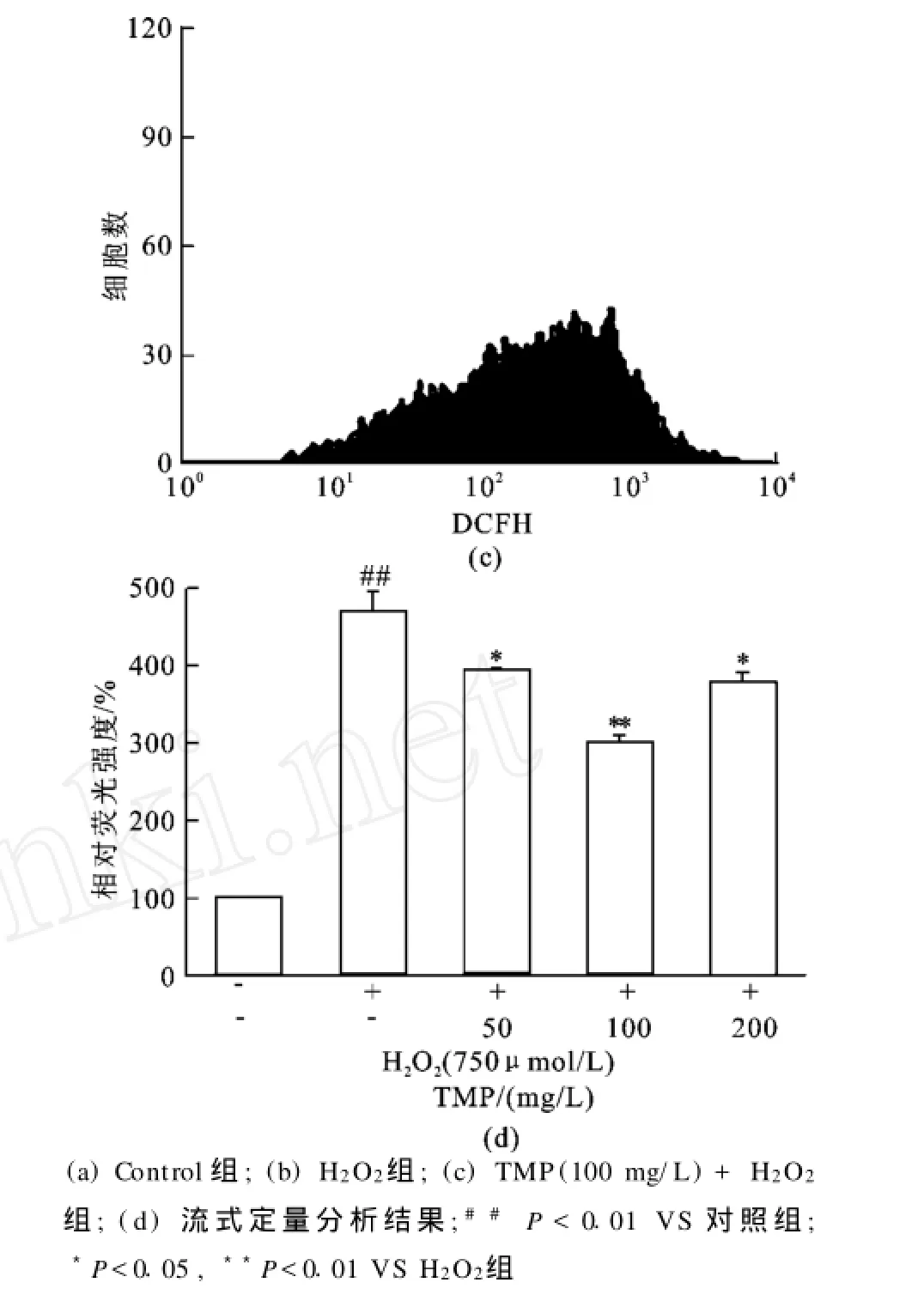
图4 流式检测川芎嗪抑制胞内R OS的产生(X ±S.n=3)Fig.4 Inhibitory effect of TMP on the production of in tracellular ROS analyzed by flowcytometry

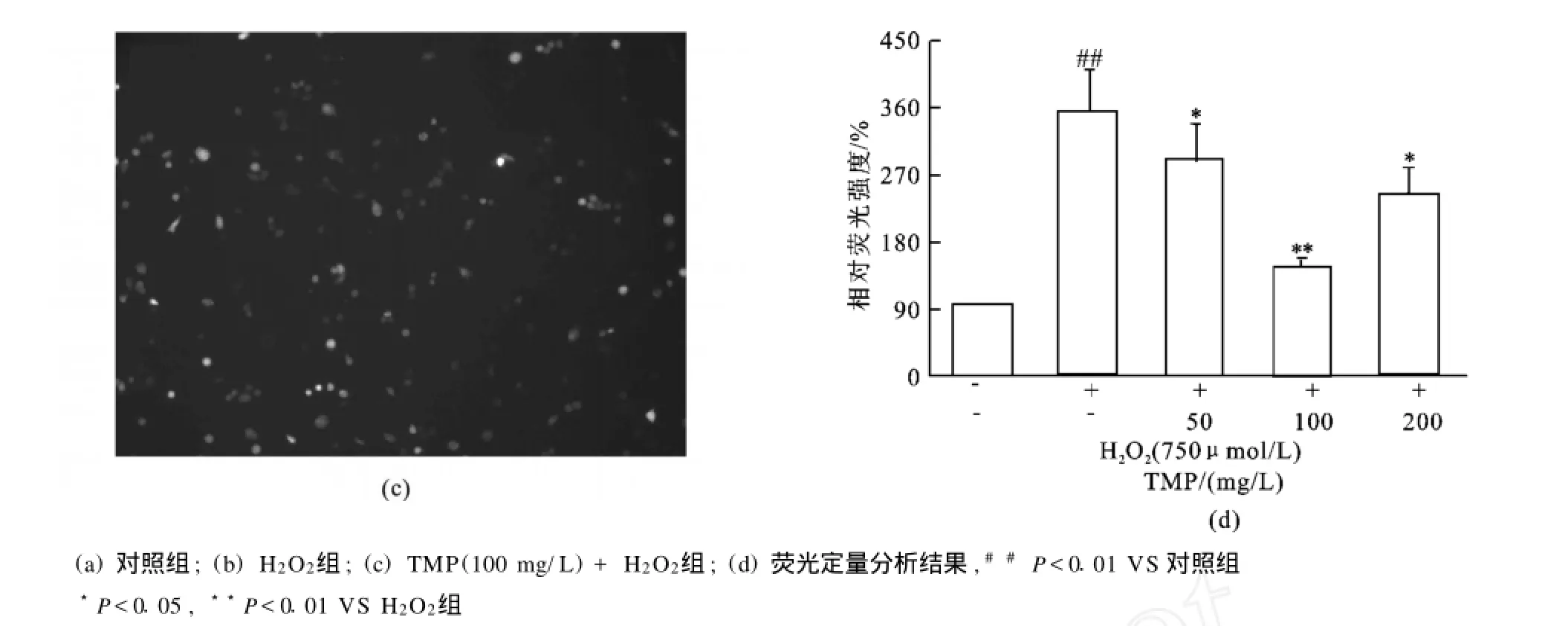
图5 荧光分析川芎嗪对胞内ROS产生的抑制作用(X ±S.n=3)Fig.5 Inhibitory effect of TMP on the production of intracellular ROS analyzed by fluorescent quantitation
由此可以看出,虽然川芎嗪对H2O2清除能力欠佳,但它可以抑制H2O2诱导的胞内ROS的产生,这提示我们川芎嗪可能是通过其他途径(如上调细胞内某些抗氧化酶的水平)来抑制胞内ROS的产生减轻细胞的氧化损伤。
3 结 语
研究通过体外抗氧化体系从抑制NO、OH·、H2O2、DPPH·及脂质过氧化等方面证明了川芎嗪的自由基清除能力:在所取的浓度范围内(50-800mg/L),川芎嗪对OH·的清除率都超过50%,具有显著的清除作用,对NO、DPPH·具有一定的清除作用且浓度依赖关系较明显,对脂质过氧化及过氧化氢的清除能力较对羟自由基清除能力弱,另外流式细胞仪检测发现川芎嗪对过氧化氢诱导的内皮细胞胞内ROS的生成具有显著的抑制作用。综上所述,川芎嗪具有一定的体外自由基清除活性,并能抑制过氧化氢诱导的胞内ROS的生成。
[1]王倩,汪海.具有抗动脉粥样硬化作用的天然药物及其单体化合物[J].世界科学技术—中药现代化,2002,4(5):52-58.
WANG Qian,WANG Hai.Natural medicines and their monomers with anti-atherosclerosis effects[J].World Science and Technology/Modernization of Traditional Chinese Medicine,2002,4(5):52-58.(in Chinese)
[2]刘红,艾明仙,阳辉.川芎嗪对自由基致大鼠离体心脏损伤的保护作用[J].中药药理与临床,2007,23(5):68-70.
LIU Hong,AI Ming-xian,YANG Hui.Protective effects of tetramethylpyrazine on free radicle-induced injury in isolated rat heart[J].Pharmacology and Clinics of Chinese Materia Medica,2007,23(5):68-70.(in Chinese)
[3]刘晓丽,霍展样,张金莲.盐酸川芎嗪体外抗氧化作用的研究[J].中国航天医药杂志,2003,5(2):37-39.
LIU Xiao-li,HUO Zhan-yang,ZHANGJin-lian.Antioxidative activity of ligustrazine in vitro[J].Medical Journal of CASE,2003,5(2):37-39.(in Chinese)
[4]Meng Xue-lian,Yang Jing-yu,Chen Guo-liang,et al.RV09,a novel resveratrol analogue,inhibits NO and TNF-alpha production by LPS-activated microglia[J].International Immunopharmacology,2008,8(8):1074-1082.
[5]Singh HP,Mittal S,Kaur S,et al.Chemical composition and antioxidant activity of essential oil from residues of Artemisia scoparia[J].Food Chemistry,2009,114(2):642-645.
[6]Xing Ronge,Yu Hua-hua,Liu Song,et al.Antioxidant activity of differently regioselective chitosan sulfates in vitro[J]. Bioorganic&Medicinal Chemistry,2005,13(4):1387-1392.
[7]吕晓玲,朱惠丽,姜平平,等.紫苏提取物抗氧化活性体外实验研究[J].中国食品添加剂,2003,5:22-25.
LüXiao-ling,ZHU Hui-li,J IANG Ping-ping,et al.In vitro Antioxidant Activity of Perillae Leaves Extract[J]. China Food Additives,2003,5:22-25.(in Chinese)
[8]Bozin B,Mimica-Dukic N,Simin N,et al.Characterization of the volatile composition of essential oils of some lamiaceae spices and the antimicrobial and antioxidant activities of the entire oils[J].Journal of Agricultural and Food Chemistry, 2006;54(5):1822-1828.
[9]Liu Shih-chuan,Lin Jau-tien,Wang Chin-kun,et al.Antioxidant properties of various solvent extracts from lychee(Litchi chinenesis Sonn.)flowers[J].Food Chemistry,2009,114:577-581.
[10]Huang Rong-hua,Mendis E,Kim SK.Factors affecting the free radical scavenging behavior of chitosan sulfate[J].International Journal of Biological Macromolecules,2005,36(1-2):120-127.
[11]Ruch RJ,Cheng Shu-jun,Klaunig J E.Prevention of cytotoxicity and inhibition of intercellular communication by antioxidant catechins isolated from Chinese green tea[J].Carcinogenesis,1989,10(6):1003-1008.
[12]Liu Hong-tao,Li Wen-ming,Xu Gang,et al.Chitosan oligosaccharides attenuate hydrogen peroxide-induced stress injury in human umbilical vein endothelial cells[J].Pharmacological Research,2009,59(3):167-75.
[13]Cai H.Hydrogen peroxide regulation of endothelial function:origins,mechanisms,and consequences[J].Cardiovasc Res,2005,68:26-36.
[14]Cotclle N,Bemier JL,Cattcau J P,et al.Antioxidant properties of hydroxyl-flavones[J].Free Radical Biology and Medicine,1998,20(1):35-43.
[15]Cavin A,Hostettmann K,Dyatmko,et a1.Antioxidant and lipophilic constituents of tinospora crispa[J].Planta medica, 1998,64:393-396.
[16]陆健,樊伟,孔伟宝,等.大麦总多酚不同溶剂提取物对DPPH自由基清除能力的影响[J].食品与生物技术学报,2008, 27(1):57-61.
LU Jian,FAN Wei,KONG Wei-bao,et al.Study on the extraction of total polyphenol in Barley(Hordeum vulgare L.) and its ability on scavenging DPPH free radical[J].Journal of Food Science and Biotechnology,2008,27(1):57-61.(in Chinese)
[17]Zhang Zhao-hui,Yu Shao-zu,Wang Zhen-tao,et al.Scavenging effects of tetramethylpyrazine on active oxygen free radicals[J].Acta Pharmacologica Sinica,1994,15(3):229-231.
(责任编辑:杨萌)
Isolation and Antioxidative Activity of the Substrate Isolated from Chuanxiong
LI Wen-ming1, LIU Hong-tao2, LI Jia-jia1, ZHANGJi1, SHI Lei1, YU Chao*1
(1.Institute of Life Science,Chongqing Medical University,Chongqing 400016,China;2.Dalian Institue of Chemical Physics,Chinese Academy of Science,Dalian 116023,China)
The objective of this study is to investigate scavenging activity of tetramethylpyrazine (TMP),an effective constituent isolated from the rhizome of nature medicinal plantL igusticum chuanxiongHort.,on free radicals in vitro and inhibitory effect of TMP on H2O2-induced oxidative damage of endothelial cells.The inhibition ofH2O2-induced intracellular reactive oxygen species(ROS)by TMP was analyzed on a FACS Vantage SE flow cytometer.The suppressive effect of TMP on nitric oxide(NO)production was measured by Griess method.The scavenging effect of TMP on free radicals including hydroxyl radical(·OH),hydrogen peroxide (H2O2),DPPH free radicle(DPPH·)and lipid peroxidation free radical was determined by colorimetry method.It was found that TMP inhibited H2O2-induced production of intracellular ROS and exhibited strong scavenging activity against hydroxyl radical.In addition,TMP displayed scavenging activity against DPPH·,NO,H2O2and lipid peroxidation.The results presented here indicated that TMP may exhibit scavenging activity on free radicals in vitro andinhibitory effect on oxidative damage of endothelial cells.
tetramethylpyrazine,oxidative stress,free radical,vascular endothelial cell
O 629.32;R 285.5
:A
1673-1689(2010)01-0064-07
2009-02-25
重庆市教育委员会科学技术研究项目资助(NO KJ070304);重庆医科大学人才启动基金资助项目(No 0200100263)。
*通讯作者:于超(1963-),男,辽宁沈阳人,医学博士,教授,主要从事天然药物分析与研究。Email:yuchaom@ 163.com
