包埋吸附法固定化酒用酸性脲酶的研究
2010-08-27吴召慧田亚平
吴召慧, 田亚平
(江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
包埋吸附法固定化酒用酸性脲酶的研究
吴召慧, 田亚平*
(江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
用包埋吸附法固定化酒用酸性脲酶,探讨了固定化的条件、固定化酶的部分性质以及固定化酶在黄酒中的应用。结果表明:固定化酒用酸性脲酶的最适海藻酸钠浓度、CaCl2质量浓度和壳聚糖浓度分别为2.0、5.0和0.3 g/dL,最适固定化时间为2.5h,固定化率为82.3%;最适反应温度40℃、最适p H4.0、半衰期为48d,固定化酶的比活为3.6 U/mg;在35℃下添加量为0.1 g/mL (固定化酶质量/黄酒体积),24 h内黄酒尿素去除率达65%,同样条件下连续使用去除黄酒中尿素,使用13次时尿素去除率达39.7%。
酸性脲酶;吸附包埋;黄酒;尿素去除率
脲酶是一种催化尿素水解为氨和CO2的高度专一性酶,尿素的酶促水解速度是非酶水解速度的1014倍。根据脲酶的最适作用p H,可以将脲酶分为酸性、中性和碱性。酸性脲酶能够耐受酸性环境,并且其中有些酸性脲酶在低乙醇度酒精饮料中仍具有很高的活性,因而可以用来去除酒精饮料中所含有的尿素[1-2]。研究发现90%的氨基甲酸乙酯(简称EC,一种致癌物质)是尿素和乙醇经化学反应后生成的产物[3],向酒中添加酸性脲酶是降低酒中尿素含量最为简便、实用,也是目前较常用的方法[4],近年来OIV(国际葡萄·葡萄酒组织)、澳大利亚、新西兰和日本等国家都相继通过了允许添加酸性脲酶降低酒中尿素的决议[5]。游离酶在溶液中不稳定,容易变性和失活,反应后酶难以分离回收,无法重复使用,利用固定化酶可避免以上的不足,扩大了酶的使用范围。国内外研究报道各种不同的固定化脲酶还可用于医疗诊断[6],环境监测,工业生产等领域。
2006年本课题组通过筛选获得了一株酸性脲酶产生菌Enterobactriasp.R2SYB082,并对发酵生产条件及粗酶在黄酒中的应用进行了研究[7]。在此基础上,作者通过包埋吸附法制备固定化酒用酸性脲酶,利用壳聚糖和海藻酸钠在一定条件下可以形成稳定的聚电解质化合物[8]固定该酶,以减少酶的泄露,且海藻酸钠和壳聚糖对环境和人体没有危害,对酒的安全性没有影响。
1 材料与方法
1.1 材料
1.1.1 酸性脲酶 作者所在实验室制备所得。
1.1.2 试剂 海藻酸钠:化学纯,中国医药(集团)上海化学试剂公司;氯化钙:分析纯,中国医药(集团)上海化学试剂公司;壳聚糖(脱乙酰度,90%):山东奥康生物科技有限公司;二乙酰一肟:上海化学试剂厂生产;硫代氨基脲:上海化学试剂厂产品。其余为国产分析纯试剂。
1.1.3 仪器 722光栅分光光度计:上海第三分析仪器厂生产;PHS-25型p H计:上海雷磁仪器厂生产;TG-328A电光分析天平:梅特勒公司产品。
1.2 方法
1.2.1 酶活测定方法
1)游离酶活测定 采用靛酚蓝反应采用比色法,见参考文献[9]。
酶活力定义:在常压,37℃,p H5.5条件下,每分钟分解底物产生1μmol氨为一个酶活力单位。
2)固定化酶活测定 一定体积的酶液经固定化后加入一定体积的柠檬酸缓冲液配制的pH值5.5的体积分数为3%尿素溶液在37℃恒温水浴箱中保温30 min后,过滤取滤液,下面方法与游离酶活力测定相同。为便于考察变量对固定化酶活的影响,以同组实验中酶活最高位100%,进行数据处理。
3)尿素去除率的测定方法:二乙酰一肟法,见参考文献[10]。
1.2.2 固定化方法 称取一定质量的海藻酸钠溶于一定体积的酶液中,混匀后静置一段时间至溶液中无气泡,用注射器注射入含有一定浓度壳聚糖的一定浓度的CaCl2溶液中,振荡一定时间后,用去离子水洗涤3次,滤干水分。4℃冰箱保藏备用。
2 结果与分析
2.1 固定化酶的制备
2.1.1 海藻酸钠质量浓度对固定化酒用酸性脲酶的影响 海藻酸钠在固定化过程中主要起包埋酒用酸性脲酶的作用,实验考察了其浓度对固定化小球的强度,成球难易程度,成球形状,固定化酶的酶活等的影响,结果见表1和图1。
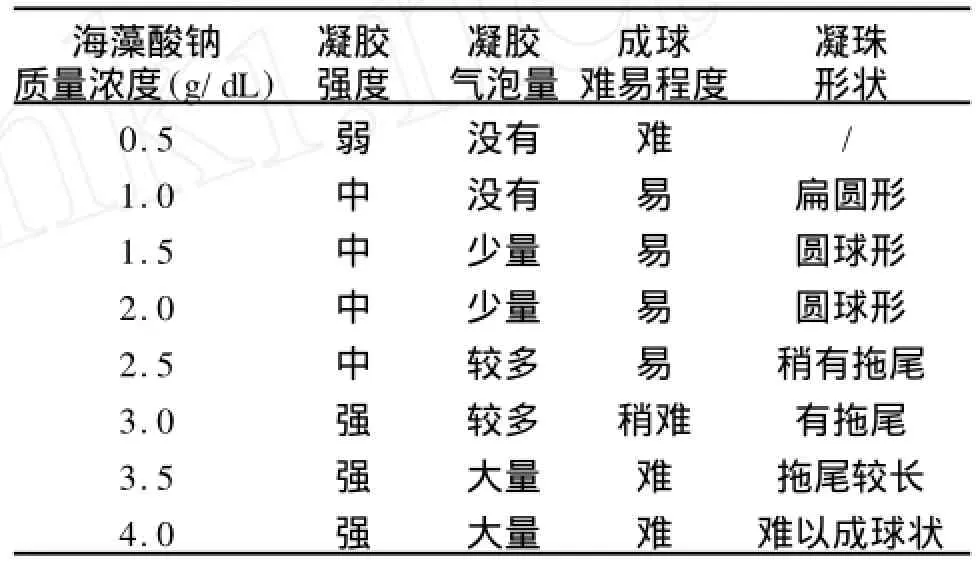
表1 海藻酸钠质量浓度对固定化小球的影响Tab.1 Effect of sodium alginate concentration on the forming process of immobilization granule
表明固定化酒用酸性脲酶的合适海藻酸钠质量浓度为2.0 g/dL。海藻酸钠质量浓度增加导致凝胶强度逐渐加强,但溶液中的气泡也有所增加,当海藻酸钠浓度大于2.0 g/dL时,小球形状趋于不规则。此浓度下的固定化小球的图片见图2,固定化酸性脲酶的固定化率为82.3%,固定化率可能是因为部分酶粘在器皿壁上未能制成固定化小球和固定化酶的空间位阻效应共同作用的结果。
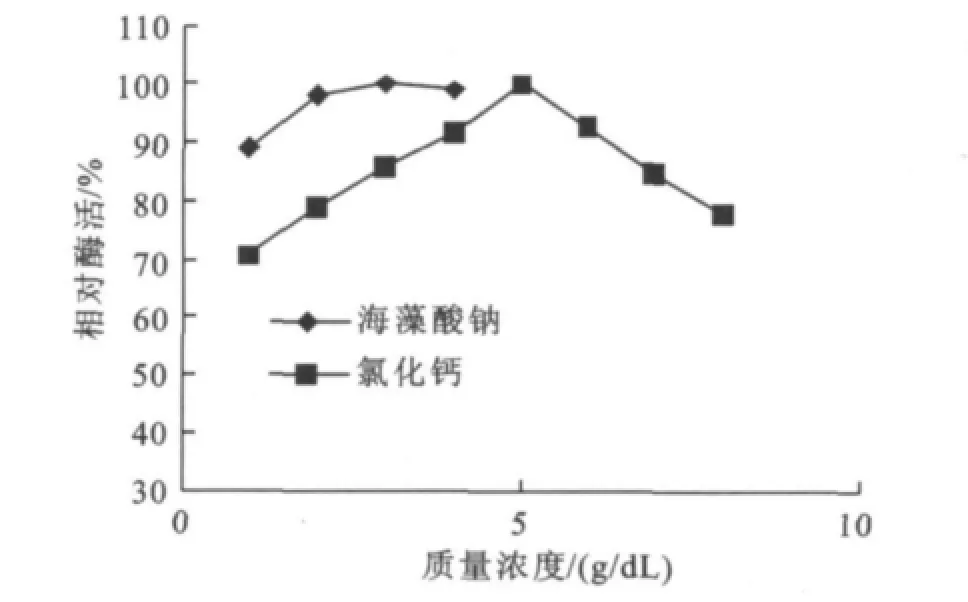
图1 海藻酸钠和C aCl2质量浓度对固定化酶活力的影响Fig.1 Effect of sodium alginate and calcium chloride concentration on immobilizedacid urease activity
图2 固定化小球的图片Fig.2 The picture of immobilization beads
2.1.2 CaCl2质量浓度对固定化酒用酸性脲酶酶活的影响 CaCl2质量浓度影响固定化小球的强度,有研究报道高浓度的Ca2+往往对酒用酸性脲酶酶活有抑制作用[11],图1结果表明,固定化酒用酸性脲酶的最适CaCl2质量浓度为5.0 g/dL。
2.1.3 壳聚糖质量浓度对固定化酒用酸性脲酶酶活的影响 壳聚糖对固定化酶活影响见图3。图3结果显示固定化酒用酸性脲酶的最适壳聚糖质量浓度为0.3 g/dL。壳聚糖对脲酶有吸附作用,随着壳聚糖的增加附着的酶有所增加,但过高质量浓度的壳聚糖会在小球表面形成一层致密的膜,反而阻碍底物的扩散。
2.1.4 时间对固定化酒用酸性脲酶酶活的影响时间对酶性脲酶活影响见图4。从图4可以看出,固定化的最适时间为2.5 h,随着固定化时间的增加,载体的硬度也随之增大。这是由于固定化时间越长,海藻酸钠与氯化钙的反应就越完全,形成的海藻酸钙凝胶珠就越致密。
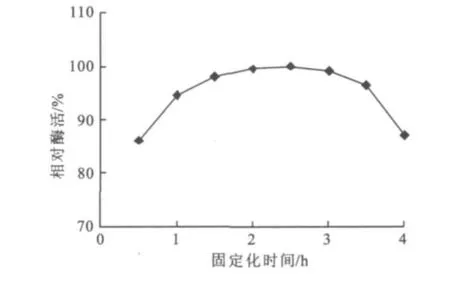
图4 固定化时间对固定化酒用酸性脲酶酶活的影响Fig.4 Effect of immobilized time on immobilized acid urease activity
2.2 固定化酒用酸性脲酶性质的研究
2.2.1 固定化酒用酸性脲酶的贮存稳定性 将游离酶和固定化酶放于4℃冰箱中,每隔3 d分别测定酶活见图5。由图5可以看出:游离酶放置26 d后酶活下降一半,而固定化酶的半衰期为48 d,说明固定化酶的贮存稳定性较游离酶又所加强。

图5 固定化酸性脲酶与游离酶的贮存稳定性Fig.5 Effect of storage time on enzyme activity of free acid urease and immobilized acid urease
2.2.2 固定化酒用酸性脲酶的最适反应温度 最适反应温度见图6。从图6得出:固定化酶的酶活在40℃达到最大,而游离酶最适反应温度为35℃。从固定化酶,游离酶的比较图中可以看出,固定化酶有较高的相对活力的温度范围比游离酶大。酸性脲酶固定化以后最适反应温度有所提高。
2.2.3 固定化酒用酸性脲酶的最适p H 最适p H见图7。图7表明:固定化酒用酸性脲酶的酶活在p H 3~5范围相对稳定,最适p H为4。相对于游离酶的p H 5.5的最适p H值,固定化酒用酸性脲酶的最适p H向酸性区域发生了迁移,p H稳定性也有所提高。说明酶固定化后催化性质发生了改变,且各种黄酒的p H都在4左右,该脲酶在固定化后更适合在黄酒中发挥作用。
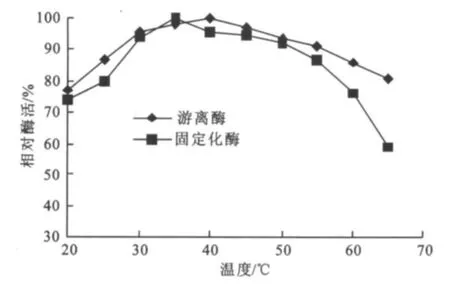
图6 温度对游离酶和固定化酶酶活的影响Fig.6 Effect of temperature on enzyme activity of free acid urease and immobilized acid urease
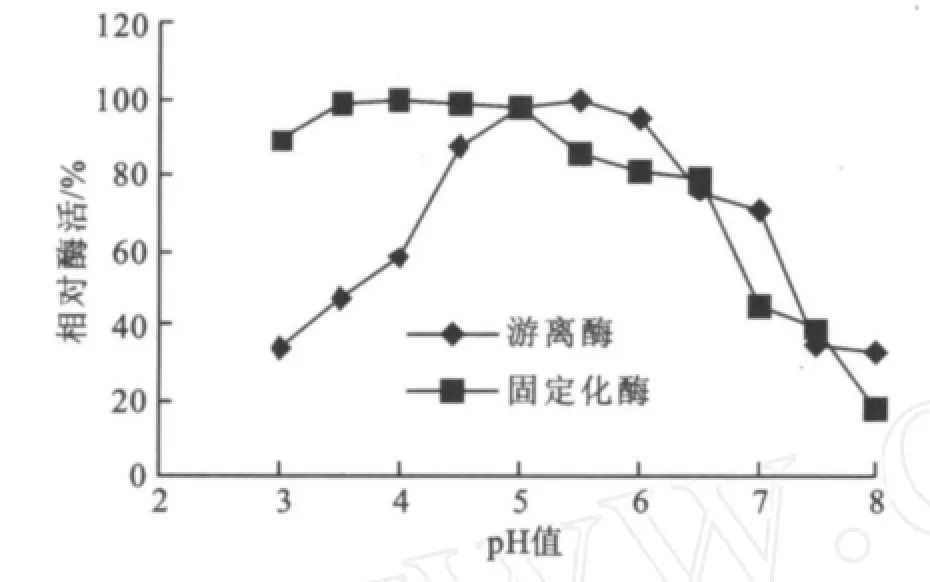
图7 pH对游离酶和固定化酶酶活的影响Fig.7 Effect of pHon enzyme activity of free acid urease and immobilized acid urease
2.2.4 固定化酒用酸性脲酶的温度稳定性 其酶活的温度稳定性见图8。由图8可以看出:固定化酒用酸性脲酶在25~55℃之间酶有较好的热稳定性,相对酶活都在80%以上。当酶液在较高温度(65℃)时,保存3 h相对酶活仍在70%左右。而课题组前期研究发现游离酶在65℃时保存3 h相对酶活仅有40%左右,固定化酶比游离酶有较好的热稳定性。
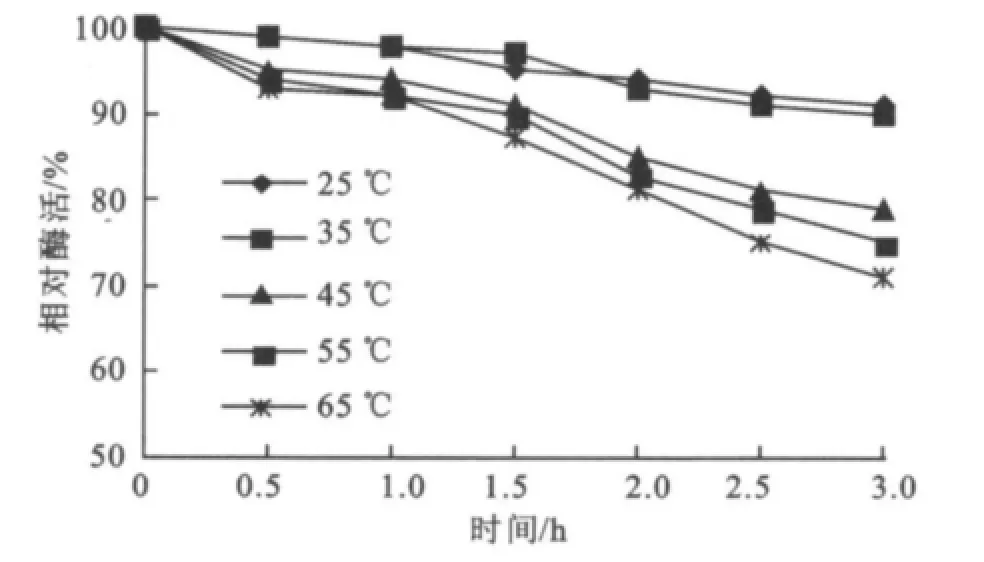
图8 固定化酸性脲酶温度稳定性Fig.8 The temperature stability of immobilized acid urease
2.2.5 固定化酒用酸性脲酶的p H稳定性 酶活最适pH值见图9。由图9可以看出:固定化酒用酸性脲酶在pH 3~6.5之间有较好的稳定性,酶活都保持在80%以上,当pH值高于7时酶活损失比较大。
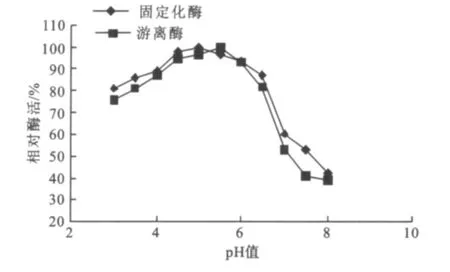
图9 固定化酸性脲酶的pH稳定性Fig.9 The pHstability of free acid urease and immobilized acid urease
2.3 固定化酒用酸性脲酶去除黄酒中的尿素
固定化酒用酸性脲酶用于去除黄酒中的尿素,在35℃,添加量为0.13 U/mL时,每隔24 h测定尿素去除率见图10。从结果可以看出尿素去除效果在前3 d内比较明显,24 h后酒样1和酒样2的尿素去除率分别达到65%和62%,前3 d酒样1和酒样2的尿素去除率分别达到77%和80%,同样条件下,在连续使用13次后其尿素去除率为39.7%,即重复反应13次后尿素去除率降低一半左右,结果见图11。
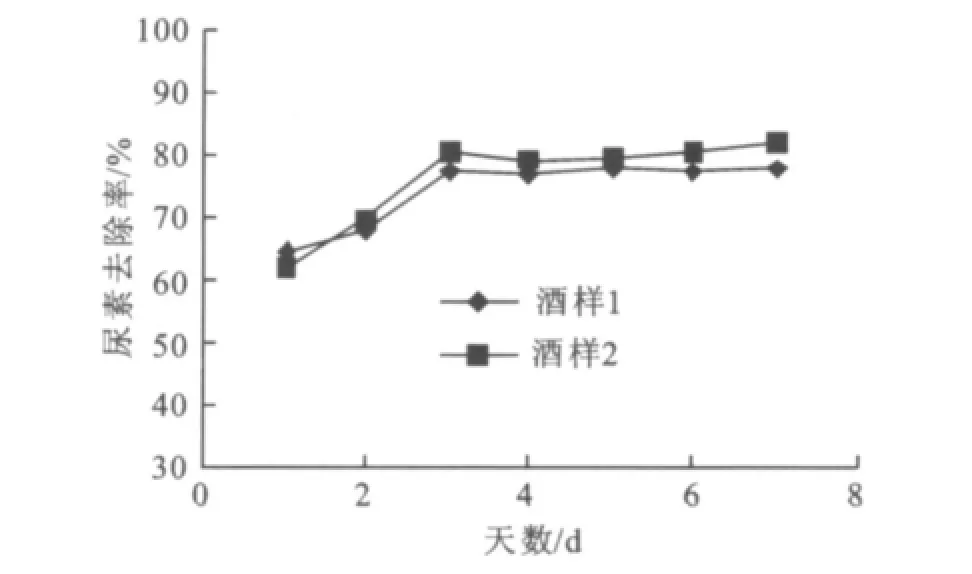
图10 固定化酒用酸性脲酶的尿素去除率Fig.10 The urea removal rate of immobilized acid urease
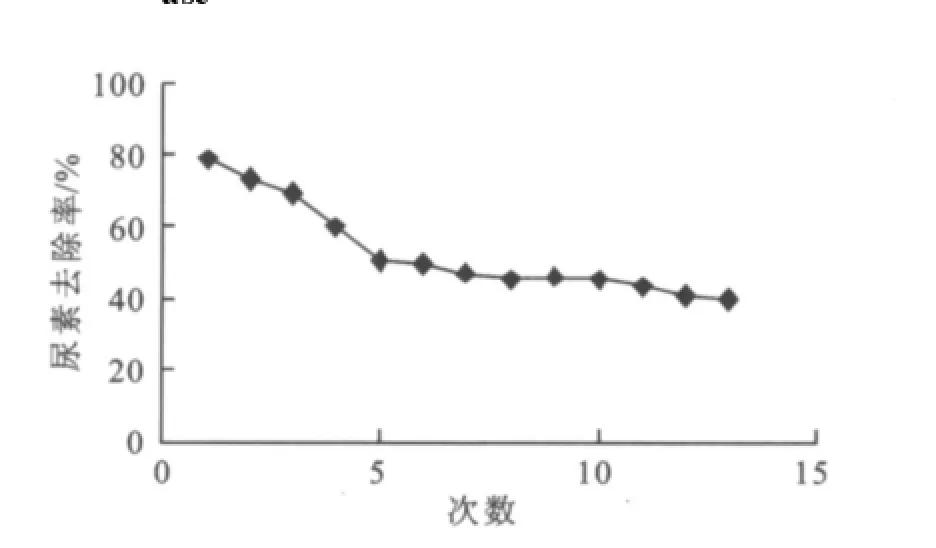
图11 连续使用13次固定化酒用酸性脲酶的尿素去除率Fig.11 The urea removal rate of immobilized acid urease continuous using thirteen times
3 结 语
用包埋吸附法固定化酒用酸性脲酶,所用的材料海藻酸钠和壳聚糖都是对人体无害的物质,且固定化酶的制备成本低,过程简单,条件温和。固定化酶在酒类饮料中使用后不影响酒类饮料的饮用,可以多次去除其中的微量尿素,方便回收。但此方法在使用的强度和稳定性方面距工业应用还有一定的距离,还有待于进一步改进。
[1]Kobashi K,Takabe S.Removal of urea f rom alcoholic beverages with an acid urease[J].Appl Toxi,1988,8(1):73-74.
[2]Yoshizawa K,Takahashi K.Utilization of urease for decomposition of urea in sake[J].Brew Soc Japan,1988,83(2): 142-144.
[3]Yoshizawa K,Takahshi K.Efeecets of temperature and sake components on the production of ethylcarbamate.[J].Brew Soc Japan,1988,83(1):69-73.
[4]陆健.酒精饮料中的氨基甲酸乙酯[J].江苏食品与发酵,1994,3:27-29.
LUjian.Urethan in alcoholic beverage[J].Jiangsu Food and Fermentation,1994,3:27-29.(in Chinese)
[5]Kakimoto S,Sumino Y.Purification and characterization of acid urease fromL actobacillus f ermentum[J].Appl Microbiol Biotechnol,1990,32:538-543.
[6]Butzke C E,Bisson L F.Ethyl carbamate preventative action manual[M].US:Food and drug Administ ration,1997:7.
[7]王玉美,田亚平,赵光鳌,等.肠杆菌酸性脲酶的提取及基本特性[J].食品工业科技,2007(4):178-180.
Wang Yu-mei,Tian Ya-ping,Zhao G A.The extraction and characterization of an acid urease f romEnterobactersp[J]. Science and Tecnology of Food Industry,2007(4):178-180.(in Chinese)
[8]Filiz Kara,Gǒkhan Demirel,Hayrettin Tümtürk.Immobilization of Urease by Using Chitosan-Alginate and Poly(Acrylamidco-Acrylic Acid)/k-carrageen an Kupports[J].Bioprocess and Engineering,2006,29(3):207-211.
[9]Kaplan A.Methods of biochemical analysis[M].New York,1965.17:311.
[10]中华人民共和国卫生部.游泳用水水质检验方法[S].1985.10-11.
[11]杨鲁强,王松华,田亚平等.酒用酸性脲酶的纯化及其N端序列的测定[J].食品与生物技术学报.2008(11):93-97.
YANGLu-qiang,WANG Song-hua,TIAN Ya-ping.Purification and N-terminal analysis of an acid urease[J].Journal of Food Science and Biotechnology,2008(11):93-97.(in Chinese)
(责任编辑:杨萌)
Immobilization of Acid Urease Via Adsorption and Embedded
WU Zhao-hui, TIAN Ya-ping*
(Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
The immobilization conditions,and application acid urease via adsorption and embedded were investigated in this study.The optimum concentration of sodium alginate,calcium chloride and chitosan was 2.0,5.0 and 3.0 g/dL,respectively.the optimal immobilized time was 2.5h, the immobilization rate was 82.3%,and the reaction take place at 40℃and p H4.The half-lives of immobilized acid urease was 48 days,the unit of immobilized urease was 3.6U/mg,the urea removal rate was 65%at 35℃,24 h and the addition level of immobilized acid urease was 0.1g/ mL(the quality of immobilized enzyme/the volume of Chinese rice wine),under the same conditions,the urea removal rate still reached at 39.7%under the continuous using thirteen times.
acid urease adsorb,embed rice wine,urea removal rate
TS 201.2
:A
1673-1689(2010)03-0437-05
2009-04-20
国家“十一五”科技支撑计划项目(2007BA K36B02)。
*通信作者:田亚平(1964-),女,安徽淮南人,工学博士,教授,博导,主要从事生物活性物质方面的研究。Email:yapingtian@hotmail.com
