尾静脉移植骨髓间充质干细胞治疗脑缺血损伤大鼠的研究
2010-08-25张向群王新平景文莉
张向群, 王新平, 景文莉
急性脑缺血后,因缺血灶神经细胞死亡而导致的神经功能缺损至今仍缺乏真正有效的治疗措施和药物,九十年代初神经干细胞的发现,打破了神经元不能再生的传统观念,为中枢神经系统的损伤修复注入了新的活力。但由于神经干细胞取材、培养困难,而且有免疫排斥、来源受限、伦理道德的约束限制了其进一步应用。而骨髓间充质干细胞(Bone marrow mesenchymal stem cells MSCs)具有取材、培养方便,可取自体骨髓进行自体移植,并有多种分化潜能等优点,具有良好的临床应用前景。本实验旨在通过尾静脉途径移植 MSCs观察在大鼠脑缺血再灌注损伤中的治疗效果,探讨可能的治疗机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物 健康成年 SD(Sprague-Dawley)大鼠,体重分别为 140~160g和 260~280g,雄性,由中国军事医学科学院动物中心(北京)提供。
1.1.2 主要仪器和试剂 5'-溴-2-脱氧尿嘧啶核苷(BrdU,MP Med Biochemicals生产);大鼠立体定向仪(西安西北光电仪器制造有限公司制造);鼠抗人尿嘧啶脱氧核苷(Brdu)单克隆抗体(中杉公司);兔抗人神经元特异性烯醇化酶(NSE)多克隆抗体(中杉公司);兔抗人胶质纤维酸性蛋白(GFAP)多克隆抗体(中杉公司);脑源性神经营养因子(BDNF)多克隆抗体(博士德公司);切片机 (MicroM HM325德国);图像采集 Olympus显微镜(北京航空航天大学图像采集软件)
1.2 实验方法
1.2.1 MSCs的分离和培养及诱导 用断颈法急性处死 SD大鼠并消毒,无菌条件下取股骨及胫骨。用 MSCs标准培养液冲洗骨髓腔,冲出细胞悬液离心,弃上清液,小心叠加到密度为 1.077的 Ficoll-Paque淋巴细胞分离液上层,取单个核细胞层,以 106/cm2密度接种到 75cm2培养瓶中培养。隔日全量换液。待原代细胞生长至瓶底的 80%~90%时,用 0.25%胰蛋白酶液和 0.02%EDTA液消化细胞,离心后重新加入标准培养液悬浮细胞,以 1∶1比例传代细胞。
1.2.2 MCAO动物模型 用改良 Zea Longa's线栓法阻断左侧大脑中动脉(MCAO)制成局灶性脑缺血模型,1h后拔线栓再灌注。模型成功的判定:右侧肢体瘫痪,以前肢为重。表现为提尾时大鼠右前肢屈曲,内收;或者行走时向右侧转圈或倾倒。
1.2.3 神经功能缺损评分(NSS) 神经功能缺失评分根据 Z.Speise的方法,此评分共 12项,总分 16分,完全正常鼠 =0分,完全功能缺失 =16分,大部分存活鼠梗死后功能评分为 12~14分。
1.2.4 MSCs的移植 制作模型成功后的 7d通过通过尾静脉注射 1×106Brdu标记的 MSCs细胞,对照组不接种。
1.2.5 脑组织石蜡切片制备及免疫组化染色
在不同时间点杀鼠后用 4%多聚甲醛磷酸盐缓冲液 300ml灌注固定,取脑后置于固定液中 24h以上。常规石蜡切片以备 HE染色、免疫组织化学染色。
2 结 果
2.1 骨髓间充质干细胞的分离后镜下的形态见图1。

图1 MSCs呈漩涡状生长融合 ×40
2.2 尾静脉组在不同时间点的大鼠头 MRI成像的比较 可以看到造MCAO模型后尾静脉移植干细胞后 1d左侧大脑半球大面积的高信号影即梗死灶(见图2),3m后再次复查 MRI时没有高信号影(见图3),大鼠运动功能恢复正常。

图2 尾静脉组 1d的 MRI

图3 尾静脉组 3m的 MRI
表1 不同时间点两组大鼠神经功能评分的影响±s)

表1 不同时间点两组大鼠神经功能评分的影响±s)
与对照组比较*P<0.05
尾静脉组对照组P值14.40±0.547714.50±0.54770.4519.50±0.5477*12.33±0.51640.0397.60±0.5345*10.50±0.54770.0165.60±0.5477*8.00±0.63250.0253.60±0.5477*5.50±0.54720.020
2.3 神经功能缺损评分 见表1。
2.4 HE染色结果 对照组可见到明显梗死灶,缺血区神经细胞明显减少,可见神经细胞变性、坏死,呈胞体皱缩,核固缩、碎裂、溶解,胞浆浓缩红染,神经纤维疏松,间质水肿明显,炎症细胞浸润。移植细胞组病理变化较对照两组轻,神经细胞变性、坏死数量明显变少,间质水肿较轻(见图4、图5)。
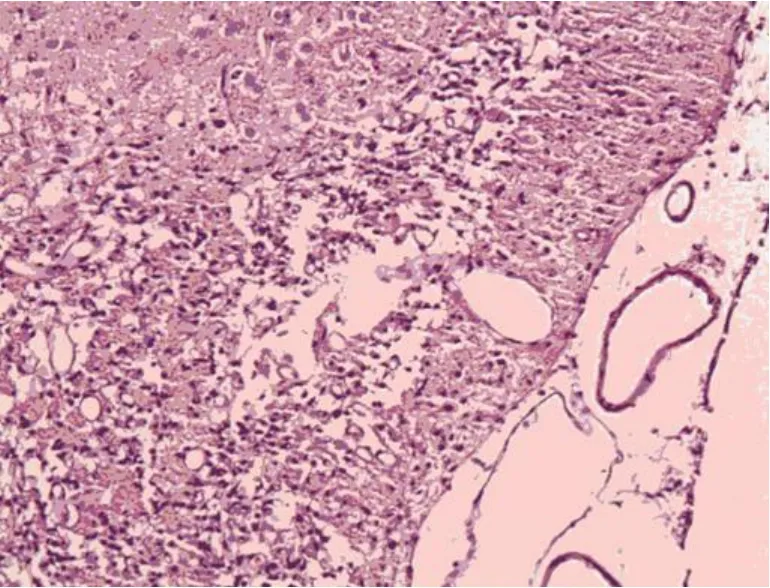
图4 对照组的 HE染色(×100)

图5 移植组的 HE染色(×100)
2.5 免疫组化结果 (1)BrdU单染结果:对照组未见到 Brdu免疫组化阳性的细胞着色,尾静脉组可见到 Brdu阳性细胞,细胞呈圆形,细胞核是红色的,尾静脉组 BrdU阳性细胞在脉络丛、脑室管膜周围、血管周围分布较多,尾静脉组的肝组织中也见到少量 Brdu染色阳性的细胞(见图6、图7)。(2)免疫双染结果:尾静脉组在移植后 1m后的免疫组化染色时均有 MSCs分化的双阳性细胞,即 Brdu+NSE、Brdu+GFAP,其中 NSE阳性细胞说明分化为神经元,GFAP阳性说明分化为神经胶质细胞,表现为细胞核红色,胞浆为蓝色(见图8、图9)。(3)BDNF检测结果:细胞浆中呈棕黄色颗粒者为阳性细胞(见图10、图11)。单染结果用阳性细胞数表示(见表2)。
表2 MSCs对大鼠脑缺血再灌注后 BDNF表达的影响±s)
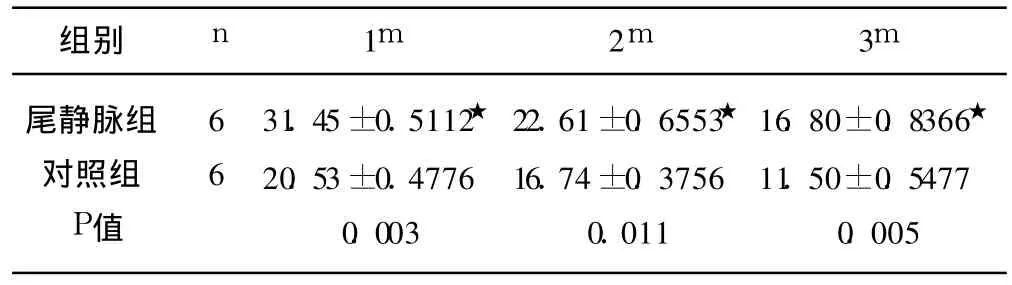
表2 MSCs对大鼠脑缺血再灌注后 BDNF表达的影响±s)
与对照组比★P<0.05
尾静脉组对照组P值6631.45±0.5112★20.53±0.47760.00322.61±0.6553★16.74±0.37560.01116.80±0.8366★11.50±0.54770.005
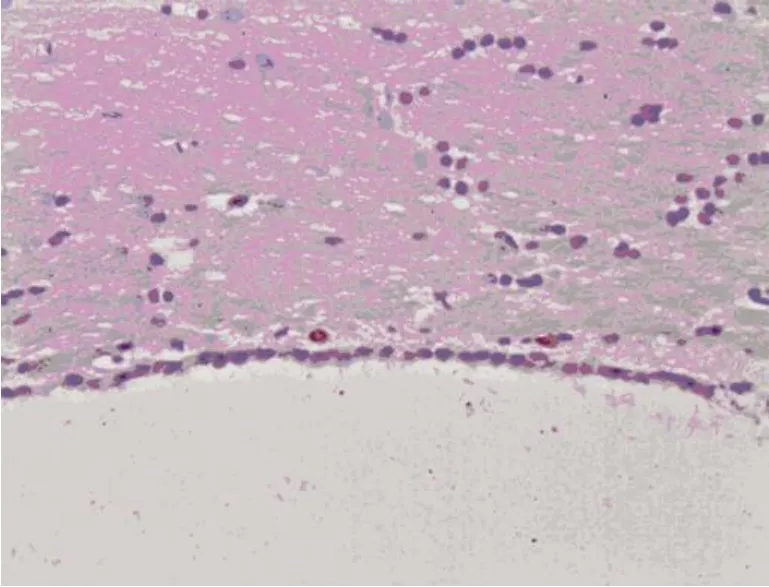
图6 尾静脉组脑内Brdu单染细胞(×100)

图7 尾静脉组肝内Brdu单染细胞(×100)

图8 Brdu+NSE免疫双染细胞(×400)

图9 Brdu+GFAP免疫双染细胞(×400)

图10 BDNF单染胞浆阳性(×400)

图11 BDNF单染白质纤维束阳性(×200)
3 讨 论
骨髓是造血器官,干细胞最初的概念也是源于骨髓,骨髓中除了有造血干细胞外,作为间充质细胞成分之一的间充质干细胞的含量估计只占全骨髓细胞的 1/105[1],因此研究它的体外培养、扩增及纯化具有重要的意义。现在各实验室主要是用 3种方法来分离 MSC,即梯度离心法[2]、贴壁培养法、免疫吸附法[3]。本实验中我们结合了密度梯度离心法和贴壁法分离骨髓中的 MSCs,这样培养的细胞贴壁快,呈集落样生长,细胞呈均匀一致的纺锤形。通过换液以弃除仍悬浮生长的血细胞、巨噬细胞等杂细胞,使其得以纯化,最初分离的细胞是混杂的细胞群,且为多态的,经过 2~3次传代后 MSCs的形态就趋于一致,分离培养的 MSCs在显微镜下观察,90%以上为梭形或呈纺锤形的细胞,形成漩涡状,部分为大的扁平形细胞,即为较高纯度的 MSCs。本实验病理学观察发现,光镜下 HE染色可见对照组梗死灶明显,缺血区神经细胞明显减少,可见大量神经细胞变性、坏死,呈胞体皱缩、核固缩、碎裂、溶解,间质水肿明显,大量炎症细胞浸润。尾静脉移植组神经细胞变性、坏死数量明显变少,炎症细胞减少,间质水肿减轻。说明 MScs治疗缺血性脑损伤是切实有效的。
当前 MSCs移植的途径主要有 3种:立体定向、动脉途径、静脉途径。其中立体定位途径对受体的脑组织有一定的损伤,动脉途径移植难度较大,静脉途径注射侵袭性小,操作方便、安全。Brazelton[4]研究小组将表达绿色荧光蛋白(GFP)成鼠的 MSCs经尾静脉注入经致死量照射的同基因成鼠体内,发现在嗅球、海马、皮层、小脑有 GFP细胞。因此我课题组设计了尾静脉途径移植 MSCs,观察 MSCs在体内的存活及分化情况,以及神经功能缺损的恢复和神经营养因子(BDNF)的分泌情况并探讨相关的机制。目前国内外研究 MSCs还可促进缺血区新血管再生[5],Liu等[6]实验表明用胎盘生长因子(Placental growth factor,PLGF)基因修饰的人 MSCs能诱导脑梗死大鼠脑内的血管发生,促进其损伤功能的恢复。移植的 MSCs还可促进内源性细胞增殖,Crigler等[7]的实验表明人 MSCs移植后,其不同的细胞亚型表达不同的神经细胞调控分子(轴突诱导因子、轴突导向及神经细胞粘附分子),对宿主神经细胞的存活和神经再生起到了一定的作用。此外还可以分化为神经细胞和胶质细胞发挥替代作用[8]。本实验观察到,移植后 1d时在由于是卒中急性期,兴奋性神经递质、自由基以及炎性因子可能会威胁进入缺血区的新细胞,移植的细胞难以发挥作用及分化,因此两组的 NSS评分间无统计学差异。2w、1m、2m、3m时尾静脉组 NSS评分明显低于对照组,在移植后 1m时免疫组化染色即可以见到免疫双阳细胞,可能是MSCs进入到缺血损伤部位,促进内源性静态的神经干细胞被激活以及更容易促进体内的细胞因子和神经生长因子的分泌,修复破坏的神经环路,分化后发挥神经替代修复作用。关于尾静脉注射时 MSCs如何通过血脑屏障,可能有几种机制:(1)脑损伤后血脑屏障的破坏,可能有助于 MSCs选择性进入缺血脑区。(2)与受损伤的脑组织释放一些趋化因子有关[9]。(3)缺血后细胞间黏附分子的表达增高并相互作用。(4)脑缺血可以诱导缺血周边区神经营养因子的表达,如脑源性神经营养因子(BDNF)、胶质细胞源性营养因子(GDNF)[10]、胰岛素样生长因子(IGF-1)[11]等,这些营养因子可能对 MSCs的存活、迁移和分化起重要作用。
本实验观察脑缺血性损伤后在不同的时间点移植组的 BDNF阳性细胞数明显高于对照组,说明了MSCs移植后能显著增加脑内 BDNF的合成,促进缺血性脑损伤的恢复。这也是尾静脉移植治疗脑缺血损伤的重要机制。BDNF属于神经营养素家族之一,相对分子量为 12.3ku的碱性蛋白。它不仅在中枢神经系统发育过程中对神经元的生存、分化、生长和维持神经元正常的生理功能起关键作用,而且还具有抗伤害刺激、促使神经元损伤后的再生。Arai等[12]在一侧大脑中动脉阻塞(MCAO)动物模型上发现,在梗死灶周围的皮质及双侧的海马 BDNF及其受体 TrkBmRNA表达明显增加。BDNF减轻脑缺血神经损害的机制有以下几点:(1)拮抗兴奋性氨基酸毒性。(2)稳定细胞内 Ca2+浓度。(3)减轻自由基损伤。(4)抑制神经细胞的凋亡。BDNF可通过调节 Bcl-2、Bax蛋白的表达而抑制细胞的凋亡[13]。
总之,大脑中动脉闭塞(MCAO)的大鼠早期通过尾静脉移植 MSCs,可在大鼠脑组织中存活并部分分化为神经细胞,显著加速大鼠的神经功能的恢复,还可以促进神经营养因子 BDNF的分泌增加,为缺血性脑梗死的治疗开辟了新的道路,在未来的临床应用中还有许多问题有待于解决,如移植的安全性问题等。
[1] Prockop DJ,Gregory CA,Spees JL.One strategy for cell and gene therapy:Harnessing the power of adult stem cells to repair tissues[J].Proc Natl Acad Sci USA,2003,100(Suppll):11917-11923.
[2] Le Blanc K,Gotherstrom C,Ringden O,et al.Fetal mesenchymal stem cell engraftment in bone after in utero transplantation in a patient with severe osteogenesis imperfecta[J].Transplantation,2005,79:1607-1614.
[3] Dominici M,Le Blanc K,Mueller I,etal.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[4] Brazelton TR,Rossi FMV,Keshet GI,et al.From marrow to brain:expression of neuronal phenotypes in adult mice[J].Science,2000,290:1775-1779
[5] Zacharek A,Chen J,Cui X,et al.Angiopoietin1/Tie2 and VEGF/Flk 1 induced by MSC treament amplifies angiogenesis and vascular stabilization after stroke[J].J Cereb Blood Flow Metab,2007,27:1684-1691.
[6] Liu H,Honmou O,Harada K,et al.Neuroprotection by PIGF genemodified human mesenchymal stem cells after cerebral ischaemia[J].Brain,2006,129(Pt 10):2734-2745.
[7] Crigler L,Robey RC,Asawachaicharn A,et al.Human mesenchymal stem cell subpopulations express a variety of neuroregulatory molecules and promote neuronal cell survival and neuritogenesis[J].Exp Neurol,2006,198(1):54-64.
[8] Segal R,Bhattacharyya A,Rua L,et al.Differential utilization of Trk autophosphorylation sites[J].J Biol Chem,1996,271:20175-20181.
[9] Wang L,Li Y,Chen X,et al.MCP-1,MIP,IL-8 and ischemic cerebral tissue enhance human bone marrow stromal cell migration in interface culture[J].Hematology,2002,7(2):113-117.
[10] Abe K.Therapeutic potential of neurotrophic factors and neural stem cells against ischemic brain injuty[J].J Cereb Blood FIow Metab,2002,20:1393-1408.
[11] Zhang J,Li Y,Chen J,et al.Expression of insulin-like growth factor 1 and receptor in ischemic rats treated with human marrow stromal cells[J].Brain Res,2004,1030(1):919-927.
[12] Arai S,Kinouchi H,Akabane A,et al.Induction of brain-derived neurotrophic factor(BDNF)and the receptor trk B mRNA following middle cerebral artery occlusion in Rat[J].Neuorsci Lett,1996,211(1):57-60.
[13] Hee Han B,D'Costa A,Back SA,et al.BDNF blocks caspase-3 activation in neonatal hypoxia-ischemia[J].Neurobio Dis,2000,7(1):38-53.
