人剪切修复基因XPD对肝癌细胞中p8/TTDA基因的调控作用*
2010-08-14杜芳腾张吉翔
杜芳腾,付 晓,张吉翔
(南昌大学第二附属医院消化科,江西330006)
核苷酸切除修复(NER)的机制聚集和调控了大概25种蛋白对损伤结构进行识别和切除,其中包括针对紫外线诱发的损伤。这一修复机制的中心成员是一种由10个亚基的转录/修复因子ⅡH(transcription/repair factorⅡH,TFⅡH)组成的复合体——正如名字暗示的那样,除了具有修复DNA作用外,这一复合物还具有调节转录的作用。
目前发现,TFⅡH 复合物是由 10个亚基(XPB、XPD、p8/TTDA 、p62、p52、p44、p34、cdk7、cyclin H 和 MAT 1)组成的多酶复合物[1]。p8/TTDA是3种 TFⅡH修复基因(XPB、XPD和p8/TTDA)之一,被证实与一种稀少的光敏型遗传早熟老化综合征——毛发硫营养不良(TTD)相关,该综合征的特点是毛发和指甲易碎,鳞状皮肤和神经恶化[2]。
p8/TTDA是TFⅡH的第10亚基,在DNA修复中起着关键性的作用,它通过刺激XPB ATP依赖的单链DNA(ssDNA)解旋酶活性和激活损伤识别因子XPC-h HR23B,从而触发DNA解旋。且荧光抗体标记还发现p8/TTDA可促进DNA解旋所需的XPA聚集至损伤位点处。在TTD-XPD细胞中p8/TTDA过表达可阻碍XPD突变所产生的有害作用,前者其主要是通过恢复TFⅡH表达水平起作用的。在TFⅡH复合物中,p8/TTDA与XPD、XPB共同在核苷酸切除修复功能中起着必不可少的作用[3-4]。
XPD是TFⅡH的第二大亚基。在核苷酸切除修复过程中,它负责从5′→3′方向打开受损位置的DNA双链,从而允许损伤特异性核酸酶从两侧切下受损DNA,在转录过程中,XPD的作用是维持TFⅡH复合物的结构稳定,并促进转录活性的放大。它的功能受阻可导致突变的基因不能得到有效的修复,同时也会干扰一些调节细胞周期和细胞凋亡因子的功能,从而导致细胞正常生长和凋亡改变[5-6]。
因此,本研究用p EGFP-N2/XPD重组质粒稳定转染人肝癌细胞SMMC-7721,检测转染前后对p8/TTDA表达情况的影响,探讨它们之间的相互作用,并检测其下游基因p53及cmyc等的表达;观察转染前后人肝癌细胞SMMC-7721所发生的生物学变化。
1 材料与方法
1.1 材料
1.1.1 细胞株和质粒来源 人肝癌细胞SMMC-7721购自中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC)。p EGFP-N2/XPD重组质粒由南昌大学第二附属医院分子医学重点实验室构建,通过用聚合酶链反应、酶切及基因测序三重鉴定所构建的克隆[7]。
1.1.2 主要试剂和产地 RPMI-1640购自美国Gibco BRL公司,FBS购自澳大利亚 Hyclone公司,Lipofectamine 2000TM、TrizolTM试剂购自美国Invetrogen公司。M-M LV Reverse Transcriptase、Rnasin、d NTP、Oligo(d T)15 购自美国Promega公司。PCR引物、G-418 Sulfate(进口分装)购自上海生工生物工程有限公司,EndoFree Pladmid Kit、2 X Tag PCR MasterMix、Markr I购自北京天根生化科技有限公司。单克隆抗体XPD、p53、c-myc购自美国Santa Cruz公司,单克隆抗体p8购自美国Sigma公司,山羊抗鼠IgG-辣根过氧化物酶、山羊抗兔IgG-辣根过氧化物酶购自北京中杉金桥生物技术有限公司。MTT购自上海普飞生物技术有限公司。
1.2 实验方法
1.2.1 稳定转染 传代 24 h后,用重组质粒p EGFP-N 2/XPD、空载质粒p EGFP-N 2分别通过 Lipofectamine 2000转染SM MC-7721细胞。以2×105细胞/孔的密度将SMMC-7721细胞平铺于6孔板内,24 h细胞铺90%,p EGFP-N2/XPD、pEGFP-N2每孔4.0μg,脂质体每孔10μL介导转染。转染48 h后用选择培养基(含G-418800μg/m L),经有限稀释法筛选4周,获得稳定转染重组质粒p EGFP-N2/XPD的SMMC-7721细胞(SMMC-7721-p EGFP-N2/XPD)及稳定转染空载质粒pEGFP-N 2的SMMC-7721细胞(SM MC-7721-p EGFP-N 2)。
1.2.2 实验分组 实验设4组,分别为稳定转染重组质粒细胞组(SMMC-7721-p EGFP-N2/XPD)、稳定转染空载质粒细胞组(SMMC-7721-p EGFP-N2)、脂质体转染对照组、无转染空白对照组。
1.2.3 RT-PCR检测各组细胞基因表达量 使用Trizol试剂提取各组细胞总RNA,合成 cDNA。应用 Primer Primier 5软件设计引物 ,p8 正义:5′-CAA TGC CCT GGG GAA GAA G-3′,反义:5′-TAA TTC ACC CAC TCG C TC C-3′,扩增片段长度 103 bp;XPD正义:5′-TCT GCC TCT GCC CTA TGA T-3′,反义:5′-CGA TTC CCT CGG ACA CT T T-3′,扩增片段长度 363 bp;p53 正义:5′-TTG AGG TGC GTG TTT GTG-3′,反义 :5′-T TT ATG GCG GGA GGT AGA-3′,扩 增片 段长 度335 bp,c-myc 正义:5′-AAC CCT TGC GCA TCC AC-3′,反义:5′-CCT CCT CGT CGC AGT AGA AA-3′,扩增片段长度317 bp;β-actin 正义 :5′-CTT CC T GGG CAT GGA GTC-3′,反义:5′-GCC GAT CCA CAC GGA GTA-3′,扩增 片段长度 232 bp。PCR扩增产物经1.5%琼脂糖凝胶电泳(含5μg/L溴化乙锭)后,在紫外灯下观察结果。并通过FR200图像分析软件(上海复日公司)观察目的电泳条带的斑点密度扫描值,以各组β-actin条带的扫描值标化其相应组的 p8、XPD、p53、c-myc条带的密度扫描值,获得其相对表达量,并进行统计学分析。
1.2.4 Western blot法检测各组细胞蛋白表达量 使用总蛋白提取试剂盒分别提取4组细胞的总蛋白,使用全自动生化分析仪(Beckman,USA)测定蛋白浓度。取同量蛋白经聚丙烯酰胺凝胶电泳,继而转移蛋白于硝酸纤维素膜上,用5%脱脂奶粉封闭后,分别先后加入一抗和二抗孵育,BeyoECL Plus荧光检测试剂显色。经曝光、显影、定影后照相,通过FR200图像分析软件读取目的电泳蛋白的斑点密度扫描值,以各组β-actin条带的扫描值标化其相应组的 p8、XPD、p53、c-myc条带的密度扫描值,测得其相对表达量,并进行统计学分析。
1.2.5 四甲基偶氮唑盐(M TT)法观察细胞增殖活力 使用0.25%胰淀粉酶消化收集细胞,每组细胞以104细胞/孔浓度平铺于96孔培养板中,每组6孔,常规培养48 h后吸出培养基,每孔加入5 mg/L MT T 20μL,继续培养4 h,弃上清液,每孔加入DMSO 150μL,振荡10 min。使用酶标仪(Labststems,芬兰)测定492 nm各孔吸光度(A)值,取每孔平均值,计算细胞抑制率,以间接反映各组活细胞数量。
1.3 统计学处理 应用SPSS12.0统计软件进行统计分析,数据以表示,组间比较采用方差分析。
2 结 果
2.1 各组细胞 p8、XPD、p53、c-myc m RNAs的表达情况RT-PCR检测结果显示:稳定转染重组质粒细胞组、稳定转染空载质粒细胞组、脂质体转染对照组和无转染空白对照组中p8/TTDA m RNA相对表达量分别为:0.624±0.055、0.179±0.084、0.159±0.093、0.156±0.060。4组细胞中XPD m RNA相对表达量为:0.972±0.078、0.295±0.040、0.219±0.072、0.280±0.081。4组细胞中p53 m RNA相对表达量为:0.829±0.023、0.567±0.018、0.566±0.052、0.516±0.064;4 组细胞中c-myc m RNA相对表达量为:0.212±0.027、0.862±0.013、0.887±0.067、0.816±0.069。p8 m RNA 在人肝癌细胞SMMC-7721是低表达的,稳定转染野生型XPD后,p8 m RNA和XPD m RNA表达量明显增高(P<0.001)。稳定转染重组质粒细胞组p53 m RNA表达量亦明显增高(P<0.05),cmyc m RNA表达量则明显下降(P<0.001)。而p8、XPD、p53、c-myc m RNAs表达量在稳定转染空载质粒细胞组、脂质体转染对照组及无转染空白对照组之间差异均无统计学意义(P>0.1),见图 1。
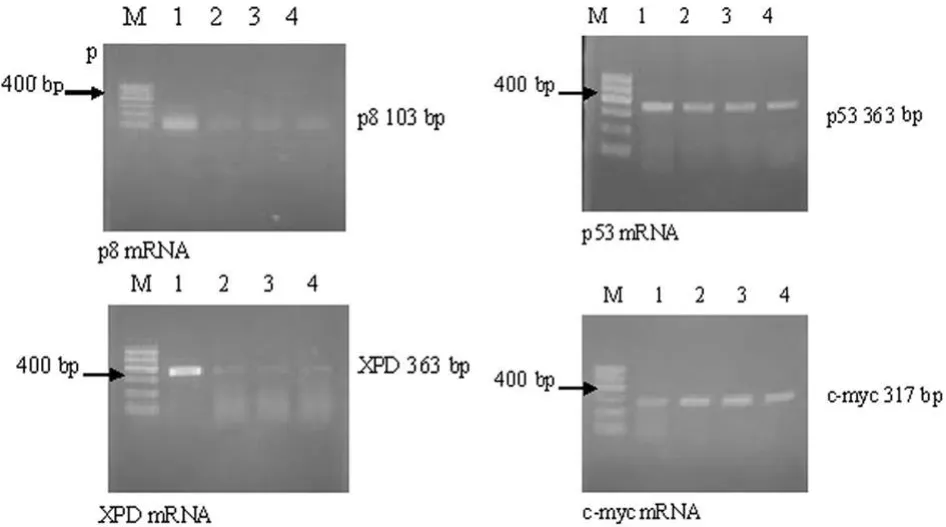
图1 4组细胞中p8、XPD、p53、c-myc m RNAs的表达情况
2.2 各组细胞p8、XPD、p53、c-myc蛋白的表达情况 Western blot法检测结果显示:p8蛋白在4组细胞中的相对表达量分别为:0.516±0.093、0.257±0.086、0.287±0.044、0.252±0.084;XPD蛋白相对表达量分别为:0.606±0.076、0.264±0.083、0.223±0.086、0.276±0.053;p53蛋白相对表达量分别为:0.894±0.046、0.455±0.038、0.443±0.051、0.405±0.072;c-myc蛋白相对表达量分别为:0.233±0.040、0.529±0.067、0.500±0.052、0.521±0.062。p8蛋白在人肝癌细胞SM MC-7721是低表达的。稳定转染野生型XPD后,p8蛋白、XPD蛋白、p53蛋白表达量明显增高(P<0.05),c-myc蛋白表达量则明显下降,差异有统计学意义(P<0.001)。而在稳定转染空载质粒细胞组、脂质体转染对照组及无转染空白对照组之间差异均无统计学意义(P>0.1)。各分子蛋白表达水平的变化趋势与其m RNA变化趋势相一致,见图2。
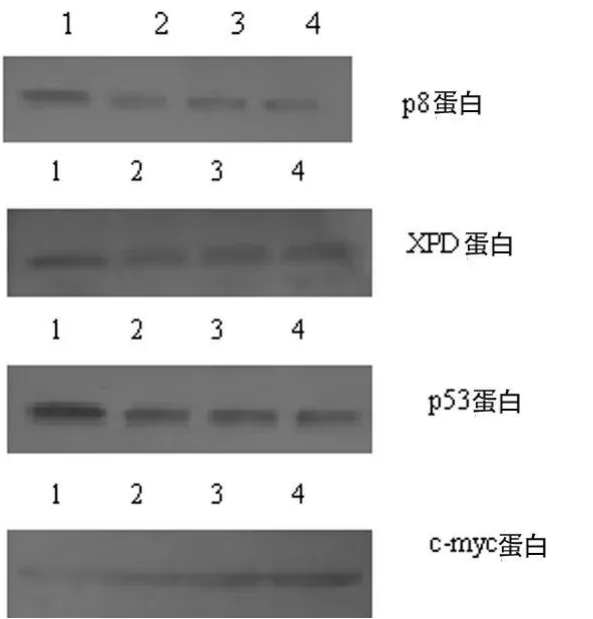
图2 4组细胞中p8、XPD、p53、c-myc蛋白的表达情况
2.3 各组细胞增殖活力的变化情况 M TT检测显示:以无转染空白对照组生长率为1,脂质体转染对照组为 1.014±0.025,稳定转染空载质粒组为 0、981±0、042,稳定转染重组质粒细胞组为0、616±0、055,稳定转染重组质粒细胞细胞组的吸光度与其他两组比较明显下降,差异有统计学意义(P<0.001);稳定转染空载质粒细胞组、脂质体转染对照组与无转染空白对照组之间相互比较差异无统计学意义(P>0.05)。
3 讨 论
DNA修复是保持人类基因组完整性的核心,DNA修复能力的减低常易发生癌变,而机体常暴露于各种有害内外物质中,致使DNA的结构受损,导致生命体重要的遗传信息的丢失。为维持基因组稳定性和完整性,可促使充足的DNA修复基因表达,通过多种途径(如核酸切除修复、同源重组修复、非同源重组修复、碱基切除修复和错配修复等)促使各种损伤得到有效修复。其中核酸切除修复是最多样和最普遍的DNA修复机制,而TFⅡH则在核苷酸切除修复功能中发挥着重要作用。XPB、p8/TTDA、p62、p52、p44和 p34组成一个核心亚复合物,cdk7、cyclin H和MAT 1组成一个具有CDK活化的激酶(CAK)亚复合物,而XPD则作为一个支架,介导着CAK亚复合物与核心亚复合物的结合。XPD以N-末端与M AT1的卷曲结构域连接,同时以C-末端与p44亚基的N-末端相连,从而把cdk7以及整个CAK亚复合物锚定在核心复合物上,这就形成了 TFⅡH多酶复合物。XPD、XPB、p8/T TDA则是TFⅡH中的3种起修复作用的基因[3]。
有研究证实,XPD除了在TFⅡH介导的核酸切除修复和转录过程中发挥主要作用外,还参与了细胞的增殖、凋亡,肿瘤的发生甚至化疗药物抗药性的产生等多种生理及病理机制[6]。因此,有理由认为,XPD基因表达下降则有利于肿瘤的发生、发展。本研究亦发现,在人肝癌细胞SM MC-7721中p8和XPD m RNAs和蛋白均为低表达。现今,有研究者发现在TTD-XPD细胞中p8/TTDA过表达可阻碍XPD突变所产生的有害作用[2]。故本研究使用重组质粒p EGFP-N2/XPD转染SMMC-7721细胞,从而研究人剪切修复基因XPD对p8/TTDA基因的影响。结果证实,转染野生型XPD后,p8 m RNA和蛋白表达量均明显增高。
Giglia-Mari等[7]通过绿色荧光蛋白(GFP)标记 TTDA和XPD亚基,并利用高分辨率的共聚焦显微镜进行观察。结果发现T TDA-GFP与XPD-GFP稳定地组成TFⅡH并且参与DNA修复,而且与仅定位于细胞核内的XPB亚基相比,在细胞质和细胞核中都可以观察到 TTDA-GFP和 XPD-GFP。还通过光脱色荧光恢复技术(FRAP)得出结论,在核心的TFⅡH复合体吸附到DNA损伤处后,一旦T TDA进入到正确的位置,将会引起构象上的改变来召集其他一些用于修复的亚基。TTDA也可帮助TFⅡH正确折叠,防止它的降解和积累 TFⅡH到达一种进行核苷酸切除修复功能所需的水平。本研究发现转染野生型XPD基因增加了SMMC-7721细胞生长的抑制率,并导致稳定转染重组质粒细胞进入S期出现障碍,停滞在G1期的细胞增多,抑制了癌细胞的增殖,促进了癌细胞的凋亡。p8基因和蛋白表达水平增高,可促进恢复TFⅡH表达水平,从而有助于抑制癌细胞生长。
抑癌基因p53可通过抑制细胞周期、促进细胞凋亡、稳定染色体基因组及抑制血管生成等途径来防止细胞恶变,抑制肿瘤生长。有研究认为,p53参与调节核酸切除修复途径,p53 C-末端释放的多肽可与XPB相互作用从而增加p53促凋亡活性;同时p53 C-末端也可抑制TFⅡH复合物的解旋酶活性。当DNA受到损伤时,XPB和XPD可识别损伤部位并与p53结合,促使损伤部位得到修复或诱导细胞凋亡[8]。本实验亦发现,在SMM C-7721-p EGFP-N 2/XPD组中p53 m RNA和蛋白表达量明显增高。野生型XPD转染后可上调p53,而p53又可与XPB相互作用,促进癌细胞凋亡。所以,作者认为XPD可能在TFⅡH复合物中发挥着核心调节作用,但尚需进一步研究证实。
癌基因c-myc可以促进细胞的生长与增殖,阻断细胞分化,促使肿瘤形成。有研究认为,XPD可以通过Fuse结合蛋白(FBP)影响c-myc的表达;FBP有潜在的转录活化和抑制功能,是c-myc表达所必需的;且当XPD发生缺陷或突变时cmyc表达量常增加;将FBP或(和)XPD转入进XPD缺陷的细胞后c-myc表达量可下降[9]。本实验亦证实转染野生型XPD后,c-myc m RNA和蛋白表达量均明显降低。c-myc表达的下降,可引起癌细胞的生长力降低和细胞凋亡增加[10]。
本实验表明,人剪切修复基因XPD可调控p8/TTDA基因的表达。野生型 XPD稳定转染SMM C-7721细胞后,p8 m RNA和蛋白表达量明显增高。p8基因和蛋白表达量水平增高,可促进恢复TFⅡH表达水平,抑制癌细胞的无限增殖。野生型XPD转染后亦可上调p53基因及蛋白表达,而p53又可与XPB相互作用,促进癌细胞凋亡。转染后,c-myc表达下降,可引起癌细胞的增殖降低和细胞凋亡增加。本实验对XPD基因抑制肝癌细胞生长的分子途径进行了初步探讨,为肝癌的基因治疗提供了分子水平的实验依据,并大胆猜测XPD基因在TFⅡH复合物中可能发挥着核心调节作用,其具体调节作用机制还有待于进一步研究探索。
[1]Giglia-M ari G,Coin F,Ranish JA ,et al.A new,tenth subunit of TFⅡH is responsible for the DNA repair syndrome trichothiodystrophy group A[J].Nat Genet,2004,36(7):714.
[2]Vitorino S,Coin F ,Zlobinskaya O,et al.Solution structure and self-association properties of the p8 TFⅡH subunit responsible for trichothiodystrophy[J].J Mol Biol,2007,368(2):473.
[3]Coin F ,Proietti De Santis L ,Nardo T ,etal.p8/TTD-A as a repair-specific TF Ⅱ H subunit[J].Mol Cell,2006,21(2):215.
[4]Chiqancas D,Lima-Bessa KM ,Starv A ,et al.Defective transcription/repair factorⅡH recruitment to specific UV lesions in trichothiody-strophy syndrome[J].Cancer Res,2008,68(15):6074.
[5]Lehmann AR.The xeroderma pigmentosum group D(XPD)gene:one gene,two functions,three diseases[J].Genes Dev,2001 ,15(1):15.
[6]Aloyz R,Xu ZY,Bello V,et al.Regulation of cisplatin resistance and homologous recombinationalrepairby the TFⅡ H subunit XPD[J].Cancer Res,2002,62(19):5457.
[7]Giglia-Mari G ,Mique C ,Theil AF ,et al.Dynamic interaction of TTDA with TFⅡH is stabilized by nucleotide excision repair in living cells[J].PloS Biol,2006,4(6):e156.
[8]Wang XW ,Vermeulen W,Coursen JD,et al.The XPB and XPD helicases are components of the p53-mediated apoptosis pathw ay[J].Genes&Dev ,1996 ,10:1219.
[9]Liu J,He L,Collins I,etal.The FBP interacting repressor targets TFⅡH to inhabit activated transcription[J].Mol Cell,2000 ,5(2):331.
[10]Schmidt EV.The role of c-myc in cellular grow th control[J].Oncogene,1999 ,18(19):2988.
