CK19 m RNA在45例乳腺癌患者外周血中的表达*
2010-08-14莫军扬庄亚强梁志东向川江
莫军扬,黄 平,庄亚强,梁志东,向川江
(广西医科大学第五附属医院乳腺外科,广西 柳州 545006)
CK 19 m RNA是上皮组织来源的组织特异性标志物,其表达与乳腺癌微转移和疗效密切相关[1]。外周血是肿瘤发生远处转移的必经途径。但是目前仍然不清楚乳腺癌发生、发展和浸润转移的具体分子机制,如果在早期能找到其浸润转移的指标,对于指导治疗、提高术后生存率有重要的意义。正常人外周血中无上皮细胞及上皮源性细胞,如果从癌症患者外周血中检出上皮源性细胞,则说明癌细胞已转移入外周血。本研究采用逆转录多聚酶链反应(reverse transcription polymerase chainreactio,RT-PC R)法检测乳腺癌外周血中CK 19 m RNA的表达,结合临床病理因素(肿瘤大小、淋巴结转移状况、临床分期等),分析它们之间的相关性及其临床意义,以期建立可靠的乳腺癌微转移的检测方法。
1 资料与方法
1.1 一般资料 45例乳腺癌组织均取自2006年6月至2008年11月广西柳州市人民医院乳腺外科住院患者,均为首次手术或空芯针穿刺诊断且未经治疗的原发乳腺癌标本,病理诊断明确,均为女性。HE切片,病理分型、TNM 分期参考《中国肿瘤病理学分类》,其中 TNM 分期分为Ⅰ期 10例,Ⅱ期18例,Ⅲ期17例;无淋巴结转移 15例,有淋巴结转移30例;病理类型:浸润性导管癌36例,黏液癌3例,导管内癌6例。乳腺良性病变患者30例,其中乳腺纤维腺瘤20例,乳腺囊性增生病8例,导管内乳头状瘤2例。年龄19~81岁,平均45岁。术前胸部X线、B超、CT及MRI全身弥散等检查未发现远处转移灶。
1.2 主要试剂和仪器 RT-PCR检测CK19 m RNA试剂盒(广州达晖生物技术有限公司)和5700型荧光定量PCR仪(美国ABI公司)。CK19 m RNA 的上游引物:5′-CAG GTC AGT GGA GGT GGA T-3′,下 游 引物:5′-TTC GCA TGT CAC TCA GGA TC T T-3′;cDNA模板对照:β2微球蛋白的cDNA;阳性对照:乳腺癌细胞系MCF-7的cDNA;阴性对照:人纤维肉瘤细胞系HT 1080;假基因扩增对照:乳腺癌细胞系MCF-7的基因组DNA。
1.3 RT-PCR法检测CK19 m RNA水平 (1)抽提总RNA。抽取每例乳腺癌患者治疗前外周静脉血5 m L,均为肝素抗凝。留取血清检测CK19 m RNA。用试剂盒提供的RNA提取液提取RNA。测A 260~280处吸光值,并计算RNA含量。操作过程严格无菌技术以避免污染。(2)逆转录反应。制作CK 19 m RNA基因标志物的标准品浓度。原标准品浓度为109拷贝/m L,稀释浓度后分别为4×108、4×107、4×106、4×105拷贝/m L。配制混合液,每个反应需RT反应液18μL,鼠白血病病毒(M-M LV)逆转录酶 1μL,RNA 酶 1 u,共20μL,分别加入5μL的预变性 RNA、4种浓度标准品、阳性及阴性对照,混匀离心,37℃水浴 60 min。(3)RT-PCR测定。配制PCR反应混合液,每个反应所需 PCR反应液43μL,Taq E 2μL,共计45μL。取45μL反应液分别装入PCR小管中,取 45μL RT反应物加入上述管中,混匀离心,放入PC R检测仪。每次检测均同法加入不同浓度的标准品、阳性及阴性对照。反应程序如下:预变性 93 ℃、2 min;93 ℃、45 s,55 ℃、60 s,共 40个循环;延伸72℃、10 min。记录结果。反应结束后分析实验数据,仪器自动得出未知标本数值M。将最终计算结果按下列公式换算:A(拷贝数/μg总 RNA)=B(拷贝数/μg cDNA)÷ 样本RNA的OD260值×5/6。
1.4 结果判断 用 RT-PCR检测CK19 m RNA的表达时,在实验中用人纤维肉瘤细胞系HT 1080的cDNA作为阴性对照,用乳腺癌细胞系MCF-7 cDNA作为阳性对照,用乳腺癌细胞系MCF-7的基因组DNA作为假基因扩增对照。结果显示阴性对照和假基因扩增对照均无扩增条带,而阳性对照有扩增条带。
1.5 统计学方法 应用SPSS13.0统计软件对数据进行χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 CK19 m RNA在乳腺癌患者外周血中表达 在乳腺癌患者外周血中,CK 19 m RNA阳性率为62.2%;乳腺癌患者与乳腺良性病变患者阳性率比较差异有统计学意义(P<0.01),见表1。

表1 外周血中CK19 m RNA表达的检测结果
2.2 CK19 m RNA与乳腺癌病理特征及临床分期关系 随着临床分期的增加,CK19 m RNA阳性率呈逐渐增加趋势。Ⅰ、Ⅱ、Ⅲ期乳腺癌患者CK 19 m RNA阳性率分别为 30.0%、61.1%、82.4%,各期间比较差异有统计学意义(P<0.01)。有淋巴结转移者阳性率达83.3%,有淋巴结转移患者的阳性率显著高于无转移者,二者比较差异有统计学意义(P<0.01)。CEA m RNA阳性率与临床分期、淋巴结转移相关(P<0.01),与肿物大小、ER、PR表达无关(P>0.05),见表2。
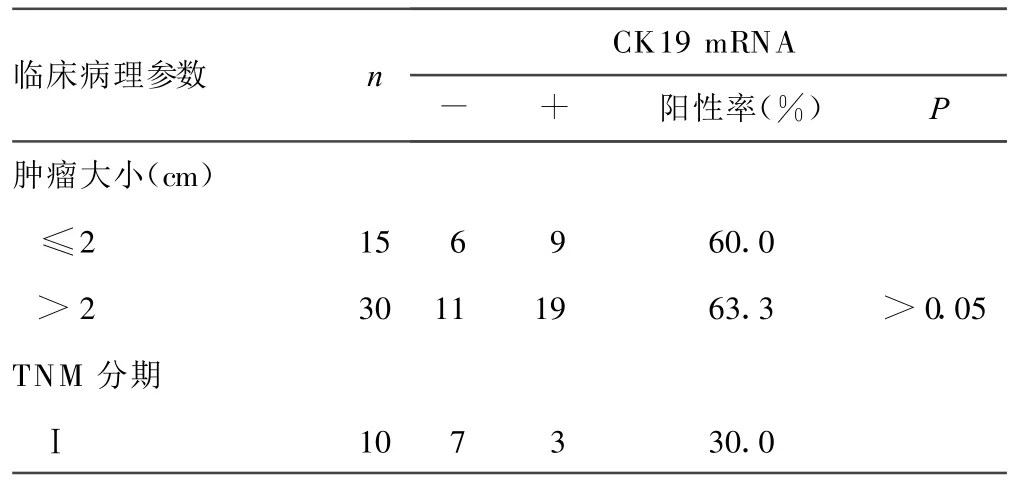
表2 CK 19 m RNA在乳腺癌组织中的表达情况及关系
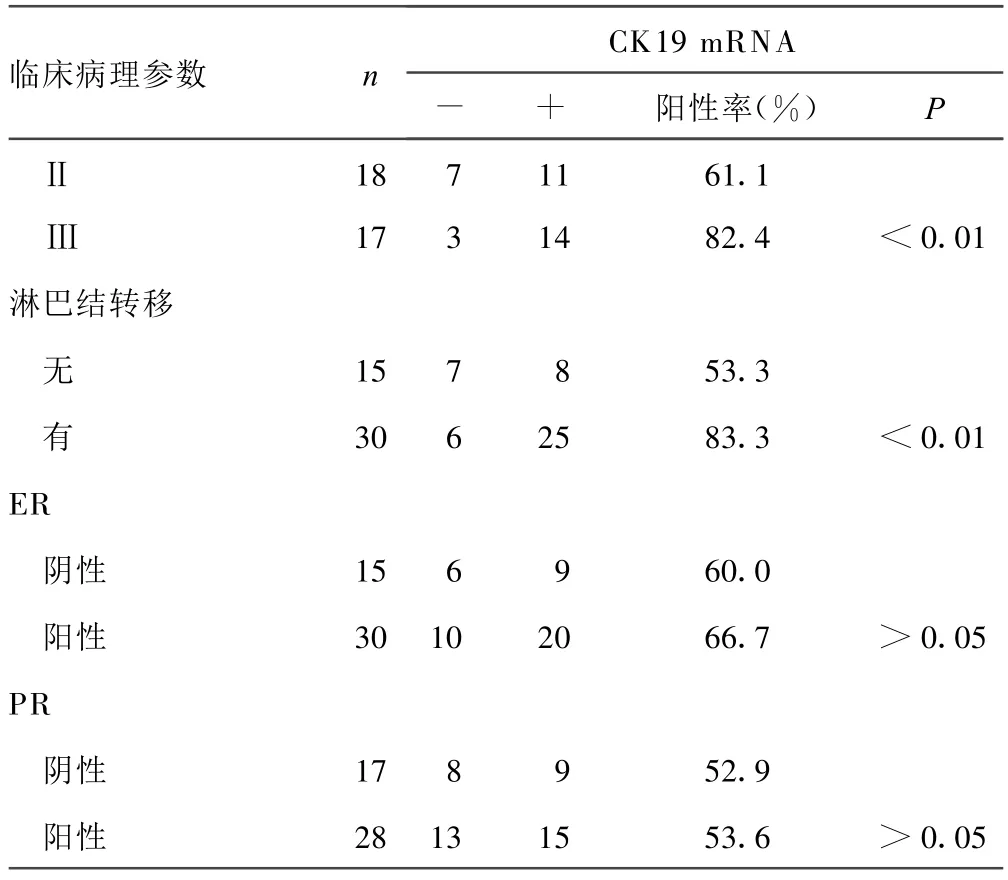
表2 (续) CK19 m RNA在乳腺癌组织中的表达情况及关系
3 讨 论
自1869年Ashworth在外周血中发现癌细胞以来,肿瘤微转移的概念便在临床中建立起来,并逐渐成为研究热点之一。血行转移是乳腺癌转移的主要途径之一,如果能在亚临床阶段检测到微小转移灶,则对肿瘤的分期、治疗和预后有重要意义。Pretlow等[2]将从有远处转移的前列腺癌患者外周血中获得的癌细胞注入裸鼠体内,结果在部分肺内形成了转移灶,因此,循环血液中检测出癌细胞,在一定程度上表明肿瘤具有较强的转移倾向,有助于临床的分期和治疗方案的选择。随着分子生物技术的发展,尤其RT-PC R技术的成熟和完善,被认为是目前检测外周血微转移的有效方法。
CK19 m RNA是上皮组织来源的组织特异性标志物,是一相对分子质量为40×103的酸性蛋白质,为上皮细胞骨架的一部分,在恶性上皮细胞中,激活的蛋白酶加速了细胞角蛋白降解,使得大量片段入血,CK19 m RNA在乳腺癌发生早期即上升,且与疗效、肿瘤转移密切相关,因此,其表达与乳腺癌微转移和疗效密切相关[3]。作为上皮来源肿瘤,表达于上皮来源性细胞生物学特征的CK19 m RNA在间叶组织来源的血液中无表达,基于这一特性,利用 RT-PC R技术检测血液中CK 19 m RNA可以判断是否存在微转移。因此,在淋巴结、骨髓和外周血中查获上皮膜抗原和角蛋白的表达阳性,可以认为是乳腺癌诊断及微转移的指标[4]。茹景顺等[5]研究发现如果淋巴结常规检查为阴性,可作淋巴结的CK19免疫组化检测,可提高淋巴结转移灶的检出率。陆云飞等[6]研究提示用乳腺癌特异性上皮细胞产物,如CK、EM A等进行免疫组化染色能发现常规病理检查不能检测到的微转移,而RT-PCR检测敏感性更高。Parikh等[7]研究发现其表达缺失和乳腺癌的局部复发明显相关,也与远处的转移及总生存率有关。王梅和葛明建[8]研究也发现术后CK19 m RNA的表达水平增加与肿瘤术后复发有一定关系,并且认为局部控制好坏与分子水平缓解密切相关。
本研究结果显示CK 19 m RNA阳性率为62.2%,本实验发现30例乳腺良性病变患者中有1例CK 19 m RNA表达阳性,可能原因为:(1)RT-PCR灵敏度高,存在假阳性可能;(2)有癌前病变可能。淋巴结转移者和无淋巴结转移者CK 19 m RNA阳性率分别为83.3%、53.3%,二者比较差异有统计学意义。表明RT-PCR技术能检出常规病理检查不能发现的微转移灶,可显著提高对乳腺癌外周血转移诊断的敏感度及准确率。
乳腺癌患者外周血CK 19 m RNA的水平在各TNM分组的差异有统计学意义(P<0.01),并随着临床分期的递增,CK 19 m RNA的水平及阳性检出率逐渐升高,提示患者发生肿瘤细胞血行播散的危险随着临床分期的递增有增加的趋势。本研究结果显示,Ⅱ、Ⅲ期患者CK19 m RNA的表达水平高于Ⅰ期患者,各分期间比较差异有统计学意义,与Wong等[9]的报道一致。提示CK19 m RNA的表达与乳腺癌的生物学行为及恶性程度有关,CK 19 m RNA的检测将有助于评估乳腺癌患者的预后。
本实验结果显示CK19 m RNA在乳腺癌外周血中阳性率仅为62.2%,对此可能的解释有:(1)可能与肿瘤细胞呈间歇性释放入血有关[10];(2)由于肿瘤在基因表达上具有异质性,加上微循环的某种因素,血循环中肿瘤细胞也许不表达该基因,有别于组织标本[11];(3)标志物的特异性或检测的方法的敏感性有待提高。因此,可采用多次采血、多种肿瘤标志基因等检测方法以提高检测阳性率。
[1]Noriko I,Yasuo M ,Kazuyoshi M ,et al.Prognostic significance of occult bone marrow micrometastases of breast cancer detected by quantitative polymerase chain reaction for cytokeratin 19 m RNA[J].Jpn J Cancer Res,2000 ,91:918.
[2]Pretlow TG ,Schw artz S,Giaconia JM ,et al.Prostatecancer and other xenografts from cells in peripheral blood of patients[J].Cancer Res,2000 ,60(15):4033.
[3]Noriko I,Yasuo M ,Kazuyoshi M ,et al.Prognostic significance of occult bone marrow micrometastases of breast cancer detected by quantitative polymerase chain reaction for cytokeratin 19 m RNA[J].Jpn J Cancer Res,2000,91:918.
[4]Zhang J,Shen KW ,Liu G,et al.Antigenic profiles of disseminated breast tumor cells and microenvironment in bone marrow[J].Eur J Surg Oncol,2003,29(2):121.
[5]茹景顺,周伟,黎红,等.乳腺癌细胞CD44V6的表达与淋巴结微转移[J].广东医学,2002,23(5):465.
[6]陆云飞,陈波,曾健,等.乳腺癌前哨淋巴结定位切除、微转移检测及其临床意义[J].广西医学,2006,28(1):28.
[7]Parikh RR,Yang Q ,Higgins SA ,etal.Outcomesin young w omen with breast cancer of triple-negative phenotype:the prognositic significance of CK19 m RNA expression[J].Int J Radiat Oncol Biol Phys,2008,70(1):35.
[8]王梅,葛明建.非小细胞肺癌患者术后化疗过程中外周血CK 19 m RNA表达水平的变化及其临床意义[J].重庆医学,2009,38(19):2423.
[9]Wong IH ,Yeo W ,Chna AT ,etal.Qunatiattive correlation of cytokeratin-19 m RNA level in peripherla blood with disease stage and metsatasis in bersat cancer patients:potential prognostic implications[J].Int J Oncol,2001,18(3):633.
[10]Glaves D ,Huben RP,Weiss L.Haematogenous dissemination of cells from human renal adenocarcinomas[J].Br J Cancer,1988,57(1):32.
[11]Hoon DS,Wang Y,Dale PS,et al.Detection of occult melanoma cells in blood with a multipe-marker polymerase chain reaction assay[J].J Clin Oncol,1995 ,13(8):2109.
