COX-2特异性的siRNA诱导胃癌SGC-7901细胞凋亡*
2010-08-14向廷秀王丕龙
谯 敏,向廷秀,王丕龙
(重庆医科大学附属第一医院消化内科 400016)
环氧化酶(cyclooxygenase,COX)是花生四烯酸(arachidonic acid,AA)合成前列腺素(prostaglandins,PGs)的限速酶,包括COX-1与COX-2两种同工酶。其中COX-2是由Xie等在1991年发现的一种诱导型酶,在正常生理状态下COX-2几乎不表达,而在多种恶性肿瘤细胞及组织中呈高表达状态[1-4]。RNA干扰(RNA interfering,RNAi)是指双链 RNA引发细胞浆内同源m RNA降解的转录后基因沉默(post-troanseriptional gene silence,PTGS)现象,具有特异、高效、可传递等优点[5-9]。本实验利用转录载体p TZU 6+1构建COX-2的短发夹状RNA(smallhairpin RNA,siRNA),研究其对胃癌细胞株SGC-7901中COX-2基因的抑制作用,进一步了解RNAi介导的SGC-7901细胞凋亡及其可能的作用途径。
1 材料与方法
1.1 材料 质粒p TZU 6+1为重庆医科大学感染性疾病分子生物学重点实验室黄爱龙教授惠赠。限制性内切酶XbaⅠ、SalⅡ、HindⅢ和Eco RⅠ购自 Taka Ra公司,质粒提取试剂盒、胶回收试剂盒、连接试剂盒、总RNA提取试剂、RT-PCR试剂盒、转染试剂lipofectamine 2000和末端标记细胞凋亡检测法(T UNEL)反应试剂盒等分别购自 Taka Ra、Promega、Omiga和Invitrogen公司等。COX-2、Caspase-3和 Caspase-9的兔抗人多抗均为美国Santa C rutz公司产品;HRP标记的羊抗兔IgG(二抗)购自北京中山生物技术公司。COX-2引物和内参GAPDH引物以及siRNA转录模板由北京三博远志生物工程技术有限服务公司和大连宝生物公司合成。
1.2 细胞培养 胃癌SGC-7901细胞株由重庆医科大学病理教研室提供。在含10%小牛血清的RPMI-1640培养液中,37℃、5%CO2培养箱中培养。
1.3 siRNA结构的设计和合成 根据siRNA设计原则[10]和COX-2编码序列,设计19个碱基的 DNA片段,中间为 8个与目的基因无同源性的插入序列(GAGTACTG),末端终止子TT TTT,并利用BLAST进行查询,确定其为特异性序列,合成的重组质粒命名为p TZU 6+1-siRNA-COX-2。共设计、合成2对COX-2编码序列的反向重复序列以及2对对应的点突变反向重复序列。合成的DNA两端设计有XhoⅠ或XbaⅠ酶切位点,便于与p TZU 6+1载体连接。siRNA的转录模板序列的正义链分别为:5′-AAC TGC TCA ACA CCG GAA T-3′和 5′-GCC TTC TCT AAC CTC TCC T-3′。 对应的点突变序列的正义链分别为:5′-AAC TGC TCT ACA CCG GAA T-3′合 5′-GCC TTC TCA AAC CTC TCC T-3′。
1.4 重组载体siRNA的构建 内切酶SalⅠ和XbaⅠ酶切转录载体p TZU6+1,凝胶电泳检查证实载体酶切完全。将其与纯化的双链DNA片段在T 4DNA连接酶作用下,4℃连接过夜,转化大肠杆菌 JM109,Amp抗性筛选。筛选克隆提取DNA,用EcoRⅠ和 HindⅢ分别酶切,并用相同的酶酶切载体p TZU 6+1作为对照,琼脂糖凝胶电泳鉴定。将筛选的重组质粒测序确定,以证实目的DNA片段克隆入p TZU 6+1载体,将构建的重组质粒命名为p TZU 6+1-siRNA-COX-2,对应目的序列及相应的点突变序列构建的重组质粒分别简称为pC1-siRNA 、p C2-siRNA 、p C1′-siRNA 和 pC2′-siRNA 。
1.5 质粒转染 按照Invitrogen公司lipofectamine 2000的说明书进行转染。将正常培养的SGC-7901细胞用胰酶消化、离心、弃上清液,沉淀用RPMI-1640培养液重悬,调整浓度为4×105cells/m L,以2 m L细胞接种于 6孔培养板中,置37℃培养。待细胞生长到占培养瓶底约70%~80%时,换为无抗菌素含血清的RPM I-1640培养液,培养过夜。次日,分别用pC1-siRNA 、p C2-siRNA 、p C1′-siRNA 和 pC2′-siRNA 转 染 SGC-7901细胞,同时设 p TZU6+1空载体转染的阴性对照,在无血清、无抗菌药物的培养液中培养4~6 h后换新鲜10%小牛血清的RPMI-1640培养液,继续培养72 h后检测各指标。
1.6 免疫细胞化学检测COX-2蛋白表达的变化 收获细胞,用95%乙醇固定后,按COX-2抗体说明书(SABC法)进行操作。DAB显色,二甲苯透明,封片并照相。采用软件Image Proc Plus3.0(IPP3.0)进行分析。
1.7 T UNEL检测细胞凋亡 采用TUNEL反应试剂盒。取对数生长期的SGC-7901细胞4×105接种于6孔板,含10%小牛血清的RPMI-1640培养基培养过夜,分组转染细胞。转染后72 h,弃上清液,用 95%乙醇固定,3%H2O2封闭,0.1%Triton-100,每孔加50μL反应混合液,37℃孵育 60 min,每孔加50 m L POD,最后用DAB显色。
1.8 Western Blot检测Caspase-9和Caspase-3蛋白表达配制10%SDS-PAGE分离胶和5%SDS-PAGE浓缩胶。分别收集阴性对照组和转染 pC1-siRNA、p C2-siRNA、pC1′-siRNA和pC2′-siRNA质粒72 h的SGC-7901细胞,沉淀用PBS洗2遍,细菌裂解液处理,上样10μL,90 V恒压电泳约60 min,120 V恒压电泳约2 h。电泳完毕后取出凝胶,4℃、25 V恒压电转过夜。次晨取出 NC膜,加1∶500稀释的 Caspase-9和Caspase-3一抗溶液,4℃过夜,加1∶1000的辣根过氧化物酶标记稀释二抗溶液,37℃、轻轻振荡2 h后弃反应液,用DAB染色试剂盒染色,BIO-RAD图像分析仪上观察并扫描制片,记录结果。采用软件Image Proc Plus3.0(IPP 3.0)进行分析。
2 结 果
2.1 重组质粒载体的构建与鉴定 p C1-siRNA、pC2-siRNA、pC1′-siRNA 和 p C2′-siRNA 质 粒 经 Hind Ⅲ 和 Eco RⅠ 双酶切,同时做p TZU6+1空载体双酶切对照。琼脂糖电泳,p TZU6+1空载经双酶切后呈2条带,分别为2.8 kb的载体片段和350 bp左右的小片段;而重组质粒经双酶切后则为2.8 kb的载体片段和400 bp左右的条带(图1)。测序结果也证明重组质粒构建成功,插入DNA序列均正确。
2.2 免疫细胞化学检测结果 对照组质粒、p C1′-siRNA和pC2′-siRNA质粒处理的 SGC-7901细胞可见细胞浆黄染,内有较多棕黄色颗粒为阳性。而经pC1-siRNA和pC2-siRNA处理的胃癌SGC-7901细胞,细胞浆的黄色明显减弱、变浅,说明COX-2蛋白表达低于对照组(图2)。
2.3 Western Blot检测结果 以β-actin蛋白条带的强弱作为标准,与对照组比较,pC1-siRNA和p C2-siRNA质粒转染组细胞Caspase-9和 Caspase-3表达明显增强,而 pC1′-siRNA和pC2′-siRNA质粒转染组细胞中 Caspase-9和Caspase-3蛋白表达与对照组比较,差异无统计学意义(图3)。
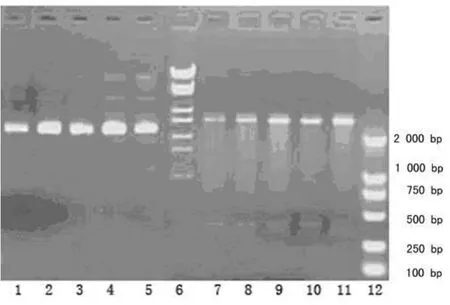
图1 重组质粒p TZU6+1-siRNA-COX-2的酶切鉴定
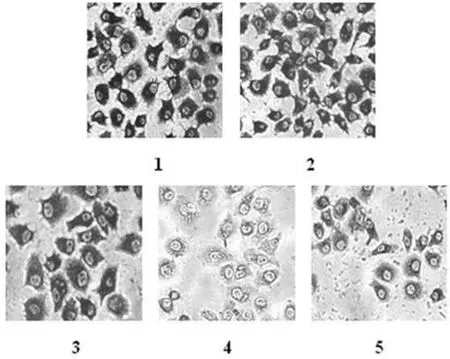
图2 免疫细胞化学检测COX-2蛋白表达
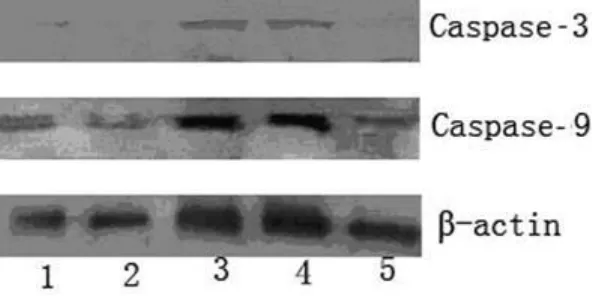
图3 Western Blot检测SGC-7901细胞中Caspases蛋白的表达
2.4 TUNEL检测结果 TUNEL染色反应后,在倒置显微镜下可见 ,对照组 、转染 pC1′-siRNA 和p C2′-siRNA 组 细胞大部分贴壁良好,形态完整正常,少量胞核内有着色现象,胞质着色浅。在转染p C1-siRNA和p C2-siRNA的SGC-7901细胞中出现大量凋亡细胞(P<0.05),表现为细胞核中央呈类圆形、均一的棕色,在胞浆中有片状着色,核浓缩,凋亡小体形成(图 4)。

图4 T UNEL检测SGC-7901细胞凋亡
3 讨 论
研究发现,COX-2不仅是启动炎性反应的关键酶,还可以通过促进肿瘤细胞增殖、抑制凋亡、促进肿瘤新生血管形成等机制促进肿瘤的发生、发展。胃癌是常见的消化道恶性肿瘤,其具有高发病率、高恶性度、预后不良的特点,临床手术切除后常需进行辅助性化疗,其目的在于抑制肿瘤细胞生长、诱导肿瘤细胞凋亡。研究表明,在胃癌组织和细胞中,COX-2常呈高表达状态,与肿瘤的发生、发展及预后密切相关。RNAi是一种PTGS的基因阻断技术,近年来被广泛应用于哺乳动物细胞抑制基因表达[11-12]。本课题通过构建重组质粒,将siRNA导入胃癌SGC-7901细胞内诱发 RNAi,进而观察 COX-2表达变化、SGC-7901细胞凋亡及与凋亡相关的信号分子改变。
作者构建了2对COX-2编码序列的反向重复序列以及2对对应的点突变反向重复序列,即p C1-siRNA、pC2-siRNA、pC1′-siRNA 和 pC2′-siRNA ,并用 其转 染胃 癌 SGC-7901 细 胞株。结果发现p C1-siRNA和pC2-siRNA均能显著下调SGC-7901细胞中 COX-2表达,而pC1′-siRNA 和p C2′-siRNA 处理的SGC-7901中COX-2表达无明显改变。说明RNAi对同源m RNA的作用是很特异的,即使发生碱基的点突变也可能影响RNAi的效力。这与 Phipps等[13]和 Elbashir等[14]的报道相一致。本实验中,作者还发现转染pC1-siRNA和pC2-siRNA的SGC-7901出现明显的细胞凋亡,且与对照组相比,Caspase-9和Caspase-3表达明显上调,说明COX-2基因特异性的siRNA可能通过激活Caspases通路而诱发SGC-7901细胞凋亡。
[1]黄昌杰,湛永滋,黄剑锋,等.CerB-2基因、COX-2基因在鼻咽癌中的表达及相关性研究[J].广西医学,2009,31(3):305.
[2]Okano H ,Shinohara H ,Miyamoto A ,et al.Concomitant overexpression cyclooxygenase-2 in HER-positive onsmad-reduced human gastric carcinoma is associated with a poor patient outcome[J].Clin Cancer Res,2004,10(4):6938.
[3]Chen XL,Su BS,Sun RQ ,et al.Relationship between expression and distribution of cyclooxygenase-2 and bcl-2 in human gastric adenocarcinoma[J].World J Gastroenterol,2005,11(8):1228.
[4]倪观太,张正荣.环氧化酶-2与卵巢癌关系的研究进展[J].安徽医学 ,2004 ,25(4):344.
[5]曾柯,吴小候,杜虎.Survivin靶向siRNA对膀胱癌细胞增殖和凋亡作用的体外研究[J].重庆医学,2007,36(14):1360.
[6]Song E ,Lee SK ,Wang J,etal.RNA interference targeting Fas protects mice from fulminant hepatitis[J].Nat Med,2003,9(3):347.
[7]Brummelkamp TR,Bernards R,Agami R.Stable suppression of tumorigenicity by virus-mediated RNA interference[J].Cancer Cell,2002 ,2(3):245.
[8]Olson A ,Sheth N ,Lee JS,etal.RNAi Codex:a portal/database for short-hairpin RNA(sh RNA)gene-silencing constructs[J].Nucleic Acids Res,2006,34:153.
[9]钟文昭,苏健,陈志红,等.RNA干扰技术抑制人肺腺癌A 549细胞株 EGFR基因表达[J].广东医学,2008,29(6):924.
[10]Sui G,Soohoo C,Affar EB,et al.A DNA vector-based RNAitechnology to suppress gene expression in mammalian cells[J].Proc Natl Acad Sci USA ,2002,99(8):5515.
[11]Tuschl T.Expanding small RNA interference[J].Nature Biotechnology ,2002,20(5):446.
[12]Agami R.RNAi and related mechanisms and their potential use for therapy[J].Curr Opin Chem Biol,2002,6(6):829.
[13]Phipps KM ,Martinez A,Lu J.et al.Small interfering RNA molecules as potential anti-human rhinovirus agents:in vitro potency,specificity,and mechanism[J].Antiviral Res,2004,61(1):49.
[14]Elbashir SM ,Lendeckel W,Tuschl T.RNA interference is mediated by 21-and 22-nucleotide RNAs[J].Genes Dev ,2001 ,15(2):188.
