黄精和多花黄精中多糖及薯蓣皂苷元的含量测定
2010-08-10毕研文杨永恒宫俊华陈宝芳刘政波
毕研文,杨永恒,宫俊华,陈宝芳,刘政波
(泰安市农业科学研究院,山东泰安271000)
黄精(Polygonatum sibiricumRed.)和多花黄精(Polygonatum cyrtonemaHua.)为百合科黄精属多年生草本植物,分别习称“鸡头黄精”“姜形黄精”,在山东泰山地区统称为泰山黄精,是“泰山四大名药”之一,根茎入药,具有补肾益精、滋阴润燥等功效[1]。近年来,有关黄精化学成分研究报道日趋增多,至今已确定主要含有多糖、低聚糖、皂苷、氨基酸等活性成分[2-3]。黄精多糖具有抗菌[4]和增强免疫力作用[5]。现代药理研究表明,薯蓣皂苷口服后经肠道菌群代谢产生的薯蓣皂苷元,具有降血脂、抗病毒等作用[6-7],薯蓣皂苷元被认为是黄精的主要有效成分[6]。但2005版《中国药典》中仅以葡萄糖的含量作为控制黄精药材质量的指标,专属性和实用性不强,不能够较为准确的控制黄精的质量。为此,本实验采用苯酚-硫酸比色法测定了黄精和多花黄精中多糖的含量,并应用RPHPLC测定了两种黄精薯蓣皂苷元的含量。结果表明该方法简便、快捷、可靠,可为黄精和多花黄精的质量控制提供依据,也为以后药典的增订提供参考。
1 实验材料
UV-2450紫外可见分光光度计,日本岛津公司。SZ-93自动双重蒸馏水器(上海亚荣生化仪器厂);FW177型中草药粉碎机(天津泰斯特仪器有限公司)。高效液相色谱仪(Waters 600E美国,包括600E四元梯度泵,2996二极管阵列紫外检测器,中文Empower色谱管理系统,四通道脱气机);SZ-93自动双重蒸馏水器(上海亚荣生化仪器厂);KQ5200D数控超声波清洗器(昆山市超声仪器有限公司)。葡萄糖(分析纯,天津市四通化工厂),浓硫酸、乙醇及蒽酮均为分析纯,水为二次蒸馏水。黄精,多花黄精均采自泰安市农业科学研究院中草药圃。对照品薯蓣皂苷元购自中国药品生物制品检定所。乙腈(分析纯,天津永大试剂厂),水为二次蒸馏水,其他试剂均为分析纯。
2 实验方法与结果
2.1 多糖的测定[8-9]
2.1.1 对照品溶液的配制 精密称取经105℃干燥至恒重的无水葡萄糖对照品33 mg,置100 mL量瓶中,加水溶解并稀释至刻度,摇匀,即得。
2.1.2 标准曲线的制备 精密量取对照品溶液0.1,0.2,0.3,0.4,0.5,0.6 mL,分别置10 mL具塞试管中,各加水至2.0mL,混匀,在冰水浴中缓缓加0.2%蒽酮-硫酸溶液至刻度,混匀,放冷后置水浴中保温10 min,取出,立即置冰水浴中冷却10 min,取出,以相应试剂为空白。照紫外-分光光度法,在582 nm波长处测定吸光度。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。回归方程为Y=0.028 4X+0.072 7,r=0.998 6,浓度在3.30~19.80 μ g/mL范围内线性关系良好。
2.1.3 样品溶液的制备及测定 分别称取60℃干燥至恒重的黄精和多花黄精0.25 g,置圆底烧瓶中,加入80%乙醇150 mL,置水浴中回流1 h,趁热过滤,残渣用80%乙醇洗涤3次,每次10 mL,将残渣及滤纸置烧瓶中,加水150 mL,置沸水浴中加热回流1 h,趁热过滤,残渣及烧瓶用热水洗涤4次,每次10 mL,合并滤液与洗液,放冷,转移至250 mL量瓶中,加水至刻度,摇匀,精密量取1 mL,置10 mL具塞试管中,照标准曲线得制备项下的方法,自加水至2.0 mL起,依法测定吸光度,计算。黄精和多花黄精多糖含量分别为107.52 mg/g和80.41 mg/g。
2.2 薯蓣皂苷元含量的测定[10]
2.2.1 色谱条件 色谱柱:Symmetry-C18(4.6 mm×250 mm,5 μ m);流动相 CH3CN-H2O(94∶6,V/V);流速1.0 mL/min;测定温度为25℃;PDA检测器,检测波长为 203 nm;进样 20 μ L 。
2.2.2 标准溶液的配制 精密称取薯蓣皂苷元6.87 mg,置10 mL容量瓶中,加甲醇定容,摇匀。
2.2.3 标准曲线的制备 精密量取标准溶液0.2,0.3,0.4,0.5,0.6,0.7,0.8 mL分别置于10mL容量瓶中,加甲醇定容,摇匀,分别吸取不同浓度标准溶液20 μ L,按2.2.1色谱条件进样测定。以峰面积为纵坐标,标准溶液浓度为横坐标,绘制标准曲线。回归方程为Y=158.92X+301.21,r=0.998 3,薯蓣皂苷元在13.74~54.96 μ g/mL范围内线性关系良好。
2.2.4 样品溶液的制备及测定
2.2.4.1 未水解样品的测定 取黄精、多花黄精粉末各10 g,置圆底烧瓶中加250 mL乙醇,摇匀,称重,加热回流4 h,放冷,称重,用乙醇补足重量,摇匀,过滤。精密量取滤液100 mL,蒸干,残渣用甲醇转移到5 mL容量瓶中,定容,摇匀,用高效液相色谱法测定,结果见表1。
2.2.4.2 水解样品的测定 另同法取100 mL滤液,蒸干乙醇,残渣加400 mL、3 mol/L的盐酸溶解,沸水回流4 h,冷却,移至分液漏斗中,加氯仿200mL(100,50,50 mL)萃取3次,合并氯仿液,沸水浴蒸干氯仿,残渣加甲醇溶解,定容至25 mL容量瓶中,摇匀,用高效液相色谱法测定,结果见表1。
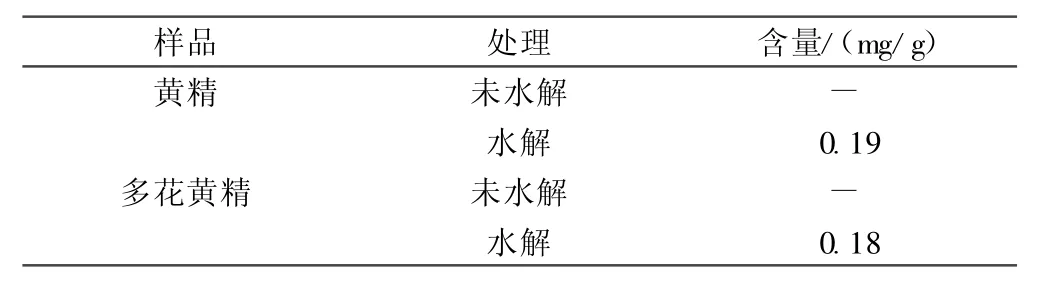
表1 样品测定结果
2.2.3 精密度试验 精密吸取薯蓣皂苷元对照品溶液(20.61 μ g/mL),按上述色谱条件,重复进样6次,每次20 μ L,测定薯蓣皂苷元峰面积的相对标准偏差RSD为0.46%,表明仪器精密度良好。
2.2.4 重复性试验 称取同一批的黄精样品5份,按水解样品溶液制备方法操作,进样20 μ L,测定薯蓣皂苷元的峰面积的RSD为3.41%。表明分析方法重复性良好。
2.2.5 稳定性试验 取同一份黄精水解样品溶液,分别在放置 0,2,4,6,8 h 后进样,进样 20 μ L,进行稳定性考察。结果表明,在8 h内4种薯蓣皂苷元的色谱峰面积没有明显变化,RSD分别为0.78%。表明供试品溶液稳定性良好。
2.2.6 加样回收率试验 精密称取已测知含量的黄精药材粉末6份,分别精密加入等量的对照品薯蓣皂苷元,按2.2.1和2.2.6项下方法测定,薯蓣皂苷元的平均回收率为103.48%,RSD为3.11%。
3 结论
未水解的黄精和多花黄精中均未检测到薯蓣皂苷元,可能由于薯蓣皂苷元含量太低有关。水解后黄精和多花黄精中薯蓣皂苷元的含量分别为0.19 mg/g和0.18 mg/g。黄精和多花黄精药材分布广、资源丰富,且在抗癌、降血脂方面具有显著的疗效,因此有必要对黄精和多花黄精进行系统和深入的研究。
[1]国家药典委员会.中华人民共和国药典[S].一部.北京:化学工业出版社,2005:215.
[2]Fen Liu,Yinghua Liu,Yiwen Meng,et al.Structure of polysaccharide from Polygonatum cyrtonema Hua and the antiherpetic activity of its hydrolyzed fragments[J].Antiviral Research,2004,63(3):183-189.
[3]庞玉新,赵致,袁瑷,等.黄精的化学成分及药理作用[J].山东农业生物学报,2003,22(6):547-550.
[4]苏伟,赵利,刘建涛,等.黄精多糖抑菌及抗氧化性能研究[J].食品科学,2007,28(8):55-57.
[5]王爱梅,周建辉,欧阳静萍.黄精对D-半乳糖所致衰老小鼠的抗衰老作用研究[J].长春中医药大学学报,2008,24(4):137-138.
[6]马海英,赵志涛,王丽娟,等.薯蓣皂苷元和黄山药总皂苷抗高血脂症作用比较[J].中国中药杂志,2002,27(7):528-531.
[7]高中礼,张景龙,宋世刚.黄精的药理研究与临床应用[J].长春中医药大学学报,1999,15(6):51.
[8]周斌,陈菊移.蒽酮-硫酸比色法测定九华山地区黄精中多糖含量[J].中国药业,2009,18(16):24-25.
[9]童红,申刚.黄精药材中黄精多糖的含量测定[J].中国药业,2007,16(9):20-21.
[10]陈立娜,都述虎,高艳坤,等.RP-HPLC法测定黄精中薯蓣皂苷元含量[J].现代中药研究与实践,2006,20(4):32-34.
