金边瑞香插穗形态、POD与可溶性蛋白含量变化研究
2010-08-09王小玲余发新孟伟伟李彦强
高 柱,王小玲,余发新,孟伟伟,李彦强
(江西省科学院生物资源研究所,南昌 330029)
金边瑞香(Daphne odoravar.marginataMak)为瑞香科瑞香属木本植物[1],是一种市场前景广阔的年销花,以扦插繁殖为主。目前,国内外有关生根物质促进或抑制金边瑞香扦插生根的报道很多[2-6],但有关金边瑞香扦插生根过程中生理生化指标变化规律的研究国内尚未见报道。可溶性蛋白为细胞生长提供物质基础,与植物的形态发生有关,部分蛋白可作为诱导物,能够激活与生根有关基因的活性,产生新的功能蛋白促进生根[7];过氧化物酶(Peroxidase,POD)参与植物体内多种生理生化过程,与植物不定根的发生和生长有密切关系,是重要的植物生根关联酶[8],Garspar等研究认为,POD可作为生根的标志之一[9]。本试验研究了不同浓度的萘乙酸(Naphthylacetic Acid,NAA)处理金边瑞香插穗后,插穗形态变化、插穗基部POD和可溶性蛋白含量的变化规律,并分析了POD和可溶性蛋白与金边瑞香插穗生根的关系,为金边瑞香生产和生根机理研究提供理论依据。
1 材料与方法
1.1 材料
选取3年生金边瑞香当年萌生的健壮半木质化枝条,截取6~8 cm长,插穗保留2~4片上部叶片,用800倍液多菌灵浸泡10 min,晾干后,在NAA溶液浓度分别为 300、500、600、800 mg·L-1中浸泡5 min,清水浸泡为对照(CK)。
1.2 方法
1.2.1 调查及取样方法
试验于江西省科学院优质植物种苗繁育基地进行。每个处理150根插穗,3次重复,随机区组排列。自扦插之日起,每隔8 d取样1次,直到生根为止。每次随机抽取5株,用于形态观察和生理指标测定。取样时先把插穗清洗擦干,剥取基部3 cm韧皮部,用液氮低温速冻,做好标签放于超低温冰箱备用。
1.2.2 样品提取
称取样品0.1 g,加少量CaCO3和1 mL蒸馏水,冰浴研磨成匀浆,转入10 mL离心管,用蒸馏水分次冲洗研钵,定容至10 mL,6 500 r·min-1离心5 min,上清液即为样品液。
1.2.3 POD活性及可溶性蛋白含量测定
POD活性测定采用比色法;可溶性蛋白含量测定采用考马斯亮蓝G-250法[10]。
1.2.4 统计指标
愈伤发生率(%)=有愈伤组织株数/调查株数×100%
变褐率(%)=插条变褐株数/调查株数×100%
腐烂率(%)=腐烂株数/调查株数×100%
皮层开裂率(%)=皮层有开裂株数/调查株数×100%
生根率(%)=生根株数/插条根数×100%
1.2.5 数据分析
采用Excel 2003制图,SPSS 16.0作相关统计分析和方差分析。
2 结果与分析
2.1 外部形态变化
结果见表1。

表1 插穗外部形态变化Table 1 External morphological changes of cuttings
金边瑞香插穗扦插8 d后,开始发生形态变化。扦插后第16天,NAA浓度为600 mg·L-1的处理有30%插穗产生愈伤,愈伤发生率高于其他各处理,且有3%皮层开裂;第32天,600 mg·L-1的处理插穗愈伤发生率最高达92%,且没有变褐或腐烂发生,该浓度处理不同时期愈伤发生率最高增长率达57%。从表1可知,金边瑞香插穗生根过程伴随皮层开裂,生根率与皮层开裂成正相关。扦插后第32~40天,愈伤组织产生率变化不大,插穗腐烂和变褐的频率增大。CK变褐和腐烂程度最大,分别可达80%和48.3%;其次是800 mg·L-1处理,变褐和腐烂的程度为23%和10%;处理600 mg·L-1,则无插穗变褐或者腐烂现象发生。因此,适宜浓度的NAA能够抑制金边瑞香插穗变褐和腐烂[11],有利于愈伤和不定根的发生[12]。
2.2 生根率的影响
金边瑞香扦插第40天统计生根率,结果见图1。方差分析见表2。

图1 NAA处理对插穗生根率的影响Fig.1 Effect of NAA concentration on the rooting rate of cuttings
由图1可知,NAA能够有效促进金边瑞香插穗生根。促根效果好的浓度依次为600>500>800>300 mg·L-1,生根率分别为86.8%、79.2%、58.6%、56.3%,该浓度顺序与愈伤发生率及皮层开裂变化趋势较一致;CK生根率为0。NAA浓度小于600 mg·L-1时,随浓度升高,金边瑞香插穗生根率呈增加趋势,高于600 mg·L-1时,生根率呈现下降趋势,这与NAA的双重作用,低浓度促进生长,高浓度抑制生长的结论相一致。
由表2可知,不同浓度NAA处理金边瑞香插穗的生根率差异极显著,说明生长素NAA是一种有效的金边瑞香生根促进剂。进一步多重比较发现(见表 3),CK、300和 800、500和 600 mg·L-1之间差异显著,而300和800 mg·L-1或500和600 mg·L-1之间差异不显著,生根率最好的处理是600 mg·L-1NAA。

表2 不同处理生根率方差分析Table 2 Analysis of variance on the rooting rate of different treatments

表3 不同处理生根率多重比较Table 3 Multiple comparison of rooting rate of different treatments
2.3 不同浓度处理插穗后POD含量变化
POD是一类含铁卟啉辅基的酶,普遍存在于植物体内,其同工酶在植物内存在发育阶段特异性和组织特异性,是一种重要的生长调节酶和生根关联酶[13-14]。由图2可知,NAA不同浓度处理金边瑞香插穗生根过程中,POD活性呈“升高-下降-升高”的趋势,并在第24天达到最高峰值,此时正是插穗愈伤发生率和皮层开裂增加最高期,POD活性不断升高,促进了根原基的诱导,高活性的POD能氧化IAA,有效降低内源IAA浓度,符合低浓度IAA诱导根原基形成的观点[15]。插穗处理后POD活性最高峰值比开始时增加了 344.5 μg·g-1FW·min-1。不同浓度NAA处理POD活性的峰值均较CK提早了8 d左右,但处理的POD活性较同一时间内CK的值要低,峰值也均没有CK的高,最高峰值差为174.6 μg·g-1FW·min-1,最后下降的幅度也比较大。根对生长素敏感性最适浓度是10-10mol·L-1左右[16],CK不生根可能与过高活性的POD氧化过多内源IAA,造成IAA含量过低有关。

图2 NAA处理对POD活性变化的影响Fig.2 Effect of NAA treatment on changes of POD activity
2.4 不同浓度处理插穗后可溶性蛋白含量变化结果见图3。
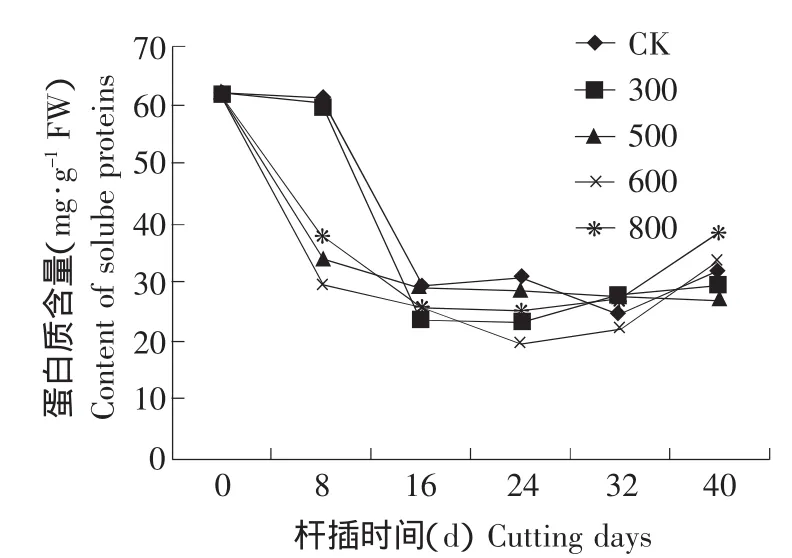
图3 NAA处理对可溶性蛋白含量变化的影响Fig.3 Effect of NAA treatment on changes of soluble proteins content
可溶性蛋白虽只占蛋白质的一部分,但是生物体能吸收利用的主要是可溶性蛋白,它在生命体活动中发挥着运输协调、免疫保护、产生和传导神经活动、控制生长分化等功能。图3表明,NAA不同浓度处理金边瑞香插穗生根过程中,可溶性蛋白含量总体呈“下降-升高”趋势,各处理下降的速度较对照要快;最低峰值出现在第24天,600 mg·L-1处理峰值最低,为20.0 mg·g-1FW,较起始时降低了67.7%,表明在根原基诱导过程中,插穗原有的可溶性蛋白转变为功能性蛋白,含量降低;其次为300 mg·L-1时,下降了39.2 mg·g-1FW;最后表现为含量升高趋势,可见可溶性蛋白重新合成并在插穗中积累,在不定根的伸长中起着重要作用。
3 讨论与结论
3.1 金边瑞香插条生根及形态变化
本世纪初Went对向光性的研究有了很大进展,化学分离出达尔文称为“某种传导刺激”的物质,证明这种物质为IAA,同时将类似物质统称为生长素[16]。大量试验证实生长素对根原基的发生起着重要作用[17]。生长素的作用机理,基因表达学说认为生长素可以使细胞伸长所需的一些基因摆脱遏制而得到表达;酸生长学说认为生长素与质膜上的受体结合,引起H+向细胞外运输,引起细胞壁的酸化和松动,在细胞的膨压下伸长。国外研究人员发现生长素加强了内质网向质膜的流动,胚芽鞘切段的伸长速度与H+-ATPase水平的变化一致,支持了酸生长学说[16]。
本研究发现,在供试范围内,NAA促进金边瑞香扦插生根效果的浓度依次是600>500>800>300 mg·L-1,CK处理没有生根。方差分析结果显示,各处理间生根率差异显著,且表现出双重作用,符合生长素作用的相关理论。处理后的插条变褐或腐烂的几率低于CK,说明NAA能够抑制金边瑞香插穗变褐和腐烂,支持了生长素作用是间接表达的理论。本研究还发现,金边瑞香插条生根率的高低和插条基部皮层开裂的比率呈正相关,说明NAA能够促进基部细胞分裂速度,从而引起皮层开裂。
3.2 金边瑞香插条POD活性的变化
POD不仅在植物的生长、发育过程中起重要作用,而且对植物的器官形态建成也起着非常重要的作用[7]。有研究表明,毛白杨插穗经过NAA处理扦插1 d后,过氧化物酶的同工酶活性加强,诱导了RNA合成,而后产生的蛋白质形成皮层分生细胞,最后形成根原基。黄卓烈等研究桉树插条POD活性呈规律性变化,并将POD活性的高低定位判断桉树生根难易的指标之一[18]。
金边瑞香生根过程中,POD活性呈“升高-下降-升高”的趋势,这与前人研究结果一致[7,19]。Galston等认为前期POD活性升高与抑制伤呼吸有关系[20];Demetrios等推测认为随后的升高与根原基形成有关[21]。本研究中扦插开始时POD活性上升,第24天达到峰值或最高,与愈伤组织出现高峰相一致。NAA处理插穗POD峰值较CK提前了8 d左右,这个结果与前人结果较相似[7,22-23],本试验测定处理POD活性值较CK低,这可能与树种和生长素种类有关。在逆境中产生的可经SOD歧化为O2与 H2O2,再由 POD将 H2O2分解为 H2O和 O2,从而保护细胞膜系统免受活性氧的伤害。因此前期POD活性增加,对抑制金边瑞香插穗变褐和腐烂具有重要作用;后期POD活性下降,表现出变褐和腐烂的增加,推测与活性氧的伤害有一定关系。
3.3 金边瑞香可溶性蛋白的变化
大量研究发现,生根过程中,可溶性蛋白作为诱导物,能够激活其他与生根有关的基因活性,因此,可溶性蛋白含量变化与生根有密切关系[14]。扦插开始时可溶性蛋白含量降低与切口呼吸代谢旺盛有关[7]。NAA处理,激活了插穗细胞内生化代谢,促进了蛋白质的转化,增加了细胞分裂和分化过程所需的功能蛋白,促进不定根原基的形成,从而促进不定根的发生。本试验中,金边瑞香插穗基部可溶性蛋白总体呈“下降-升高”趋势,前期降低主要与可溶性蛋白转化成功能蛋白诱导根原基的形成有关,最后表现出升高趋势,与根原基形成后,吸收能力增强,部分可溶性蛋白又重新合成有关。金边瑞香插穗可溶性蛋白含量下降的速度要比对照快,主要是因为处理生根,对照没有生根,因而功能蛋白形成所消耗的可溶性蛋白也表现出一定的差异。
[1]刘慧.金边瑞香生物学特性及其栽培要点[J].江西园艺,2003(4)∶33-35.
[2]刘文和.ABT生根粉与NAA,IAA,IBA在扦插育苗中的效果比较[J].江苏林业科技,2001,28(1)∶22-24.
[3]柯合作,宋志瑜.金边瑞香的扦插繁殖与花期管理技术[J].福建农业科技,2002(1)∶37-38.
[4]徐成云,陶晓晴.金边瑞香的扦插繁殖与夏季养护[J].安徽林业科技,1998(4)∶29.
[5]田英翠,杨柳青.金边瑞香的扦插技术[J].林业实用技术,2007(1)∶42-43.
[6]魏国汶,宋小民,黄冬华,等.金边瑞香的扦插生根研究[J].江西农业学报,1998,10(3)∶56-59.
[7]潘健.三种柃木属植物扦插生根机理研究[D].江苏∶南京林业大学,2007.
[8]曹帮华,扈红军,张大鹏,等.桑树硬枝扦插生根能力及其生根关联酶活性的研究[J].蚕业科学,2008,34(1)∶96-100.
[9]Gaspar T,Kevers C,Hausman J F,et al.Practical uses of peroxidase activity as a predictive marker of rooting performance of micropropagated shoots[J].Agronomie,1992(12)∶757-765.
[10]高俊凤.植物生理学试验技术[M].西安∶世界图书出版公司,2000∶192-193.
[11]毕兆东,孙淑萍.基质与植物生长调节剂对食用仙人掌扦插繁殖的影响[J].东北农业大学学报,2003,34(3)∶368-362.
[12]孙婷婷,胡宝忠,陈玉霞,等.黄刺玫(RosaxanthinaLindl.)嫩枝扦插生根过程的解剖学研究[J].东北农业大学学报,2008,39(7)∶53-56.
[13]Moneousin C H,GasPar T.Peroxidase as a marker for rooting improvement in Cynara seolymus L.cultivated in vitro[J].Bioehem Physiol Pflanzen,1983,178∶263-271.
[14]Nordstrom A C,Jacobs F A,Eliasson L.Effect of exogenous indole-3-acetic acid and indole-3-butyric acid on internal levels of the respective auxins and their conjugation with aspartic acid during adventitious root formation in pea cuttings[J].Plant Physiol,1991,96∶856-861.
[15]宋金耀,何文林,李松波,等.毛白杨嵌合体扦插生根相关理化特性分析[J].林业科学,2001,37(5)∶64-67.
[16]余叔文,汤章城.植物生理与分子生物学[M].2版.北京∶科学出版社,1998∶421-437.
[17]韩碧文,邵莉嵋,陈虎保.植物生长物质[M].北京∶科学出版社,1987.
[18]黄卓烈,李明,詹福建,等.不同生长素处理对桉树无性系插条氧化酶活性影响的比较研究[J].林业科学,2002,38(4)∶46-52.
[19]李明,谭绍满.难易生根的桉树对过氧化物酶活性及其同工酶多型性比较研究[J].华南农业大学学报,2000,21(3)∶56-59.
[20]Galston A W,Davies J P.Hormonal regulation in higher plants[J].Seience,1969,163∶1288-1297.
[21]Demetrios J M,Thomas D S,Traianos Y,et al.Peroxidases during adventitious rooting in cuttings of Arbutus unedo and Taxus baccata as affected by plant genotype and growth regulator treatment[J].Plant Growth Regutlation,2004,44∶257-266.
[22]宋金耀,何文林,李松波,等.毛白杨嵌合体扦插生根相关理化特性分析[J].林业科学,2001,37(5)∶64-67.
[23]Chao I L,Cho C L,Chen L M,et al.Effect of indole-3-butyrie acid on the endogenous indole-3-acetic acid and lignin contents in soybean hypocotyol during adventitious root formation[J].Journal of Plant Physiology,2001,158(10)∶1257-1262.
