TACE联合PMCT治疗小肝癌的疗效评价
2010-08-09102300北京京煤集团总医院王宁军
102300 北京京煤集团总医院 王宁军
350001 福建医科大学附属协和医院 杨维竹
原发性肝癌是临床上常见的恶性肿瘤之一,手术切除仍是目前肝癌治疗的首选方法。但各种非手术疗法的作用日趋重要,其中肝动脉化疗栓塞术(TACE)是肝癌非手术治疗中的首选方法;经皮穿刺微波凝固治疗(percutaneous microwave coagulation therapy,PMCT)因热效率高、凝固范围可靠、创伤小、并发症少等优点已在临床上得到了广泛应用,其对小肝癌的治疗可达到根治的效果。本文总结了采用TACE联合PMCT治疗小肝癌的资料,报告如下。
1 材料与方法
1.1 病例资料 25例患者为我院2007-05—2009-11期间住院病人,其中男性21例,女性4例;年龄22~78岁,平均(62.21±10.48)岁。病灶数目共28个,肝内单个病灶者22例,2个病灶者3例;AFP升高者20例;HBsAg阳性者23例。病例入选标准:原发性肝癌患者,单个肿瘤直径≤3 cm,总数不超过2个;无肝外病灶;无门静脉癌栓。所有患者按原发性肝癌诊断标准[1](21例)或经肝穿刺病理活检证实(4例)。按Child-Pugh分级,所有病例肝功能均为A级。治疗过程中均未接受其他方式的抗癌治疗。
1.2 仪器设备 TACE治疗所用仪器为GE公司生产的ADVANTX LCV+/DLX数字减影血管造影机,Medrad Mark V Provis高压注射器。微波仪器:南京庆海微波电子研究所研发的FORSEA MTC-3型组织间肿瘤微波凝固治疗仪,微波发射频率2 450 MHz,功率5~100 W,时间1~99 min连续可调,配置的电极针杆为14 G,采用冷水循环系统冷却。
1.3 治疗方法 所有病例首先选择TACE治疗。采用Seldinger技术经股动脉穿刺插管,先行腹腔动脉和肠系膜上动脉造影,了解肝肿瘤位置、数目、大小及血供情况。然后选用微导管超选择插管至肝叶或肝段动脉分支,先经导管缓慢注入5-FU(按体表面积750 mg/m2给药)后,再注入超液态碘化油(3~6 mL)和表阿霉素(20~30 mg)制成的混悬液,最后予以明胶海绵条栓塞,直至肿瘤供血动脉血流阻断。
TACE术后2~4周择期行PMCT治疗。PMCT前30 min予以肌注盐酸派替啶100 mg和地西泮10 mg。在CT引导下选定穿刺点及穿刺路径,予2%利多卡因麻醉穿刺点后,将12 G套管针穿过病灶至对侧缘。进针时尽量避开邻近重要器官,如肝门区血管、门静脉主干及左右支、胆囊等。退出套管针针芯,经套管送入连接好的微波电极针,将微波功率设定在60~70 W。每个病灶每次微波凝固时间为10~15 min,使微波凝固范围超出病灶周边5 mm左右。若1次单针凝固范围不够,可1周内再行补充PMCT治疗1次。治疗结束后将微波电极拔出,以明胶海绵封堵穿刺道,局部用无菌纱布包扎。卧床休息,观察血压、脉搏24 h。
所有病例行TACE和PMCT治疗后,予以保肝、消炎、镇痛等处理。每1~2月复查CT及AFP进行随访。
2 结果
所有病例28个病灶于TACE后2~4周各行PMCT治疗1次,其中3个病灶2周内补充PMCT治疗1次。PMCT后通过活检及CT增强扫描,显示25个肿瘤病灶完全性坏死,并有肿瘤周边正常肝实质3~5 mm宽度的完整环状坏死区域(图1~4);另3个病灶治疗后肿瘤完全坏死,周边正常肝实质坏死不完整。
20例AFP升高的患者中,15例治疗后2周内AFP降至正常水平,其余5例患者治疗后4周内AFP降至正常水平。
TACE术后有发热、疼痛、恶心、呕吐等栓塞后综合征,经消炎、保肝、镇痛等处理后均得到缓解。PMCT术中患者多诉局部烧灼疼痛,但多数能忍受,个别患者需间断微波凝固操作。PMCT术后多有发热、局部疼痛等不适,予以对症处理后可缓解。本组病例无内出血、胆道损伤、针道种植等并发症发生。
所有病例均接受随访,随访时间6~24个月,均无复发表现。随访期内患者均存活。

图1

图2

图3
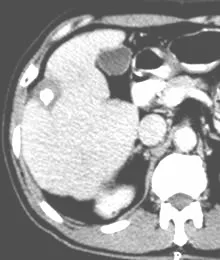
图4
3 讨论
自1976年Goldstein等[2]首先报道了TACE治疗肝恶性肿瘤后,TACE开始应用于肝癌治疗。1979年日本学者Yamada等[3]用碘化油栓塞治疗肝癌,开创了介入治疗的新纪元。但TACE治疗肝癌很难达到根治目的。近年来国内外学者强调肝癌综合治疗的重要性,努力探索物理性治疗肝癌的新方法。1994年Seki等[4]首先报道PMCT治疗小肝癌,之后PMCT逐渐成为治疗肝癌的重要方法之一。
PMCT治疗肝癌是利用微波的热效应和肿瘤对热敏感的特点,通过插入肿瘤内的电极产生高温,使肿瘤组织迅速凝固坏死,以达到杀灭肿瘤的目的。PMCT作用范围与微波电极针的直径、输出功率、凝固时间以及局部血循环状况有关[5-6]。由于微波治疗仪电极针的直径是恒定不变的,而增大输出功率、延长凝固时间必然加重患者的痛苦。因此,减少局部血流量成为扩大PMCT作用范围的最佳方式。
研究表明,大多数原发性肝癌有丰富的血供。经肝动脉注射碘化油和明胶海绵行TACE,在阻断肿瘤动脉血供的同时,碘化油能通过许多肝动-门脉间的交通支填充到肿瘤周围的门静脉内,减少门静脉的血供,从而减少丰富血流冷却微波热能的不利影响。试验研究表明,相同条件下,活体动物肝脏的微波凝固范围小于离体肝脏微波凝固范围,说明血流引起的散热效应可使微波凝固范围缩小[4]。另外,TACE还能引起肿瘤组织缺血和炎症水肿,有利于热的产生和传递,增加热的敏感性,扩大凝固范围[7]。因此,PMCT治疗前行TACE,在治疗上具有协同、互补的作用[8]。这就是采用肝动脉化疗栓塞联合经皮微波消融术治疗小肝癌的理论基础。
原发性肝癌多在肝硬化的基础上恶变而来,存在多病灶倾向。于PMCT前行TACE治疗,除可增强PMCT效能外,还有利于发现常规影像检查未能检出的子灶,因为DSA和碘油CT仍是检出小肝癌的最佳方法。同时,对PMCT未能处理的病灶,TACE能及时得到有效地控制。这也是实施PMCT前先行TACE治疗的目的所在。
PMCT具有特殊的抗肿瘤免疫作用是其优势之一。原理是灭活的组织可以产生热休克蛋白,刺激机体的免疫系统,使肿瘤和邻近肝组织内的免疫细胞明显增加,局部和全身免疫功能得到增强,从而抑制肿瘤细胞的扩散,预防肿瘤复发[9-11]。
需要注意的是,行PMCT时,不但需杀灭中央部分的肿瘤组织,而且需同时将其周边一定范围内的正常肝实质一同灭活,这样才能获得肿瘤完全坏死的疗效。这是因为肝细胞癌有很高的侵犯包膜及包膜外的几率[12]。本研究使用的微波治疗仪,在输出功率为60~70 W、凝固时间为15 min条件下,能造成直径4~5 cm范围内的组织凝固坏死。在TACE基础上,1次单针组织凝固坏死的范围完全能覆盖≤3 cm的肝癌病灶,并保证病灶周边5 mm左右的安全边缘;而且发生癌细胞血行播散的可能性亦较小[13]。我们联合应用肝动脉化疗栓塞和经皮微波凝固术治疗28个小肝癌病灶,均获得完全坏死,随访6~24个月无复发。
本组病例PMCT副反应均较轻微,术中及术后局部疼痛均不严重,无内出血、胆道损伤及针道播散等并发症,说明PMCT是安全的治疗方法。
综上所述,我们认为联合应用TACE和PMCT治疗≤3 cm小肝癌创伤小,操作简便,疗效好,且能提高机体免疫功能,可作为不适合手术切除的小肝癌首选治疗方案,是一种较理想的综合治疗方法。
[1]中国抗癌协会肝癌专业委员会.原发性肝癌诊断标准[J].中华肝病杂志,2000,8(3):135.
[2]Goldstein HM,Wallace S,Anderson JH,et al.Transcatheter occlusion of abdominal tumors[J].Radiology,1976,120(3):539-545.
[3]Yamada R,Sato M,Kawabata M,et al.Hepatic artery embolization in 120 patients with unresectable hepatoma[J].Radiology,1983,148(2):397-401.
[4]SekiT,WakabayashiM,NakagawaT,etal.Ultrasonically guided percutaneous microwave coagulation therapy for small hepatocellular carcinoma[J].Cancer,1994,74(3):817-825.
[5]SekiT,WakabayashiM,NakagawaT,etal.Percutaneous microwave coagulation therapy for small hepatocellular carcinoma:comparison with percutaneous ethanol injection therapy[J].Cancer,1999,85(5):1694-1702.
[6]Dong BW,Liang P,Yu XL,et al.Sonographically guided microwavecoagulation treatment of liver cancer:an experimental and clinical study[J].Am J Roentgenol,1998,171(2):449-454.
[7]曹玮.化学药物加温灌注肝癌[J].国外医学·临床放射学分册,2001,24(1):22-25.
[8]王精兵,冯敢生,梁惠民,等.肝动脉化疗栓塞联合经皮微波凝固治疗恶性肝肿瘤的初步观察[J].中华肿瘤杂志,2004,26(2):125-126.
[9]韩秀婕,董宝玮,梁萍,等.微波治疗肝癌后局部细胞免疫变化及其对临床疗效影响[J].中国癌症杂志,2007,17(2):135-138.
[10]管军,姚晓平,吴孟超,等.微波组织凝固对晚期肝癌患者抗肿瘤免疫力的影响[J].中华物理医学杂志,1998,20(3):168-170.
[11]管军,姚晓平,吴孟超,等.微波组织凝固诱导荷瘤宿主的抗肿瘤效应[J].中华物理与康复杂志,1999,21(2):97-99.
[12]Nakajima Y,Nagabuchi E,Sato N,Kamiyama T,et al.A clinicalstudy ofliver resections in patients with small hepatocellular carcinoma less than three centimeter in diameter[J].Nippon Geka Gakkai Zasshi,1992,93(9):1087-1090.
[13]马焕先,顾万清,李崇辉,等.微波固化和手术切除对肝癌细胞血行性播散的影响[J].解放军医学杂志,2005,30(6):539-541.
