α-synuclein与帕金森病
2010-08-09赵大龙王珂
赵大龙,王珂
帕金森病(Parkinson’s disease,PD)是一种常见的神经变性性疾病,由 Parkinson 于 1817 年首次提出,其突出表现为选择性中脑黑质多巴胺能神经元丧失及纹状体多巴胺含量显著减少,同时在神经元细胞质中产生泛素化蛋白沉淀,即 Lewy 小体。在散发 PD 患者中,黑质和纹状体中神经胶质增生是另一显著的神经病理学特征。
PD 是一种仅次于阿尔茨海默症(Alzheimer disease,AD)的神经变性性疾病,多见于中老年人,在年龄大于 50 岁的人群中,患病率约为 1%。大多数学者认为此病是由于多种易感基因和环境因素之间复杂的相互作用所致,但人们对于这种作用仍不甚了解。目前,已从不同的家族性帕金森病例中确定了若干个致病基因,如 α-synuclein、nuclear receptor-related 1(Nurr 1)、parkin 和ubiquitin C-terminal hydroxylase L1(UCHL 1)等。此外,还有一些 PD 相关基因与多巴胺能神经元损伤,多巴胺合成、代谢及功能,能量供给,氧化应激和细胞解毒等密切相关,这些基因的作用在转基因动物模型及临床患者中已得到证实。
1 α-synuclein 基因
α-synuclein 基因是由 Polymeropoulos 等在一个遗传性 PD 家族(Contursi 家族)中首先发现的,它定位于4q21-q23,属常染色体显性(autosomal dominant,AD)遗传。序列分析表明,α-synuclein 基因第 209 位的鸟嘌呤被腺嘌呤取代(G209A),导致氨基酸序列第 53 位由苏氨酸替代丙氨酸(A53T)。基因发生改变后,破坏了 α-synuclein的 α-螺旋,而易于形成 β-片层结构,后者参与了蛋白质的自身聚集。1998 年,Kruger 等在一个德国家系中发现α-synuclein 基因还存在另一种突变,即第 88 位的鸟嘌呤被胞嘧啶取代(G88C),导致氨基酸序列第 30 位由脯氨酸替代丙氨酸(A30P)。近年,又有学者在一个 AD 遗传的西班牙家系中发现 α-synuclein 的第三种突变—E46K 突变[1]。
很多学者在研究其他大的 PD 家系和不同散发病例后,并未发现 α-synuclein 存在突变。A53T 和A30P 突变在临床表现上也不尽相同,A53T 突变的患者临床特征与散发性帕金森病有差异,如发病年龄早(平均为 46.5 岁),震颤发生率低,进展快速(一般从发病到死亡平均为9.7 年),此外还出现痴呆等一些不典型的症状。而 A30P突变的临床表现与散发性 PD 则非常接近。采用转基因方法在果蝇身上表达野生型和突变型 α-synuclein 后发现,表达 α-synuclein 突变型基因的个体表现出运动功能障碍。经检查其脑内多巴胺能神经元出现丢失,神经元内产生以 α-synuclein 为主的包涵体。据报道,在散发型 PD 中,上调 α-synuclein 基因水平,可以带来黑质中 10 倍量的α-synuclein 蛋白表达[2]。
此外,将野生型和A53T、A30P 突变型 α-synuclein 基因导入 BE-M17 细胞后,也发现胞浆内存在聚集物。在 PD中,A53T 突变可以加速 α-synuclein 蛋白的纤维化,但A30P 突变则无此作用。与野生型及 A53T、A30P 突变相比,E46K 突变显著增强了 α-synuclein 与带负电荷的脂质体的结合能力,并增强了 α-synuclein 丝状纤维的聚集能力。此外,在 α-synuclein 基因启动子区域存在一个呈多态性的等位基因,其在 PD 患者和正常人之间存在显著差异,导致存在 PD 易感基因型的人群发生 PD 的机率较正常人高出 12.8 倍。因此,α-synuclein 基因作为遗传因素在 PD发病中起关键作用[3]。
2 α-synuclein 蛋白
2.1 α-synuclein 蛋白的结构特性
synuclein 蛋白是1988 年首次从电鲟鱼的带电器官中分离得到的,包括 α-,β- 和γ-synuclein 3 种类型,其中 α-synuclein 和β-synuclein 主要存在于脑组织,而γ-synuclein 主要分布于周围神经和视网膜。目前对于α-synuclein 的功能尚不清楚,但大量研究发现其存在于许多神经系统变性性疾病的神经元突触末梢或胞浆包涵体中,所以多数学者认为它参与了神经元的变性过程,在 PD 发病中起重要作用。
synuclein 是一个小分子蛋白质家族,广泛分布于中枢神经系统突触前末梢。α-synuclein 由 140 个氨基酸组成,序列高度保守,并有一个两性结构域,可以与脂质双层结合。α-synuclein 蛋白的状态及浓度可以影响其结构,且因病理性突变及核的作用而增强。在溶液中 α-synuclein 呈非折叠的无定形结构;在脂质膜内可形成 α-螺旋结构;在含有高浓度 α-synuclein 蛋白的脂质膜内,则可形成纤维样的β-片层结构。α-synuclein 在与膜磷脂相互作用时,其 N,C端都可与囊泡膜结合,结合后 α-螺旋从 3% 增加到 80%。研究发现,α-synuclein 与磷脂双层结合可以稳定蛋白二级结构中的 α-螺旋,而 α-螺旋增加,β-片层减少,可使α-synuclein 不易产生聚集。α-synuclein 可通过膜进口受体进入到线粒体感受器的外部和内部,发挥其生理作用[4-5]。
2.2 α-synuclein 蛋白的生理功能
目前,人们对于 α-synuclein 蛋白的生理功能还没有全面的认识。已有研究显示它可能与突触的发育和可塑性、突触膜系统和信号传递、多巴胺的合成及突触小泡的转运功能等密切相关。
α-synuclein 蛋白在神经组织中分布广泛,主要在新皮质、海马、嗅球、纹状体及丘脑中表达,端脑中的含量尤其丰富。由于 α-synuclein 主要位于神经细胞的突触前膜,所以推测它与突触前膜的功能有关。Murphy 等发现,α-synuclein 能够调节神经元突触前囊泡池的大小,并且可与突触膜系统相互作用影响突触功能。当考查胚胎期、幼龄期和成龄期小鼠脑组织中 α-synuclein 表达峰值的分布后,与突触素表达峰值相比较发现,在胎龄 12~15 d 时,就可以在鼠脑中检测到 α-synuclein 的表达,随后其表达水平不断升高,而突触素的表达在胚胎的晚期才逐渐升高,这个现象说明 α-synuclein 蛋白可能做为一种突触前调控蛋白参与了突触的发生及中枢神经系统的发展。
在 α-synuclein 基因敲除小鼠中发现,随着年龄增加,小鼠产生多巴胺依赖的反应性运动减少,同时黑质和纹状体中多巴胺水平出现下降,提示 α-synuclein 可能在多巴胺囊泡的释放和转运中起一定作用。将人野生型和A53T 突变的 α-synuclein 基因导入 MN9D 细胞后,发现酪氨酸羟化酶(tyrosine hydroxylase,TH)的含量并未减少,但活性明显降低,导致多巴胺合成减少,这说明 α-synuclein 基因可能在多巴胺的生物合成中起作用。将 α-synuclein 基因导入K562 细胞后,发现当诱导该巨核细胞分化时,α-synuclein表达上调,而 β-synuclein 表达下调,在血小板中仅存在大量的 α-synuclein,提示在造血细胞的分化过程中,synuclein家族成员的分布与表达起到重要作用。过度表达α-synuclein 可能会造成细胞死亡,因为 α-synuclein 能与蛋白激酶 C(PKC)、BAD、细胞外调节激酶等蛋白结合,抑制 PKC 的活性。免疫共沉淀证明 α-synuclein 可与 PP2A相互作用,并激活 PP2A[6]。
此外,α-synuclein 的 61~95 氨基酸片段(NAC)具有神经毒性作用,而且形成 β-片层构象的能力与毒性作用呈正相关。α-synuclein 还可能涉及了与磷酸肌醇相关的第二信使通路,是细胞信号传导过程中的一个重要成员。
总之,α-synuclein 可以与多种蛋白相互作用,体现不同的生理功能(图 1)。
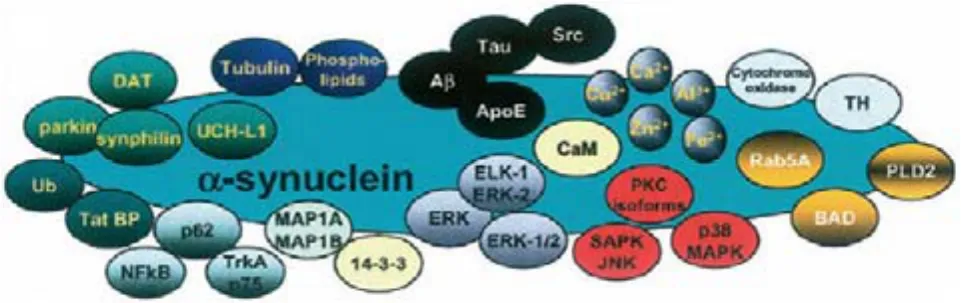
图1 与 α-synuclein 产生相互作用的蛋白质
3 α-synuclein 与 Lewy 小体
Lewy 小体被认为是PD 的病理性标志物,其主要成分是α-synuclein。α-synuclein 基因突变可以使 α-螺旋向 β-片层改变,导致蛋白聚集。将野生型和突变型 α-synuclein蛋白于体外培养时均可发生纤维聚集,只是突变型蛋白聚集地更快。α-synuclein 蛋白总量增多或具有毒性构象的α-synuclein 蛋白选择性增多,都可以导致多巴胺细胞易死亡。以上提示 α-synuclein 参与了 Lewy 小体形成及 PD神经元变性过程。过去认为,Lewy 小体形成是导致 PD 的病因,而目前大多数学者认为,Lewy 小体形成初始是细胞的一种自我保护机制,它可将有害的蛋白聚集物进行包裹、限制,并不是PD 主要病理机制,而寡聚化初纤维才是致病的主要原因。类似 Lewy 小体的病理性包涵体不只存在于 PD 中,在 AD、Down 综合征及弥漫型 Lewy 小体病等患者的皮质、皮质下和轴突中都可呈 NACP 免疫阳性,并在 PD 的黑质和皮质下 Lewy 小体中显示强阳性。以上提示 α-synuclein 蛋白可能与其他蛋白相互作用,在多种神经元变性的过程中起协同作用。包涵体中还含有泛素-蛋白酶体(ubiquitin-proteasome),所以推测 α-synuclein 的聚集与清除在细胞功能失调中起关键性作用。
目前,尚不清楚 Lewy 小体形成的具体机制,已有的相关研究结果主要为以下几个方面(图 2):
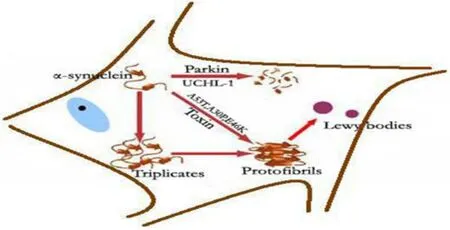
图2 Lewy 小体形成与 α-synuclein 间的关系
⑴ α-synuclein 自身改变导致 Lewy 小体形成。正常α-synuclein 蛋白的构象在异常相互作用中发生改变,首先形成三聚体,继而形成初纤维,后者作为中间体聚集成纤维化的多聚体,初纤维还可以结合 β-淀粉样蛋白进一步刺激聚集,从而形成 Lewy 小体。蛋白结构由 α-螺旋向 β-折叠改变导致寡聚化初纤维中含有大量的 β-折叠结构,这使得蛋白功能丧失并产生神经毒性。在体内,微管蛋白可与聚集的 α-synuclein 纤维结合,参与并促进 Lewy 小体的形成。synphilin 蛋白在体内可以与 α-synuclein 结合,在体外共转染后,细胞胞浆出现类似 Lewy 小体的包涵体。当下调培养细胞的甘油磷酸钙水平时,也可导致 α-synuclein 蛋白聚集。由于 α-synuclein 蛋白发生构象改变形成初纤维,从而使细胞遭受毒性损害,这可能是它在散发性 PD 中的特征性改变。
⑵如前所述,A53T、A30P、E46K 等基因突变可以导致 α-synuclein 蛋白构象改变而产生聚集,形成 Lewy 小体。甘氨酸残基在维持人酰基磷酸酯酶的稳定性中起重要作用,而甘氨酸突变为其他氨基酸会使蛋白结构不稳定,产生聚集倾向[7]。α-synuclein 的谷氨酸被赖氨酸取代(E46K 突变)可以改变 α-synuclein 蛋白表面的电荷分布,并提供额外的转谷氨酰胺酶反应的场所,最终改变了 α-synuclein 蛋白与脂质的相互作用,增加 α-synuclein 的交联和聚集。E46K 突变型患者的疾病进程要快于散发型患者及其他家族性 PD 患者,同时伴有显著的痴呆和皮层 Lewy 小体症状[1]。Neeraj 等[8]也证实,在 α-synuclein 第四个 KTKEGV重复区的 E46K 突变显著提高了 SH-SY5Y 细胞中α-synuclein 蛋白聚集的可能性。在这个家族中,患者有四个 α-synuclein 基因拷贝,而不是通常的两个。额外的拷贝也为正常的野生型序列,所以很难定性分辨蛋白的差异。但是,与正常对照相比,这些患者的 α-synuclein 蛋白表达量约为正常者的两倍[9]。以上的结果足以导致疾病的发生,并且疾病的严重程度与基因拷贝数呈正相关[10]。SNCA 双倍化可以产生典型的 PD 症状,而三倍化不仅可以产生 PD症状,还可以导致其他神经病理性损害如弥漫型 Lewy 小体症,这说明 α-synuclein 水平升高确实可能是PD 的病因。Singleton 等[11]正在研究其他同样存在蛋白沉积的疾病(如 AD),试图通过降低这些蛋白表达或增强蛋白清除能力来达到临床治疗目的。
⑶泛素-蛋白酶体系功能障碍导致 Lewy 小体形成。α-synuclein 蛋白在细胞内由泛素-蛋白酶体系进行清除,在家族性和散发型 PD 中,此酶体系可因氧化应激而受到不同程度的损害。如果清除途径受阻,α-synuclein 蛋白就不能被及时有效降解从而聚集形成 Lewy 小体,结果会导致细胞衰老甚至死亡。热休克蛋白可以抑制 MPP+诱导的α-synuclein 高表达,并增强细胞内泛素化水平,提高蛋白酶体活性,加速蛋白降解[12]。热体克蛋白做为分子伴侣可以协助多肽链正确折叠,避免发生蛋白聚集。Nakajimaa等[13]将大鼠脑室给予亮肽素,发现神经组织中存在大量α-synuclein 阳性结构。免疫电镜显示 α-synuclein 免疫反应性集中在海马轴突处,特别是突触前末梢,而激光共聚焦扫描后很少见到泛素化 α-synuclein。以上结果提示溶酶体和泛素依赖的蛋白酶体代谢通路受损可导致局部 α-synuclein聚集。在有些模型中,抑制蛋白酶体可以导致 α-synuclein包涵体形成。此外,很多最新的证据表明,α-synuclein 蛋白降解并不是主要通过泛素蛋白酶体通路,而是通过溶酶体通路实现。
⑷化学作用导致 Lewy 小体形成。多巴胺氧化后可与α-synuclein 形成共价复合体,抑制了中间体的正向聚集,导致初纤维含量升高。Vladimir 等[14]运用不同的生物物理学和生物化学技术对硝化 α-synuclein 的性质进行了研究,结果显示,硝化作用可以导致蛋白产生部分折叠构象,形成的寡聚体还可形成不溶且耐热的高分子多聚体,并可能会干扰自噬途径,从而导致多巴胺能神经元损伤[15]。在 PD 动物模型中还可检测到硝化的 α-synuclein 包涵体[16]。细胞色素 C/氢过氧化物可使重组 α-synuclein 产生聚集,抗氧化剂可阻断此种聚集作用,铁螯合剂也可部分抑制这种作用。由于细胞色素 C 也存在于 Lewy 小体中,推测由细胞色素C/氢过氧化物介导的氧化还原反应可能参与了 α-synuclein的聚集。以上提示硝化和氧化作用均可能参与了路易小体的形成。此外,氧化应激可以损害细胞的微环境,也能够加速α-synuclein 蛋白的聚集。
⑸金属离子作用导致 Lewy 小体形成。锰、铜、钴、铁、铝等带正电荷的金属离子可能通过中和α-synuclein C端的负电荷而进一步融入蛋白中,引起构象改变,促进初纤维形成。这种作用同离子半径大小成反比,与化合价高低成正比。
⑹体内外的多种毒素如鱼藤酮、百草枯可以与α-synuclein 的疏水片段结合,引起 α-synuclein 的聚集。过表达 A30P 突变性 α-synuclein 蛋白也可以增强 MPTP 对DA 神经元的损伤[17]。在灵长类和啮齿类动物中,MPTP 通过损伤黑质中的 DA 神经元产生与临床相似的病理症状,Shimoji 等[18]通过不同间隔给予不同剂量的 MPTP 制造了急性,半急性及慢性 C57BL6 小鼠 PD 模型,结果发现酪氨酸羟化酶、DA 及其代谢物均有显著减少,但并未产生包涵体。
⑺α-synuclein、泛素和突触素等神经元突触蛋白的异常转运在路易小体的形成中也起重要的作用。
⑻当 β-synuclein 与 α-synuclein 之比大于 4 时,α-synuclein 的聚集明显减弱。β-synuclein 本身并不参与聚集,但与 α-synuclein 结合后,有利于后者形成 α 螺旋,并可发挥抗氧化作用,抑制氧化应激引起的 α-synuclein聚集。
4 α-synuclein 与 PD
目前,对于 PD 的确切发病机制仍不明了。通过流行病学调查及遗传连锁分析等方法均证明遗传病原学是PD的发病原因之一,其中 α-synuclein 是最为关键的基因。与α-synuclein 基因突变相关的家族性 PD 有如下的临床特点:属于染色体显性遗传,每代连续发病;发病早(平均发病年龄为 46 岁);进展快(平均病程 < 9 年);有运动迟缓、静止性震颤、强直等典型 PD 临床表现,并且常伴有如共济失调、锥体系损害、精神症状等非典型 PD 症状;可见由 α-synuclein 蛋白大量聚集形成的 Lewy 小体,并有皮层海绵样改变的非典型 PD 特征。基因突变能改变α-synuclein 蛋白的动力学从而表现出聚集倾向,变异的α-synuclein 蛋白还可以引起多巴胺能神经元中蛋白酶复合体功能的损害。但是,在散发型 PD 中,α-synuclein 基因突变并不起主要作用。泛素-蛋白酶体系的损伤可导致蛋白消除障碍形成聚集,从而引发 PD。此外,氧化应激与线粒体功能障碍也是导致 PD 的病因之一[19]。近期研究表明,编码线粒体蛋白 PINK 1 的基因突变与遗传早发性 PD 相关[20]。环境因素如杀虫剂、除草剂及一些工业化学试剂均有可能通过对氧化应激发生作用而导致 PD。
α-synuclein 在 PD 发病中可能的作用机制主要包括产生神经毒性作用、扰乱多巴胺的存储与释放、影响突触功能和信号传递、增加氧化应激水平等。
α-synuclein 蛋白的 NAC 片段具有神经毒性,在体外,0.5~10.0 mmol/L 的 NAC 就可选择性减少多巴胺含量、导致多巴胺能神经元死亡。25~100 mmol/L 的 NAC 则丧失选择性,对所有神经细胞都产生毒性作用。体内实验也发现了相似的选择性神经毒性作用,经证明,毒性作用强弱与β-片层纤维聚集的程度相关。过表达人类野生型或突变型α-synuclein 蛋白可导致 N27 细胞和SH-SY5Y 细胞凋亡,并增强 6-OHDA 的神经毒性作用。但也有其他学者认为野生型 α-synuclein 可降低细胞对不同凋亡因素的易感性。
对表达 A53T 突变型 α-synuclein 细胞进行蛋白印迹分析,发现囊泡单胺转运体 2(vesicular monoamine transporter,VMAT2)与 TH 相比表达较少,提示α-synuclein 的此种突变能下调囊泡的储存和释放功能。由于 α-synuclein 的定位接近突触囊泡,在与磷脂囊泡结合后,可引发其结构改变,提示 α-synuclein 可能做为突触前调节因子参与囊泡再循环。此外,α-synuclein 的初纤维与磷脂囊泡结合能力强于单体或多聚体,更易导致囊泡渗透性增加,导致包括 DA 在内的小分子的泄漏,胞质中 DA 的浓度显著增加。耗竭细胞内的 DA 可以阻断 A53T α-synuclein 诱导的神经元凋亡,提示其通过 DA 途径起作用。Hasegawa 等[21]发现酪氨酸酶过表达可导致细胞凋亡,共表达野生型/A53T 突变型 α-synuclein 和酪氨酸酶可进一步杀死细胞。在这个过程中,可形成 α-synuclein 寡聚体,同时线粒体膜电位降低。Machida 等[22]指出:parkin 和α-synuclein 在参与 DA 代谢过程中存在相同的路径,而此路径的异常会导致氧化型 DA 代谢产物聚集并引起细胞死亡。
α-synuclein 的 N,C 端都可与囊泡膜结合,并通过影响蛋白激酶 A 催化 tau 蛋白磷酸化而间接影响微管的稳定性。α-synuclein 倾向与含磷脂酸并且直径为 2~20 nm的较小的囊泡结合,结合后 α-螺旋比例由约 3% 大幅上升为 80%,前述 α-螺旋增加 β-片层减少则蛋白不易聚集,所以认为 α-synuclein 蛋白与突触膜系统的结合直接影响了其二级结构的稳定性。磷脂酶 D2(phospholipase Disoform2,PLD2)和蛋白激酶 1(protein kinase C,PKC)参与囊泡的运输、出胞及再循环过程,PLD2 是信息传导中的重要媒介物质,并与细胞生长分化有关。体外实验表明 α- synuclein能抑制 PLD2 的活性,并能通过抑制 PKC 的活性,进一步抑制 PLD2 的活性,因此 α-synuclein 也可能参与突触的信号传递系统。
氧化损伤已被证明是PD 发病机制之一[23]。胞内α-synuclein 浓度异常升高时,可直接抑制线粒体功能,导致氧化应激水平升高,细胞更易遭受氧化应激损害,活性氧族水平升高,对于多巴胺诱导的细胞死亡更加敏感。体外实验表明,表达人突变型 α-synuclein 的 PC12 细胞中可见蛋白酶体活性下降,与凋亡相关蛋白如 caspase-3、-9 表达升高[24]。
在 BE-M17 细胞中过度表达人野生型和突变型α-synuclein 蛋白后发现,A53T 型对铁的敏感性约增加4 倍,A30P、野生型的敏感性也均强于正常细胞。当表达α-synuclein 突变产物的细胞接触氢过氧化物或 MPP+后,对氧化作用敏感性也相应升高。A53T 型 α-synuclein 可以通过抑制 VMAT2 的表达,降低突触囊泡对多巴胺的储存能力,胞质内 DA 和活性氧族浓度显著增加,导致细胞氧化应激死亡。Klivenyi 等[25]发现 α-synuclein 缺陷小鼠可耐受 MPTP 诱导的 DA 神经元变性,同时也可耐受丙二酸和3-硝基丙酸引起的神经毒性,这可能是因为 α-synuclein 可以做为氧化损伤的调节器。Chen 和Feany[26]发现在果蝇中α-synuclein 初原纤维的毒性依赖于丝氨酸的磷酸化。给予α-synuclein 敲除小鼠 MPP+后,除了对毒性的耐受表现外,体内乳酸盐水平也有升高。使用 Alet 泵持续给予 MPTP可导致葡萄糖摄取水平持续升高和泛素蛋白酶体系损伤[27]。
自果蝇转基因模型后,研究者又构建了野生型、A53T及 A30P 突变 α-synuclein 的转基因小鼠模型,其中以野生型和A53T 的居多,A30P 的则较少,并且这些模型大部分为非调控表达,可调控表达的模型非常少见,这也给探索PD 发病原回带来了不便[28-29]。
PD 传统的治疗方案是以左旋多巴(L-3,4-dihydroxyphenylethylamine,L-DOPA)为主,但存在不能阻止疾病发展、后期无效等问题。向脑内植入能产生多巴胺的细胞也有一定的疗效,但因存活、效果、细胞来源等问题很难在临床推广[30]。目前,人们还在尝试进行 PD 基因治疗,如通过导入编码多巴胺合成酶的基因以增加多巴胺含量,或者引入神经营养因子基因来阻止或减缓多巴胺能神经元的退变,促进损伤神经元恢复等[31]。
实践证明这些方案均可以不同程度改善 PD 模型的症状。有关 α-synuclein 在 PD 致病机制中的作用目前仍有很多争议,由于 α-synuclein 还参与其他神经变性疾病,充分说明其与神经元变性密切相关。设想通过作用于α-synuclein,以对抗蛋白聚集为主要途径而达到控制疾病的目的,这给 PD 的治疗带来了无限的希望。
[1]Zarranz JJ, Alegre J, Gómez-Esteban JC, et al.The new mutation,E46K, of alpha-synuclein causes Parkinson and Lewy body dementia.Ann Neurol, 2004, 55(2):164-173.
[2]Shehadeh L, Mitsi G, Adi N, et al.Expression of Lewy body protein septin 4 in postmortem brain of Parkinson’s disease and control subjects.Mov Disord, 2009, 24(2):204-210.
[3]Cronin KD, Ge D, Manninger P, et al.Expansion of the Parkinson disease-associated SNCA-Rep1 allele upregulates human alpha-synuclein in transgenic mouse brain.Hum Mol Genet, 2009, 18(17):3274-3285.
[4]Devi L, Raghavendran V, Prabhu BM, et al.Mitochondrial import and accumulation of alpha-synuclein impair complex I in human dopaminergic neuronal cultures and Parkinson disease brain.J Biol Chem, 2008, 283(14):9089-9100.
[5]Devi L, Anandatheerthavarada HK.Mitochondrial trafficking of APP and alpha synuclein: relevance to mitochondrial dysfunction in Alzheimer’s and Parkinson’s disease.Biochim Biophys Acta, 2010,1802(1):11-19.
[6]Liu D, Jin L, Wang H, et a1.Silencing alpha-synuclein gene expression enhances tyrosine hydroxylase activity in MN9D cells.Nettroehem Res, 2008, 33(7):1401-1409.
[7]Parrini C, Taddei N, Ramazzotti M, et al.Glycine residues appear to be evolutionarily conserved for their ability to inhibit aggregation.Structure, 2005, 13(8):1143-1151.
[8]Pandey N, Schmidt RE, Galvin JE.The alpha-synuclein mutation E46K promotes aggregation in cultured cells.Exp Neurol, 2006,197(2):515-520.
[9]Miller DW, Hague SM, Clarimon J, et al.Alpha-synuclein in blood and brain from familial Parkinson disease with SNCA locus triplication.Neurology, 2004, 2(10):1835-1838.
[10]Singleton A, Gwinn-Hardy K.Parkinson's disease and dementia with Lewy bodies: a difference in dose? Lancet, 2004, 364(9440):1105-1107.
[11]Singleton A, Myers A, Hardy J.The law of mass action applied to neurodegenerative disease: a hypothesis concerning the etiology and pathogenesis of complex diseases.Hum Mol Genet, 2004, 13 Spec No 1:R123-R126.
[12]Fan GH, Zhou HY, Yang H, et al.Heat shock proteins reduce alpha-synuclein aggregation induced by MPP+ in SK-N-SH cells.FEBS Lett, 2006, 580(13):3091-3098.
[13]Nakajima T, Takauchi S, Ohara K, et al.Alpha-synuclein-positive structures induced in leupeptin-infused rats.Brain Res, 2005,1040(1/2):73-80.
[14]Uversky VN, Yamin G, Munishkina LA, et al.Effects of nitration on the structure and aggregation of alpha-synuclein.Brain Res Mol Brain Res, 2005,134(1): 84-102.
[15]Martinez-Vicente M, Talloczy Z, Kaushik S, et al.Dopaminemodified alpha-synuclein blocks chaperone-mediated autophagy.J Clin Invest, 2008, 118(2):777-788.
[16]Gao HM, Kotzbauer PT, Uryu K, et al.Neuroinflammation and oxidation/nitration of alpha-synuclein linked to dopaminergic neurodegeneration.J Neurosci, 2008, 28(30):7687-7698.
[17]Nieto M, Gil-Bea FJ, Dalfó E, et al.Increased sensitivity to MPTP inhuman alpha-synuclein A30P transgenic mice.Neurobiol Aging, 2006,27(6):848-856.
[18]Shimoji M, Zhang L, Mandir AS, et al.Absence of inclusion body formation in the MPTP mouse model of Parkinson's disease.Brain Res Mol Brain Res, 2005, 134(1):103-108.
[19]Andersen JK.Oxidative stress in neurodegeneration: cause or consequence? Nat Med, 2004, 10 Suppl:S18-S25.
[20]Valente EM, Abou-Sleiman PM, Caputo V, et al.Hereditary early-onset Parkinson's disease caused by mutations in PINK1.Science, 2004, 304(5674):1158-1160.
[21]Hasegawa T, Matsuzaki-Kobayashi M, Takeda A, et al.Alphasynuclein facilitates the toxicity of oxidized catechol metabolites:implications for selective neurodegeneration in Parkinson's disease.FEBS Lett, 2006, 580(8):2147-2152.
[22]Machida Y, Chiba T, Takayanagi A, et al.Common anti-apoptotic roles of parkin and alpha-synuclein in human dopaminergic cells.Biochem Biophys Res Commun, 2005, 332(1):233-240.
[23]Chen CM, Liu JL, Wu YR, et al.Increased oxidative damage in peripheral blood correlates with severity of Parkinson’s disease.Neurobiol Dis, 2009, 33(3):429-435.
[24]Benner EJ, Banerjee R, Reynolds AD, et al.Nitrated alpha-synuclein immunity accelerates degeneration of nigral dopaminergic neurons.PLoS ONE, 2008, 3(1):e1376.
[25]Klivenyi P, Siwek D, Gardian G, et al.Mice lacking alpha-synuclein are resistant to mitochondrial toxins.Neurobiol Dis, 2006, 21(3):541-548.
[26]Chen L, Feany MB.Alpha-synuclein phosphorylation controls neurotoxicity and inclusion formation in a Drosophila model of Parkinson disease.Nat Neurosci, 2005, 8(5):657-663.
[27]Fornai F, Schluter OM, Lenzi P, et al.Parkinson-like syndrome induced by continuous MPTP infusion: convergent roles of the ubiquitin-proteasome system and alpha-synuclein.Proc Natl Acad Sci U S A, 2005, 102(9):3413-3418.
[28]Nuber S, Petrasch-Parwez E, Winner B, et al.Neurodegeneration and motor dysfunction in a conditional model of Parkinson's disease.J Neurosci, 2008, 28(10):2471-2484.
[29]Plaas M, Karis A, Innos J, et al.Alpha-synuclein A30P point-mutation generates age-dependent nigrostriatal deficiency in mice.J Physiol Pharmacol, 2008, 59(2):205-216.
[30]Brighina L, Prigione A, Begni B, et al.Lymphomonocyte alpha-synuclein levels in aging and in Parkinson disease.Neurobiol Aging, 2010, 31(5):884-885.
[31]Olanow CW, Rascol O, Hauser R, et al.A double-blind, delayed-start trial of rasagiline in Parkinson's disease.N Engl J Med, 2009, 361(13):1268-1278.
