地塞米松对大鼠支气管哮喘气道重塑及PDGF-BB表达的影响
2010-08-08张朝蔷薄建萍李江波
张朝蔷 薄建萍 李江波
支气管哮喘是多种细胞和细胞成分参与的气道慢性炎症性疾病,气道炎症和气道高反应是支气管哮喘的特点。近年来,气道重塑在支气管哮喘发病中的作用受到高度重视,被认为是引起不可逆的气道阻塞和气道高反应的病理基础[1]。PDGF是1974年才发现的一种肽类调节因子,贮存于血小板的α颗粒中,当血小板被激活后,PDGF与血小板因子、β血小板球蛋白等一起释放出来。体内多种细胞可以产生和分泌PDGF[2]。PDGF-BB为PDGF家族中的主要成员之一,它是由PDGF-B链通过二硫键而形成的同源二聚物[3]。PDGF-BB具有强烈的促进气道平滑肌增殖、促进成纤维细胞的增生及胶原蛋白的合成作用,研究发现,气道上皮损伤后PDGF释放增多,并能促进共培养体系中肌成纤维细胞增生,因此,PDGF-BB被认为与哮喘过程中气道平滑肌增生肥厚、气道痉挛及气道上皮纤维化有关[4]。本文通过观察PDGF-BB在不同程度的气道重塑中的表达变化,探讨了PDGFBB与气道重塑的关系及地塞米松的干预作用。
1 材料和方法
1.1 材料 选择SPF级Wistar雄性大鼠40只,2~3月龄,体重160~180g(由山西医科大学生理动物实验室提供)。卵白蛋白(ovalbumin,OVA)(由美国sigma公司生产);氢氧化铝(Aluminum hydroxide,AL(OH)3)(由天津化学试剂三厂生产);PDGF-BBSP 免疫组化试剂盒(由北京博奥森生物技术有限公司生产)二抗及DAB显色剂(由北京博奥森生物技术有限公司生产)。彩云JWC-201D型雾化器(由鞍山市同信医用仪器厂生产);BH-2型光学显微镜(由日本Olympus公司生产);LY-WN-HP SUPER CCD万能视频成像装置(由成都励扬精密机电有限公司生产);BI-2000医学图像分析系统(由成都泰盟科技公司提供)。
1.2 制备动物模型 将40只大鼠随机分为对照组(control group,C组)、模型组(non-intervention group,N组)、早期干预组(early-intervention group,E组)和晚期干预组(late-intervention group,L组),每组各10只。实验于第1、8天,E组、L组和N组每只大鼠腹腔注射10%卵白蛋白抗原混悬液(内含生理盐水加卵蛋白100mg,氢氧化铝干粉100mg)1ml致敏;C组腹腔注射等量的生理盐水;第15天,E组、L组和N组开始用1%卵白蛋白超声雾化吸入诱导哮喘发作,1次/d,20min/次,共8周;C组用生理盐水雾化吸入,1次/d,20min/次,共8周。其中,E组每只大鼠在每次雾化前1h腹腔注射地塞米松0.5mg/kg;从雾化第15天始,L组每只大鼠在每次雾化前1h腹腔注射地塞米松0.5mg/kg;C组用生理盐水代替,注射剂量相同。以出现点头运动、呼吸急促、腹肌收缩、两便失禁为哮喘发作标志[5-6]。
1.3 标本制备 每只大鼠在末次雾化后的24h内用25%乌拉坦0.4ml/100g腹腔注射麻醉,开胸取右肺中叶,4%多聚甲醛溶液中固定1周,常规石蜡包埋,切片,分别做HE染色及免疫组化染色。
1.4 图像分析
1.4.1 HE染色切片上100倍光镜下选择完整支气管横断面测量支气管基底膜周径(Pbm)、支气管总面积(At)、管腔面积(Ac)、平滑肌外缘内气管面积(AMe)、平滑肌内缘内气管面积(AMi)。计算公式:支气管壁厚度=(At-Ac)/Pbm;平滑肌厚度=(AMe-AMi)/Pbm;衡量气道重塑程度[7]。
1.4.2 测定PDGF-BB表达区平均光密度值 高倍镜下,每张免疫组化切片取5个视野,测定每个视野阳性表达区的平均光密度值,取其均值为PDGF-BB的相对含量。
1.5 统计分析 采用SPSS16.0专用统计软件,多组间比较采用方差分析,多组间两两比较采用LSD-t法,两个变量间的关系采用线性相关分析,结果以均数±标准差(±s)表示,P<0.05为有统计学意义。
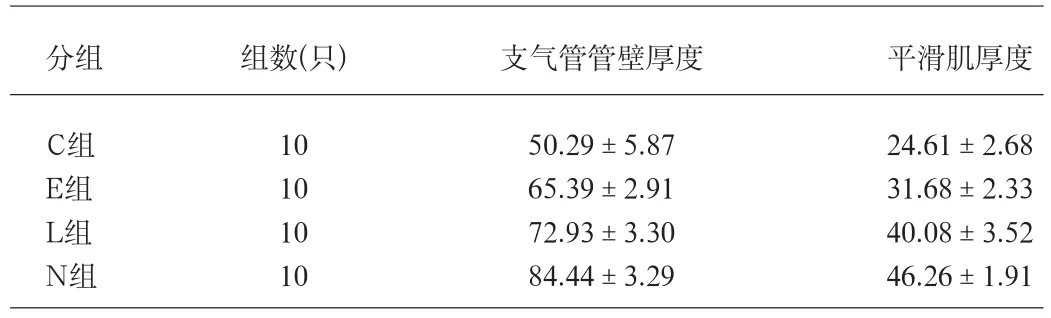
表1 各组大鼠支气管管壁厚度和平滑肌厚度(um)

表2 各组大鼠肺组织中PDGF-BB表达区的平均光密度值
2 结果
2.1 肺组织病理学改变 光镜下观察N组大鼠气道壁及气道平滑肌明显的增厚,黏膜皱褶增多,黏膜下层增宽,管腔狭窄,有时可见黏液栓堵塞,气道上皮细胞脱落,黏膜下及管周有大量的炎性细胞浸润(以嗜酸粒细胞和淋巴细胞为主)。E组较上述的病理变化明显减轻。L组的病理变化介于N组、E组之间。C组几乎无上述病理变化。
2.2 各组大鼠支气管管壁厚度和平滑肌厚度测定(见表1)。
2.3 各组大鼠肺组织中PDGF-BB表达的测定(见表2)。
2.4 统计学分析结果
2.4.1 各组大鼠支气管管壁厚度和平滑肌厚度比较 各组大鼠支气管管壁厚度数据方差分析得F=126.88,P<0.01;进一步进行LSD-t法,任何两组间支气管管壁厚度比较,差异均有统计学意义(P<0.05)。同样,各组大鼠支气管平滑肌厚度数据经方差分析得F=125.47,P<0.01;进一步进行LSD-t法,任何两组间支气管平滑肌厚度比较,差异均具有统计学意义(P<0.05)。
2.4.2 各组大鼠肺组织中PDGF-BB表达区的平均光密度的比较 各组大鼠肺组织中PDGF-BB表达区平均光密度数据由方差分析得F=222.10,P<0.01;进一步进行LSD-t法,任何两组间PDGF-BB表达区平均光密度比较,差异均具有统计学意义(P<0.05)。E组低于N组和L组(P<0.05);C组低于E组(P<0.05);L组低于N组(P<0.05)。
2.4.3 各组大鼠PDGF-BB与支气管管壁厚度及平滑肌厚度之间的关联性分析 绘散点图知,PDGF-BB浓度与支气管管壁厚度呈线性趋势,Pearson相关系数r=0.96(t=9.70,P<0.001),表明肺组织中的PDGF-BB浓度与支气管管壁厚度间呈线性正相关;同样,绘散点图知,肺组织中PDGF-BB浓度与平滑肌厚度也呈线性趋势,Pearson相关系数r=0.98(t=13.92,P<0.001),表明肺组织中的PDGF-BB浓度与平滑肌厚度间也呈线性正相关。
3 讨论
气道重塑指发生在大小气道的结构改变,在支气管哮喘中气道结构的改变包括上皮下纤维化,平滑肌增生,腺体增生肥大,新生毛细血管形成和上皮改变。气道改变导致了气道壁增厚从而使得气道变窄,气道高反应,气道壁水肿和黏液分泌增多,被认为是难治性哮喘的重要病理基础。在这些病理过程中,气道平滑肌增生是哮喘气道重塑的一个主要特点[1]。有研究表明,PDGF-BB在肺组织中表达增多,被认为可能与气道重塑和气道平滑肌增生有关。研究还表明PDGF-BB是经STAT通路诱导平滑肌增生[8]。从本实验结果中,我们看到早期干预组、晚期干预组和模型组中气道重塑的程度逐渐加重,而PDGF-BB浓度随着气道重塑程度的加重也呈上升趋势,两者关联分析发现存在线性正相关,由此可见,PDGF-BB与支气管哮喘气道重塑有着密切的关系。哮喘治疗的首选药物为糖皮质激素[9]。在本实验中,应用地塞米松干预后,早期干预组气道重塑程度较模型组明显减轻,而晚期干预组介于两者之间,其可能是通过下调了PDGF-BB而起作用,也表明早期使用糖皮质激素可以延缓气道重塑的过程,但不能逆转。该实验提示,临床哮喘患者应早期诊断和早期使用糖皮质激素。另外,使用PDGF-BB拮抗剂可能延缓气道重塑,但这一观点尚需进一步大量的临床实验研究来证实。
[1]Ce line Bergeron1,Wisam Al-Ramli,Qutayba Hamid.Remodeling in Asthma[J].Proc Am Thorac Soc,2009,6:301-305.
[2]彭海兵,王献华.PDGF调节因子及其信号转导通路与肺纤维化[J].Modern Preventive Medicine,2008,35:24.
[3]Linda Fredriksson,Hong Li,Ulf Eriksson.The PDGF family:four gene products form five dimeric isoforms[J].Cytokine & Growth Factor Reviews,2004,15:197-204.
[4]钟南山.支气管哮喘[M].北京:人民卫生出版社,2006:8.
[5]Salmon M,Walsh DA,Koto H,et al.Repeated allergen exposure of sensitized Brown Norway rats induces airway cel I DNA synthesis and remodeling[J].Eur R,espir J,1999,14(3):633-641.
[6]Palmans E,Kips JC,Pauwels R A.Prolonged AIlergen Exposure Induces Structural Airway Changes in Sensitized rats[J].Am J Respir Crit Care Med,2000,161(2):627-635.
[7]王传夏,李昌崇,罗运春,等.支气管哮喘大鼠气道重塑中肺泡巨噬细胞的作用[J].中华结核和呼吸杂志,2006,29(11):740-743.
[8]Marina C.Simeone-Penney,Mariano Severgnini,Lilliana Rozo,et al.PDGF-induced human airway smooth muscle cell proliferation requires STAT3 and the small GTPase Rac1[J].Am J Physiol Lung Cell Mol Physiol, 2008,294:698-704.
[9]Sum Yee Leung,MD,Paul Eynott,et al.Effects of ciclesonide and fluticasone propionate on allergen-induced airwayinflammation and remodeling features[J].Allergy Clin Immunol,2005,115:989-996.
