机器人辅助导管插入系统技术进展
2010-08-08作者陈大国沈杰言勇华
【作者】陈大国,沈杰 ,言勇华
1 上海交通大学机器人研究所,上海,200240
2 解放军第四五五医院,上海,200052
近年来,微创手术(Minimally Invasive Surgery,MIS)由于其手术操作相对简单、伤口小、患者痛苦小、术后恢复快和风险较小的特点迅速为医生、病人所接受。微创手术有一种重要的应用,用针头在皮肤(一般为股动脉处)上穿刺后,将导丝插入血管,在图像引导下进给到指定位置,再将导管沿导丝送入,接着抽出导丝。这个过程称为导管插入(简称插管),其中最重要的步骤为将导丝在图像引导下进给到指定位置。插管操作有多种用途,如肝癌的微创疗法——经导管肝动脉化疗栓塞(Transcatheter Arterial ChemoEmbolization , TACE),是将导管送至肝脏癌变部位的血管附近,再将化疗药物或栓塞剂通过导管内腔送到病灶附近。目前实施方法是医生在图像引导下手动操作,但这种操作主要有以下几个不足:
(1) 插管操作过程中需要X射线成像,使术者受到辐射的危害;
(2) 插管操作过程中没有导管三维位置信息,仅凭术者的经验和解剖学知识,操作是试探性的,使手术时间较长,辐射累积伤害较大;
(3) 人工插管操作准确度低,有时很难或无法将导管精确定位到病灶,使得治疗效果欠佳。
机器人辅助插管系统能较好地解决这些问题。利用远程操作技术并加入力检测与力反馈装置,可实现术者在手术室外或更远距离对手术室内的执行装置进行控制,并仍能感受力的信息。同时,也能缩短手术时间,减少术者和病人的辐射剂量。利用虚拟/增强现实技术将术前的病灶三维模型和术中的二维图像进行图像匹配、融合,提供三维图像导航信息给术者,使其操作更加精确。此外,利用机械执行装置的高精度复现术者的操作,将导管准确送到病灶处,可改善疗效。机器人辅助插管系统根据导管的不同而有较大的差别,分为主动和被动两类。主动导管头部有附加自由度,且一般直径较大而中空,可输送液体,多采用复杂的控制系统[1,2]。被动导管由导丝和套管组成,仅能从末端控制。当前国内医院进行此类手术时多采用被动导管,故本文仅讨论后者。
目前对于机器人辅助插管系统尚无普遍认可的定义,但至少包含以下内容:一个主从控制的或自动控制的机电装置,在两维或三维图像的引导下,以较高精度将导管送至指定的位置,在这过程中能实时反馈导管的位置以及导管所受的力。
1 系统组成
根据前面的定义,一个典型的机器人辅助插管系统结构如图1 所示。

图1 系统结构图Fig.1 System structure
它至少应当包括以下部分:(1)导丝进给、检测装置;(2)力反馈装置;(3)成像设备及图像处理装置;(4)监控及显示设备;(5)计算机。
系统分为放射室内和放射室外两部分,使用网络进行通信。放射室内布置了成像、监控设备及导丝进给和检测装置,从控计算机起总体控制作用;放射室外布置了显示设备和导丝检测装置,主控计算机进行统筹。前面三部分将在后面详细讨论,监控设备用于医生在手术过程中保证患者安全,包括视频监控、记录心跳、血压等参数的装置;计算机用于处理检测数据,进行图像处理,控制进给装置等。
2 监控的检测与显示
2.1 导丝进给、检测
导丝要能在分支复杂、形状多变的血管里运动,至少需要两个自由度:沿血管进退以进入、退出血管,绕自身旋转以在分支处找准要进入的血管。
导丝的头部是弯曲的,进入分支血管的方式,是转动导丝使导丝头部弯曲方向对准目标血管,再将导丝往前送,这两个自由度通常由同一个装置实现。进退运动的实现的基本方式是利用摩擦力,用电机驱动滚轮使导丝运动。Ikuta等人提出了多种驱动方式,如摩擦轮驱动[3],差动齿轮驱动[4]和无干涉球型驱动[5]等。不过,它们与所有利用滚动摩擦的机构一样,有一个共同的缺点:当接触表面摩擦系数下降时,会产生打滑。F.Arai与T.Fukuda等人提出了一种称为线性步进机构(Linear Stepping Mechanism)的装置,它的原理与自动铅笔相似[6]。这种机构利用锁死来改善摩擦力的影响,但也有其固有的缺陷,它推进导丝的速度较慢,并且步进的距离是固定的,不能准确到达指定位置。旋转运动一般由将实现进退运动的机构进行绕其轴旋转实现,或者反过来将实现旋转运动的机构整体做成可沿轴线运动的形式。这两种结构体积较大,在实际应用中价值不大。
实现远程操作需要检测主动端(术者操作部分)的导丝的旋转、进退量。在从动端(病人受控部分)进行闭环控制时,也需要检测实际的运动量。当前用来检测导丝运动量的手段主要为编码器。Y.Thakur等人提出的系统中使用编码器来检测线性和旋转两个运动量,最小分辨率分别为0.02 mm和0.18°[7]。在后续研究中,将会使用光学传感器作为检测运动量的手段,可大大减小检测机构的体积和复杂程度。
2.2 力反馈
由于血管形状的复杂性和血液的粘性等原因,导丝在血管内运动时会受到阻力。这些阻力主要有1)导丝头部与血管壁的接触力,2)导丝在整个长度上与血管壁的摩擦力, 3)血液对导丝的粘性阻力等。检测这些力并提供给术者,不仅可以帮助操作者判断导丝的位置和状态,决定下一步是前进、后退还是旋转,更重要的是限制了力的大小,保护病人不受伤害。
前面提到的三种力中,其中力3)相对前两种力很小,此处不作讨论。而当力1)出现时,导丝头部与血管相抵触使其暂时卡住,当阻力突然消失时会造成导丝前冲,有可能损伤血管。力2)是正常情况下导丝前进需要克服的阻力。力1)和力2)都通过导丝传递到操作者的手上,操作者无法区分它们,因此有必要分别检测这两种力。关于触觉传感器的布置形式,有附加在导丝上和安装在夹持导丝的手腕上两种。J.Jayender 等人曾报道过,在他们使用的7自由度东芝机器人的手腕上安装6维力/力矩传感器,检测插丝过程中力和力矩[8]。
安装在导丝上的力传感器,根据所应用的物理原理,大致分为压电效应[9]、应力应变[10]和光学原理[11]三种。压电效应中使用最多的材料是聚偏氟乙烯(PVDF),基本原理是PVDF受到载荷时(压力),薄膜的两侧积聚电荷形成电压,电压与压力大小有关。在制作完成传感器并标定后,测量的电压即可知压力[12]。导丝上的传感器,包括头部的传感器和导丝壁的感器,检测力时都不需要准确获得力的方向。这一方面是因为根据经验,在插丝操作中导丝的运动并不能准确地响应医生的操作,只要知道阻力的存在及其大小,就能判断下一步该执行什么样的操作(旋转,进退);另一方面,由于血管的复杂性和柔性,要测量力的方向也比较复杂。
2.3 成像及图像处理
传统的开放式手术操作者可看到手术区域,可做到相当程度的手眼协调。而在微创手术中,操作者通常看不到手术区域或视野比较狭窄,因此必须借助于其他方法。目前,常用医学成像方法用作图像导航手段,如超声波、X射线(包括计算机断层扫描CT,数字减影血管造影DSA等)及MRI等[13]。
超声波(Ultrasound)成像是靠人体组织弹性和密度的不同对超声波的反射也不同原理成像的,对病人的损伤小,比较安全,常用于心脏、腹部成像[14,15]。X射线成像的原理是人体不同组织对X射线的吸收不同,常用于检测肿瘤。数字减影血管造影(Digital Subtraction Angiography, DSA)是往目标区域的血管里注入造影剂,将造影前后的图像相减,可得到清晰的二维血管图像,是经血管栓塞、化疗的重要手段[16];磁共振成像(Magnetic Resonance Imaging, MRI)是通过探测人体组织的原子与电磁波的共振幅度获得组织的信息的,常用于检查脑肿瘤、关节病变等。磁共振成像用于微创介入手术具有安全和病人损伤小等特点,不过由于铁磁性物体会对成像效果有很大影响,微创介入器械必须由非铁磁性材料制成[17]。在实际的微创介入手术中,经常使用多种成像手段,用信息融合加以处理以获得更好的效果,如R.Fahrig等人报道用X射线/MR混合成像,作为介入手术导航方法[18]。
在微创介入手术中,为获得导管/导丝头部的环境情况,发展了多种特殊的图像导航方法。例如,在治疗心房颤动消融(Atrial Fibrillation Ablation)中,M.P.Fronheiser等人提出了在电消融导管头顶部及四周安装小型超声波传送阵列,探测心房内部空间[19];在C.Pappone等人报道了Stereotaxis公司的Niobe系统,采用磁场来控制导管头,因而也可以得到导管头的准确位置信息。不过,他们仍需要使用CT或MRI技术获得体内组织的信息,才能获得导管相对人体的位置[20]。
在微创手术的图像导航中,如果使用普通的CT、DSA或超声波成像,只能得到治疗区域的二维图像,深度信息的丢失会降低手术的准确率,延长手术时间。目前的解决方案大致有两种。一种是使用可获得三维图像的成像技术,如三维超声波成像,虽然实时性较好,但其空间分辨率低,不适合用于精细操作[21];又如螺旋CT和MRI,虽然能得到高质量的三维图像,但数据处理花费的时间较长,不适合实时性要求较高的图像导航。另一种方法是术前通过螺旋CT或MRI,获得手术区域的高分辨率的三维图像,又在手术过程中,通过DSA或X射线机获得实时高分辨率二维图像,然后通过图像配准等方法得到手术器械在体内的位置。这种方法涉及二、三维图像匹配、图像融合及虚拟现实技术,是当前研究的热点[22,23]。
3 插管系统介绍
目前已比较成熟的插管系统多为主动导管系统。Hansen Medical公司的产品Sensei控制台和Artisan插管装置,医生操作布置在手术室外,其控制台上有三维操纵杆,控制台的屏幕可显示实时的X射线和超声波图像,并通过3D可视化模块Cohesion实时显示心脏及导管的三维图像[24];插管装置在手术室内,控制SMA主动导管执行动作。Stereotaxis公司的Niobe系统,由布置在手术台两侧的位于保护罩内的可俯仰、旋转运动的强永磁体,在手术室外的远程控制、显示台,以及布置在手术台一侧的插管机构组成。它的头部带有磁环的专用导管,通过旋转、俯仰永磁体来控制方向,由导轮控制进或退[25]。国内哈尔滨工业大学对主动导管使用的形状记忆合金(SMA)[26]和机器人辅助穿刺等[27],也有研究的报道。此外,清华大学、北京航空航天大学等高校在微创机器人上也有相关的研究。

图2 插管机构Fig.2 Device for insert catheter
被动导管系统相对主动导管系统来说比较少,发展也欠成熟。Corindus公司的CorPath系统,由安装在手术台旁边的插丝机构(图2)和布置在与手术台不远处的有较好防护的控制台组成。它的插丝机构在控制台上的操纵杆的控制下,实现与人工插管类似的前进、后退或旋转操作。使用操纵杆可实现连续运动,在距离目标点较远时使用;点按控制台的触摸屏上的按钮,可实现微小的步进运动,用于目标点附近的微调[28]。
Y.Thakur等人提出了一种与现有的插管手术类似的系统[7]、[29]。该系统有一个称为导管传感器(Catheter Sensor)的装置,用来检测术者对导管的旋转、进退操作;另外有一个导管操纵(Catheter Manipulator)的装置,可复现导管传感器检测到的动作(图3)。这个系统的特点是不需要特殊的导管,操作方式与当前常用的手动操作导管相似,可以充分利用介入医生的熟练技术。该装置也可以作为训练工具培养新医生。当前国内进行此类介入手术的医院多采用此种方法,不过该系统并没有提供力反馈。Y.Thakur认为导管的柔性变形会将力储存起来,不会造成破坏性影响。但是在不知道导管的弯曲情况下能感受到阻力,会让介入医生操作更加谨慎,如放慢速度,操作导管旋转、后退等。这些都是当前医生所具有的经验,不应当抛弃。
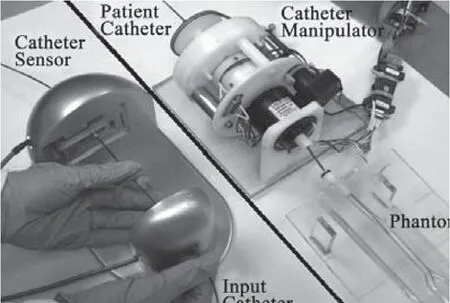
图3 导管传感器与导管操纵器Fig.3 Catheter Sensor and Catheter Manipulator
4 结论
微创介入手术由于其多种优点迅速被人们所接受,但手动进行介入手术有效率低、对操作者有损伤等缺点,而且随着手术例数的增多,介入操作者的辐射累积损伤较为严重,限制了微创介入手术的发展。利用机器人辅助插管,在解决一系列关键技术后,可以提高手术效率,降低辐射损伤,具有光明的前景。
机器人辅助插管系统的发展方向,主要有以下几个方面:
(1) 三维图像导航软件。提供基于虚拟/增强现实的术前规划、术中导航的图形用户接口(GUI),实现多种成像设备的支持,使得医院在使用机器人辅助插管装置时可利用已有的设备。
(2) 插管机构的小型化、模块化。应当巧妙设计机械、电气结构,使得装置便于安装、拆卸以及消毒等。
(3) 插管的智能化、自动化、远程化。解决手术的自动规划、过程控制的时延以及设备的可靠性的关键技术,提高治疗效率。远程医疗和实现插管自动化将使医疗资源让更多的人受惠。
[1]Saliba W, Cummings JE, Oh S,et al.Novel robotic catheter remote control system: feasibility and safety of transseptal puncture and endocardial catheter navigation[J].J Cardiovasc Electr, 2006, 17(10):1102-1105.
[2]Faddis MN, Chen J, Osborn J,et al.Magnetic guidance system for cardiac electrophysiology-a prospective trial of safety and efficacy in humans[J].Journel of the American College of Cardiology, 2003, 42(11): 1952-1958.
[3]Ernst S, Ouyang F, Linder C,et al.Initial experience with remote catheter ablation using a novel magnetic navigation system-magnetic remotecatheter ablation[J].Circulation, 2004(109): 1472-1475.
[4]Koji I, Masaki T, Takao N.Virtual endoscope system with force sensation[J].Proceedings of the 1999 IEEE International Conference on Robotics & Automation, 1999, 3: 1716-1721.
[5]WANG J, GUO S, KONDO H,et al.A novel catheter operating syatem with force feedback for medical applications[J].International Journal of Information Acquisition, 2008, 5(1): 83-92.
[6]`Arai F, Fuji R, Fukuda T.New catheter driving method using linear stepping mechanism for iIntravascular neurosurgery[A].Proceedings of the 2002 IEEE lntematinal Conference on Robotics & Automation, 2002, 3:2944-2949.
[7]Yogesh T, Jason H.C, David W.H,et al.A device for real-time measurement of catheter-motion and input to a catheter navigation system[J].Progress in biomedical optics and imaging , 2007, 6509(part 1).
[8]Jayender J, Azizian M, Patel RV.autonomous image-guided robot-assisted active catheter insertion[J].IEEE transactions onrobotics, 2008, 24(4):858-871.
[9]Javad D, Sedaghatia R, H.S,et al.Modeling and testing of an endoscopic piezoelectric-based tactile sensor[J].Mechatronics , 2007, 17(8): 462-467.
[10]Mami T, Takashi I, Yoshikatsu T,et al.Development of a 3D tactile sensor[J].J Mater Process Tech, 2007, 181: 286-290.
[11]Jan P, Joeri C, Dominiek R,et al.A micro optical force sensor for force feedback during minimally invasive robotic surgery[J].Sensors and Actuators, 2004, 115: 447-455.
[12]Weixing F, Shuxiang G, Changmin C,et al.Realization of a catheter driving mechanism with micro tactile sensor for intravascular neurosurgery[A].Proceedings of the 2006 IEEE International Conference on Robotics and Biomimetics[C], 2006: 1628-1633.
[13]Lei X, Brian T, Eduard S,et al.Overview of image-guided radiation therapy[J].Medical Dosimetry, 2006, 31(2): 91-112.
[14]Wang AS, Narayan G, Kao D,et al.An Evaluation of using real-time volumetric display of 3D ultrasound data for intracardiac Catheter Manipulation Tasks[A].Volume Graphics 2005 Eurographics/IEEE VGTC Workshop Proceedings[C], 2005: 41-45.
[15]Chris J.D.Thermal ablation and high-temperature thermal therapy-Overview of technology and clinical implementation[J].International journal of hyperthermia , 2005, 21(8): 745-753.
[16]Milickovic NB, Baltas D, Giannouli S,et al.Automatic reconstruction of catheters in CT based bracytherapy treatment Planning[A].Proceedings of the 22nd Annual EMBS International Conference[C], 2000: 2870-2874.
[17]Michael B, Frank K.W.MR-guided intravascular interventions- Techniques and applications[J].J Magn Reson Imaging, 2008, 27(2): 326-338.
[18]Rebecca F, Arundhuti G, Prasheel L,et al.Design, performance, and applications of a hybrid X-ray MR system for interventional guidance[J].Proceedings of the IEEE , 2008, 96(3): 468-480.
[19]Matthew P.F, Edward D.L, Salim F.I,et al.Real-time, 3-D ultrasound with multiple transducer arrays[J].IEEE Transactions on Ultrasonics,Ferroelectrics, and Frequency Control, 2006, 53(1): 100-105.
[20]Carlo P, Giuseppe A, Filippo G,et al.Robotic and magnetic navigation for atrial fibrillation ablation[J].How and why[J], 2007: 885-894.
[21]Lin Y, Bogdan G, Yefeng Z,et al.3D ultrasound tracking of the left ventricle using one-step forward prediction and data fusion of collaborative trackers[J].26th IEEE Conference on Computer Vision and Pattern Recognition, 2008.
[22]H.M.C, Albert C.S.C, Simon C.H.Y,et al.2D-3D vascular registration between digital subtraction angiographic (DSA) and magnetic resonance angiographic (MRA) images[A].2nd IEEE International Symposium on Biomedical Imaging: Macro to Nano[C], 2004, 1: 708-711.
[23]Hasegawa S, Wang H, Wei D.An efficient algorithm for real-time catheter Tip detection in a virtual reality of electrophysiology study[A].Proceedings of The Sixth IEEE International Conference on Computer and Information Technology[C], 2006: 126-131.
[24]Reddy VY, Petr N, Zachary J.M.View-synchronized robotic imageguided therapy for atrial fibrillation ablation; experimental validation and clinical feasibility[J].Circulation, 2007, 115(21): 2714-2754.
[25]Mark S.P, Jeroen S, Carlos Van M,et al.Magnetic Navigation in Percutaneous Coronary Intervention[J].Journal of Interventional Cardiology, 2006, 19(6): 558-565.
[26]付宜利, 李显凌, 梁兆光.基于形状记忆合金的自主导管导向机器人设计[J].机械工程学报, 2008, 44(9): 76-82.
[27]修雯雯,杜志江.机器人辅助经皮穿刺手术系统发展概况[J].中国医疗器械杂志, 2007, 31(5): 362-366.
[28]Rafael B, Luis G, Dan D,et al.Remote-Control Percutaneous coronary interventions: concept, validation, and first-in-humans pilot clinical Trial[J].J Am Coll Cardiol, 2006, 47(2): 296-300.
[29]Yogesh T, Jeffrey S.B, David W.H,et al.Design and performance evaluation of a remote catheter navigation system[J].Ieee T Bio-Med Eng,2009,56(7):1901-1908
