3株猪Ⅱ型圆环病毒的分离及基因组序列分析
2010-08-07刘业兵孙跃辉薛青红宁宜宝黄金海
刘业兵,孙跃辉,张 磊,薛青红,宁宜宝*,黄金海
(1.中国兽医药品监察所,北京100081;2.天津大学,天津300072)
猪圆环病毒Ⅱ型(Porcine circovirus-Ⅱ,PCV2)为猪断奶后多系统衰竭综合征(Postweaning multi-systemic wasting syndrome,PMWS)的主要病原,1991年在加拿大首次被证实,随后在美洲、欧洲的许多国家和亚洲的一些国家和地区均有报道[1-3]。临床上PCV2常与细小病毒、伪狂犬病毒等混合感染,加重和促进了PMWS疾病的发生。PCV2又是引起猪的繁殖障碍、皮炎与肾病综合征和幼龄猪的先天性震颤等疾病的重要致病因子[4],已成为影响养猪业发展的重要传染病病原之一。
近年来,对PCV2遗传变异情况的报道不断增多,PCV2基因组多为 1 767 nt或1 768 nt[5-9],而Dupont等报道了基因组为1 766 nt的新病毒株[7-10]。为了解混合感染中PCV2的遗传变异特性,本研究对2009年由与高致病性猪繁殖与呼吸综合征病毒(PRRSV)混合感染病例中分离到的3株PCV2进行了全基因组序列测定及遗传分析,旨在为开展疫病的分子流行病学和疫病控制等研究奠定基础。
1 材料和方法
1.1 试剂及细胞株TaqDNA聚合酶购自NEB公司;dNTPs、DL2000 DNA Marker购自宝生物工程(大连)有限公司;DNA提取试剂盒购自天根生化科技(北京)有限公司;胶回收试剂盒购自promega公司;PCV阴性PK15细胞为本研究室保存;MEM、新生牛血清购自Hyclone公司;兔抗猪IgG-FITC、D-Glucosamine购自sigma公司;特异性抗PCV2抗血清购自VMRD公司。
1.2 引物的设计与合成 根据GenBank中PCV2核苷酸全序列(AF055391)和PCV1核苷酸全序列(NC_001792),利用DNAMAN和Oligo6.0设计3对PCV2的特异性引物(表1),引物A扩增176 bp的片段,引物B扩增1 370 bp的片段,引物C扩增420 bp的片段。用于PCV2的检测和全序列的扩增,由Invitrogen公司合成。

表1 PCV2全基因组扩增引物序列Table 1 Primers of PCV2 complete genome amplified
1.3 病料及PCR检测 采自2009年山东、湖北和湖南规模化猪场具有呼吸系统衰竭综合征临床症状的临死猪及剖检有病变的猪淋巴结、肺脏和脾脏组织,在完成高致病性PRRSV的分离鉴定的同时(另文报道),用C引物对病料样品提取的DNA进行PCR扩增,预计为约420 bp的片段;PCR反应体系为 50 μL,反应条件为:94℃ 4 min;94℃ 45 s、49℃45 s、72℃ 45 s,30个循环;72℃10 min。
1.4 病毒的分离及鉴定 取PCR检测为PCV2阳性的组织病料样品,按1∶10(W/V)加入MEM培养液,将组织研磨后,冻融3次、离心取上清液,过滤除菌。通过用D-氨基葡萄糖处理PK15细胞促进PCV2繁殖和分离[11]。按照文献[12]方法用间接免疫荧光方法对分离的病毒进行鉴定。
1.5 全基因组序列的测定与分析 利用设计的3对引物,以上述细胞培养物提取的DNA为模板进行PCR扩增。扩增条件按1.3方法。PCR产物经1%琼脂糖凝胶电泳后于紫外光线下检测。切胶回收目的条带,回收的DNA由Invitrogen公司测序。采用DNAStar软件进行同源性比较并生成遗传进化树。
2 结果与讨论
2.1 样品PCR检测结果 采自山东、湖北和湖南地区3份病料样品中均扩增出约为420 bp的目的条带,与预期结果相符合,表明PCV2检测为阳性。
2.2 荧光染色鉴定结果 在3个细胞培养物中均观察到典型的特异性亮绿色荧光,而阴性对照、空白对照的细胞无特异性绿色荧光,将分离的PCV2分别命名为HUN-09株、SD-09株和HUB-09株。
2.3 PCV2细胞培养物全基因组的扩增 以病毒细胞培养物中提取的DNA为模板,利用3对PCV2特异性引物扩增出大小分别约为180 bp、400 bp和1 400 bp的目的条带,与预期结果相符合(图1)。

2.4 序列测定与分析 用DNAStar对序列进行拼接和分析表明,分离得到的3株PCV2全基因组序列均为1768bp,已录入GenBank中,登录号分别为GQ449670、GQ449669、GQ449671。
序列同源性比较表明:3个PCV2分离株与PCV1分离株之间的全基因同源性在70%左右,16个PCV2株间的同源性为95%~99.7%,本次分离的3个2009年病毒株之间的同源性为97.6%~98.5%。进一步分析结果表明HUB-09株与EU921255(北京)亲缘关系最近,同源性高达99%;HUN-09株与FJ644559(江苏)亲缘关系最近,同源性高达99.3%;SD-09株与AY484407(Netherlands株)亲缘关系最近,同源性高达98%;3个毒株与AF086834(Canada株)亲缘关系最远,同源性为95%左右(图2)。

进化树关系表明,PCV被分为PCV1和PCV2两大分支,PCV2又有2个基因型PCV-2a和PCV-2b。本研究分离的3株PCV2均属于基因型PCV-2a(图 3)。
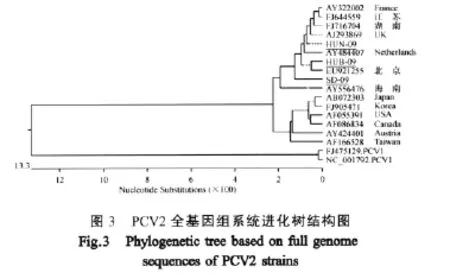
目前,对国内外PCV2分子流行病学分析结果表明,PCV2基因型发生了由PCV-2a到PCV-2b的转换,以PCV-2b流行毒株为主[7,13]。但是,本研究通过PCR检测、免疫荧光鉴定显示,2009年从湖南、山东、湖北所分离到的3株PCV2均属于基因型PCV-2a,毒株之间序列差异不大,而且均分离自感染高致病性PRRSV的猪体组织,基因型PCV-2a的毒株在高致病性PRRSV的感染与免疫中起到何种作用,有待进一步研究。
由本实验室从3个省分离的PCV2结果结合国内其他报道[13]显示,PCV2两种基因型同时存在,致使目前国内猪圆环病毒病的流行正日趋复杂化。近年报道的PRRSV在临床上致病作用不断增强,或许与PCV2的混合感染等情况密切有关。PCV2全基因组的获得,为开展ORFs的功能研究、探究其毒力和免疫原性及PCV2在混合感染中的作用等研究工作奠定了基础。
[1]Allan G M,McNeilly E,Kennedy S,et al.PCV-2-associated PDNS in Northern Ireland in 1990[J].Vet Rec,2000,146(24):711-712.
[2]Mankertz A,Domingo M,Folch J M,et al.Characterisation of PCV-2 isolates from Spain,Germany and France[J].Virus Res,2000,66(1):65-77.
[3]Onuki A,Abe K,Togashi K,et al.Detection of porcine circovirus from lesions of a pig with wasting disease in Japan[J].J Vet Med Sci,1999,61(10):1119-1123.
[4]Kennedy S,Allan G,McNeilly F,et al.Procine circovirus infection in Northern Ireland[J].Vet Rec,1998,142:495-496
[5]刘新文,曹胜波,郭东春,等.猪Ⅱ型圆环病毒(PCV2)Henan株的分离与全基因组序列分析[J].中国预防兽医学报,2006,26(4):357-359.
[6]Wen L B,Xin G,Yang H C.Genotyping of porcine circovirus type 2 from a variety of clinical conditions in China[J].Vet Microbiol,2005,110:141-146.
[7]Dupont K,Nielsen E O,Bakbo P,et al.Genetic analysis of PCV2 isolates from Danish archives and a current PMWS case-control study supports a shift in genotypes with time[J].Vet Microbiol,2008,128:56-64.
[8]Choi K S,Chae J S.Genetic characterization of porcine circovirus type 2 in Republic of Korea[J].Res Vet Sci,2008,84:497-501.
[9]Olvera A,Cortey M,Segales J.Molecular evolution of porcine circovirus type 2 genomes:Phylogeny and clonality[J].Virology,2007,357:175-185.
[10]Shang S B,Jin Y L,Jiang X T,et al.Fine mapping of antigenic epitopes on capsid proteins of porcine circovirus and antigenic phenotype of porcine circovirus type 2[J].Mol Immunol,2009,46(3):327-334.
[11]Tischer I,Peters D,Rasch R,et al.Replication of porcine circovirus:induction by glucosamine and cell cycle dependence[J].Arch Virol,1987,96(1-2):39-57.
[12]郎洪武,王力,张广川,等.猪圆环病毒分离鉴定及猪断奶多系统衰竭综合征的诊断[J].中国兽医科技,2001,31(3):3-5.
[13]郭龙军,陆月华.我国部分地区猪圆环病毒2型分离株的遗传变异分析[J].中国预防兽医学报,2009,31(11):856-859.
