牛乳溶菌酶在毕赤酵母中的分泌表达及活性分析
2010-08-07付世新齐长学罗春海
付世新,齐长学,罗春海,张 丽,王 瑶
(黑龙江八一农垦大学动物科技学院,黑龙江大庆163319)
溶菌酶(lysozyme)作为天然非特异性抗菌物质,广泛分布于植物、动物和微生物中[1]。普遍存在于哺乳动物的泪液、唾液、血浆、乳汁、体液、组织细胞内以及胎盘中。不仅具有杀菌作用,还具有增强免疫力、减缓炎症[2]、促进组织修复[3]等多种功能。溶菌酶在细菌性疾病的防治过程中取得了较好的预防和治疗效果,与抗生素相比显示出疗效高、无毒副作用、不产生耐药性等优势,成为研发抗生素替代制剂的热点。
牛乳溶菌酶(LYZ1)作为c型溶菌酶中的一种,在治疗奶牛子宫内膜炎、乳房炎等细菌性疾病中不仅具有相似的生物学作用,还具有同源性的优势。因此,本研究通过毕赤酵母GS115分泌表达系统获得了重组牛乳溶菌酶,与溶菌酶天然提取方法相比,克服其产量低、质量不稳定和成本高等缺点,为溶菌酶的规模化生产奠定了基础。
1 材料和方法
1.1 菌株与质粒 质粒pPICZα-A与毕赤酵母菌株GS115购自Invitrogen公司;实验用金黄色葡萄球菌ATCC6538、大肠埃希菌ATCC8099等标准菌株购自中国微生物菌种保藏管理委员会普通微生物中心;无乳链球菌C55901、停乳链球菌C55935等标准菌株购自中国兽医药品监察所;乳房链球菌021-51082219购于北京早稻田生物科技发展有限公司;溶壁微球菌ATCC 4698购于Sigma公司。
1.2 主要试剂 T4 DNA连接酶、EcoRⅠ、XbaⅠ、蛋白Marker购自TaKaRa公司;牛乳溶菌酶重组蛋白的单因子血清;山羊抗小鼠二抗为Promega公司产品;Zeocin为Invitrogen公司产品;人溶菌酶标品购自Merck公司;溶壁微球菌购于Sigma公司;His Trap FF粗提柱购于GE Healthcare公司。
1.3 目的序列的改造与引物合成 根据GenBank中登录的LYZ1基因序列(NM-001077829)去除LYZ1基因前段18个氨基酸的信号肽,并按照毕赤酵母的偏爱密码子改造目的序列。在不改变其氨基酸序列的前提下,更换为酵母偏爱密码子共16个。人工合成的目的序列包含编码溶菌酶130个氨基酸的基因全长序列(390 bp),以及在目的序列前端添加限制性内切酶EcoRⅠ的酶切位点和编码组氨酸标签(His-tag)的6个氨基酸的18 bp,在目的序列末端添加了终止密码子和限制性内切酶XbaⅠ的酶切位点,全长423 bp。并连接到pBluescriptⅡSK(+)质粒中,命名为pBS-LYZI。
pPICZα-A载体通用引物(5'AOX1:5'-GACTGG TTCCAATTGACAAGC-3'和 3'AOX1:5'-GCAAAT GGCATTCTGACATCC-3')、目的片段改造引物(RP1:5'-CTGAATTCCATCATCATCATCATCATAAG-3'和RP2:5'-TCTAGACTCGAGTTAAACACGGCAAC-3')改造的目的基因序列及以上引物均由上海生工生物工程技术服务有限公司合成。
1.4 目的基因的克隆 以RP1、RP2为引物,以pBS-LYZ1为模版,对目的序列进行扩增,扩增条件为:94℃ 5 min;94℃ 50 s、50℃ 50 s、72℃50 s,共30个循环;72℃10 min。将扩增序列连接到pMD18-T载体上,测序。
1.5 重组表达质粒pPICZα-A-LYZ1的构建 利用限制性内切酶EcoRⅠ和XhaⅠ对载体pMD18-TLYZ1和酵母载体pPICZα-A进行双酶切,利用T4连接酶将胶回收目的片段和载体片段连接,转化大肠杆菌DH5α中,提取重组质粒经酶切鉴定后测序。
1.6 毕赤酵母的电转化 将经限制性内切酶SacⅠ线性化的重组质粒pPICZα-A-LYZ1与毕赤酵母GS115感受态细胞混匀后加入到预冷的电转杯中,在电压1.8 kV、电容25 μF、电阻200 Ω、电击7.0 ms的电转参数下(以载体pPICZα-A为阴性对照)完成电转化,培养于含Zeocin抗性的YPDS培养基上。
1.7 阳性转化子的筛选与鉴定 在YPDS(Zeocin+)固体培养基上挑起单个菌落,在YPD培养基中扩大培养。以玻璃珠法提取的酵母基因组为模版,采用表达载体pPICZα-A通用引物(5'AOX1、3'AOX1)对转化子进行检测;扩增条件为:94℃5 min;94℃60s、54℃60s、72℃70s,30个循环;72℃10min。
1.8 重组酵母菌的诱导表达 将筛选到的阳性和阴性酵母菌按照1%的比例分别接种于YPD培养基中,30℃、200 r/min振荡培养24 h,按照2%的比例接种到10 mL的BMGY培养基中,30℃、200 r/min振荡培养约20h至OD600nm达到5~6;室温5000r/min离心5 min收集菌体重悬于50 mL(0.5%甲醇、pH5.0)BMMY培养基中进行诱导表达。28℃、200 r/min培养60 h,期间每24 h添加终浓度1%甲醇。60 h后8 000 r/min离心10 min,收集培养液上清。
1.9 重组牛乳溶菌酶LYZ1的western blot检测收集的上清首先采用超滤管浓缩,再用甲醇-氯仿法浓缩,将收集的重组蛋白进行SDS-PAGE电泳;应用半干法转移至PVDF膜上,5%脱脂奶粉4℃封闭过夜,以牛乳溶菌酶重组蛋白的单因子血清为一抗,HRP标记的山羊抗鼠IgG为二抗进行检测。
1.10 重组牛乳溶菌酶LYZ1的纯化与浓度的测定将发酵液上清过滤除菌,采用超滤管将上清2倍浓缩。并按照GE公司的操作手册,用结合缓冲液平衡亲和柱,将浓缩后的酵母上清过柱,用10个柱体积的清洗缓冲液清洗,最后用洗脱缓冲液洗脱带His-tag的目标蛋白,并收集洗脱液。洗脱液4倍稀释后通过SDS-PAGE电泳分析纯化结果,测定洗脱液纯化后目标蛋白的浓度。
1.11 重组牛乳溶菌酶LYZ1的活性检测 参照文献[4]的快速比浊法,用pH6.2的PBS将溶菌酶标准品配成活力为5 000 u/mL、4 000 u/mL、3 000 u/mL、2 000 u/mL、1 000 u/mL的标准液;用pH6.2的PBS将溶壁微球菌重悬至OD490nm为2的悬液。以阴性酵母菌株表达上清为空白对照,将不同浓度的标准液和阳性酵母菌株表达上清各取100 μL加入到酶标板中,之后加入100 μL菌悬液,37℃恒温作用5 min后测其吸光度OD490nm。以标准液活性为纵坐标,吸光度OD490nm平均值为横坐标绘制标准曲线,用线性回归方程y=ax+b表示,并将测出的样品吸光度平均值代入方程得出样品的活性。
1.12 重组牛乳溶菌酶LYZ1的体外溶菌活性检测将重组牛乳溶菌酶酵母表达上清和空载体诱导表达上清分别浓缩50倍,过滤后备用。将适量埃希氏大肠杆菌、金黄色葡萄球菌、无乳链球菌、停乳链球菌、乳房链球菌分别加入灭菌并冷却至40℃~50℃的营养琼脂培养基中,每平皿倒入15 mL培养基,凝固后打孔制成各菌株的固体培养基平板。以空载体表达上清为对照,每孔加入上清50 μL,置37℃培养24 h后,测量抑菌环直径(去除孔直径),计算同一类菌株的平均抑菌直径。
2 结 果
2.1 目的序列的改造 目的序列经改造后,在序列末端添加了XbaⅠ的酶切位点,经双酶切鉴定并测序。结果表明序列与预期相符。
2.2 表达重组质粒的构建与鉴定 构建的重组质粒pPICZα-A-LYZ1用EcoRⅠ、XbaⅠ双酶切后,出现了一条约430 bp的片段,大小与目的序列一致,经测序后表明与预期相符。
2.3 重组酵母菌的鉴定 PCR鉴定结果表明:pPICZα-A转化菌扩增出约600 bp的DNA片段;pPICZα-A-LYZ1转化菌则扩增出约 1 000 bp的DNA片段,与预期大小一致。证明LYZ1基因已经整合到酵母基因组中(图1)。
2.4 诱导表达蛋白LYZ1的SDS-PAGE分析及western blot检测 SDS-PAGE结果显示重组菌pPICZα-A-LYZ1/GS115浓缩上清有一条明显的16 ku左右的蛋白条带,与预期大小一致。经试验筛选目的蛋白高表达重组酵母菌株GS115/pPICZα-A-LYZ1,确定最佳诱导时间为60 h,最佳诱导pH为5.0。重组菌GS115/pPICZα-A-LYZ1浓缩上清的western blot分析显示,有一条16 ku左右的蛋白条带(图2)。
2.5 诱导表达蛋白LYZ1的纯化及其浓度的测定确定最佳清洗缓冲液pH7.0,咪唑浓度为40 mM;洗脱缓冲液pH7.4,咪唑浓度为500 mM。经过His-tag柱子纯化后,能够获得纯度较高的目的蛋白。经测定诱导表达的重组蛋白浓度为218 mg/L。
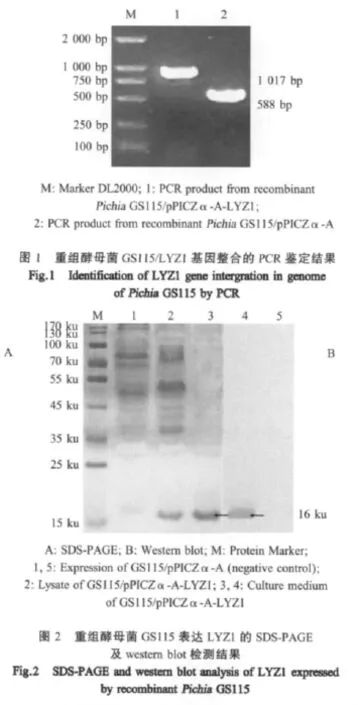
2.6 诱导表达蛋白LYZ1的活性检测 采用酶标仪快速比浊法测定标准曲线,显示溶菌酶活性与吸光度OD490nm的线性回归方程为y=-6 691.5×OD490nm+6371.1。同时对样品进行了多个重复的检测,其OD490nm值为0.521±0.00012。将样品OD490nm平均值代入回归方程可得出样品溶菌酶溶液的活性为2 842 u/mL。再根据测定的重组蛋白浓度可计算出其比活性约为13 040 u/mg(图 3)。
2.7 诱导表达蛋白LYZ1的体外抗菌活性检测 抑菌试验结果显示,重组牛溶菌酶对埃希氏大肠杆菌、金黄色葡萄球菌有一定的抑菌效果,而对无乳链球菌、停乳链球菌和乳房链球菌抑菌效果较弱,空对照未出现抑菌环。结果如表1所示。
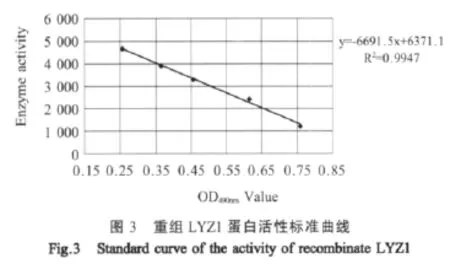

表1 重组LYZ1体外抗菌实验检测结果Table 1 Bacterial inhibition assay of recombinant LYZ1
3 讨 论
随着分子生物学技术的发展和对溶菌酶研究的不断深入,人们更多的倾向于使用微生物发酵和乳腺生物反应器[5-6]的方法生产溶菌酶。乳腺生物反应器旨在提高牛奶品质,改良个体性状,不适于规模化生产。微生物发酵的方法不仅易于培养和操作,而且生产成本低,便于规模化生产。溶菌酶在大肠杆菌表达系统中的表达已有报道[7-8],但由于该系统所表达的外源蛋白难以进行正确的翻译后修饰加工,很大程度上影响了其活性;另外溶菌酶能够引起工程菌自溶,因此在原核表达系统中多以包涵体的形式获得重组蛋白,表达后需对产物进行复性和纯化等处理,导致成本上升。毕赤酵母表达系统具有真核细胞翻译后修饰加工功能,遗传性状稳定等诸多优点[9-10];另外该系统弥补了哺乳类细胞、昆虫细胞表达系统操作复杂、表达水平低、表达不稳定和生产成本高的缺陷[11-12]。
欧阳萍等在大肠杆菌中诱导表达了可溶性的重组人溶菌酶,表达量在裂解上清中占58.3%,对金黄色葡萄球菌和大肠杆菌具有抑制作用[8]。贾向志等将人溶菌酶基因克隆至酵母分泌型表达载体pPIC9K中,表达的目的蛋白约占培养上清总蛋白的47%[13]。本实验应用pPICZα-A分泌型载体,目的蛋白在表达后得到了进一步修饰加工,活性增强,更加接近于天然牛乳溶菌酶。同时在目的基因前端添加了组氨酸标签,可简化表达产物的分离纯化过程[11]。另外本实验特别选用了毕赤酵母的偏爱密码子对目的序列进行了改造,可大大增加目的蛋白的表达量。在实验过程中发现,影响目的蛋白表达量的因素很多,主要包括菌体密度、通气量和培养基pH值等。其中pH值影响较大,经过对各种影响条件的优化,获得了最佳反应条件,最佳的pH为5.0。
吕爽等构建的分泌型酵母表达质粒pPIC9K-hLYZ,重组蛋白表达量约 198 μg/mL,活性为4 677.72 u/mL[14]。而本实验构建的牛乳溶菌酶毕赤酵母表达系统所表达的重组蛋白浓度为218 mg/L,活性为2 842 u/mL,比活性约为13 040.0 u/mg。体外抑菌试验表明牛重组乳溶菌酶具有一定的抗菌作用,尤其是对金黄色葡萄球菌抗菌效果最好,其次是埃希氏大肠杆菌、乳房链球菌、停乳链球菌和无乳链球菌。选用这些细菌主要是因为它们均为临床上奶牛乳房炎及子宫内膜炎的主要致病菌,并且有望将该研究成果应用于临床对奶牛子宫内膜炎和乳房炎的治疗方面,即可抑制细菌生长,又可以增强牛体的免疫力,同时还能促进子宫内膜的修复。本研究组将在以后的实验中,优化表达条件,提高表达量和抑菌效果,推进该研究成果工业化,尤其是在临床治疗和饲料生产中替代抗生素等方面做进一步的推广和应用。
[1]Fleming A.On a remarkable bacteriolytic element found in tissues and secretions[J].Proceed Royal Society London.1922,93(653):306-317.
[2]梁爱华,大野尚仁,宿前利郎.鸡蛋清溶菌酶与β-内酰胺类抗生素联合应用对大肠埃希氏菌生物特性的影响[J].中国抗生素杂志,2001,10(265):371-374.
[3]荣晓花,凌沛学.溶菌酶的研究进展[J].中国生化药物杂志,1999,20(6):319-320.
[4]苍金荣,刘万里,刘延龄,等.微量快速比浊法检测溶菌酶含量[J].陕西医学检验,1994,9(1):38-39.
[5]孙怀昌,张泉,施伟庆,等.人溶菌酶cDNA的克隆及其在小鼠体内的表达[J].中国兽医学报,2004,24(2):157-159.
[6]蒋春茂,孙怀昌,王涛.人溶菌酶基因在奶牛乳腺中的表达试验[J].中国畜牧兽医,2004,31(12):20-21.
[7]钱世钧,陈欣,叶军,等.从大肠杆菌包含体中提取有活性的人溶菌酶的研究[J].生物工程学报,1996,12(增刊):266-268.
[8]欧阳萍,雷连成,吕爽.人溶菌酶基因的原核表达及其生物学活性[J].中国生物制品学杂志,2009,6(6):544-547.
[9]Borgheresi R A,Palma M S,Ducancel F,et al.Expression and processing of recombinant sarafotoxins precursor inPichia pastoris[J].Toxicon,2001,39:1211-1218.
[10]Daly R,Hearn M T W.Expression of heterologous proteins inPichia pastoris:a useful experimental tool in protein engineering and production[J].J Mol Recognit,2005,18(2):119-138.
[11]Cereghino J L,Cregg J M.Heterologous protein expression in the methylotrophic yeastPichia pastoris[J].FEMS Microbiol Rev,2000,24(1):45-66.
[12]Hui S W.Overview of drug delivery and alternative methods to electroporation[J].Methods Mol Biol,2008,42(3):91-107.
[13]贾向志,袁汉英,马文熠,等.人溶菌酶基因的克隆及其在毕赤酵母中的表达[J].第四军医大学学报,2001,22(22):2068-2072.
[14]吕爽.人溶菌酶基因hLYZ在毕赤酵母及小鼠乳腺中的表达及其生物活性研究[D].吉林大学硕士学位论文,2009.
