不同基因型新城疫病毒对美国白羽王鸽的致病性研究
2010-08-07王伟伟曹军平胡顺林王晓泉刘秀梵
吴 双,王伟伟,曹军平,胡顺林,王晓泉,刘秀梵
(扬州大学农业部畜禽传染病学重点开放实验室,扬州225009)
新城疫病毒(Newcastle disease virus,NDV)属于副粘病毒科,禽腮腺炎病毒属。NDV为单股负链不分节段RNA病毒,主要编码6种病毒蛋白,基因组长约15 kb。新城疫(ND)是危害养禽业的重要传染病之一,给许多国家的养禽业造成巨大经济损失[1]。尽管NDV只有1个血清型,但不同基因型毒株之间的生物学特性存在明显差异。根据致病力的不同,NDV通常分为强毒株、中等毒力株和弱毒株。鸽新城疫是由鸽Ⅰ型副粘病毒(Pigeon paramyxovirus type 1,PPMV-1)引起的一种高度接触性传染病,是严重危害养鸽业的主要疫病之一[2]。多数学者认为,PPMV-1是鸡NDV的一种变异株[3],值得注意的是大部分鸽源病毒株F蛋白裂解位点序列虽然为强毒特征,但它们对鸡的致病力却不强,主要呈中等毒力[4]。
研究表明,鸽群中所分离的NDV绝大多数属于基因Ⅵb型,与当前世界上流行的优势基因型并不一致,表明Ⅵb型NDV对鸽具有明显的宿主适应性。但迄今为止,Ⅵb亚型与其它基因型NDV对鸽的致病性尚无详尽报道。为了比较不同基因型NDV对鸽的致病性差异,本研究选择了4个不同基因的NDV强毒株,分别进行鸽的人工感染试验,并对接种后鸽的临床症状、病理变化、排毒规律、抗体变化及组织嗜性差异进行了研究。
1 材料和方法
1.1 病毒株和实验动物 基因Ⅲ型鸡源NDV分离株JS-7-05-Ch、Ⅵ型鸽源NDV分离株WX-10-07-Pi和Ⅶ型鹅源NDV分离株JS-5-05-Go均为本实验室近期分离,经鸡胚成纤维细胞(CEF)噬斑纯化3次后SPF胚传代3次[5];基因Ⅸ型病毒株F48E8由本实验室保存。SPF鸡胚购自山东家禽研究所。2月龄美国白羽王鸽购自江都飞亚肉鸽养殖基地。实验前血清检测证明,所有实验鸽均无NDV和禽流感病毒抗体。
1.2 主要仪器和试剂 7300型实时荧光定量PCR扩增仪,TaqMan Universal PCR Master Mix Kit为ABI公司产品;TRIzol抽提试剂购自Invitrogen公司;M-MLV反转录酶和RNasin购自Promega公司。
1.3 病毒毒力及ELD50测定 1日龄雏鸡脑内接种致病指数(ICPI),6周龄鸡静脉接种致病指数试验(IVPI)和最低致死量致死鸡胚的平均死亡时间(MDT)按照文献标准进行[6]。用Reed-Muench法计算鸡胚半数致死量(ELD50)。
1.4 鸽致病力试验 将2月龄美国白羽王鸽分组,每组10只,另取5只作为阴性对照组,隔离饲养。每只试验组鸽滴鼻、点眼接种106个ELD50的病毒剂量。将F48E8感染组作为阳性对照,阴性对照组鸽接种同体积的PBS。接种后观察30 d,记录实验鸽的临床症状及发病死亡情况;并定时采集泄殖腔棉拭子。
1.5 血清抗体的测定 于接种后第7 d、14 d和21 d采血,血清于-20℃保存,统一用1%健康鸡红细胞,以4个血凝单位LaSota病毒为抗原,采用β微量法测定HI滴度。
1.6 实时RT-PCR(RRT-PCR)检测组织中病毒的分布
1.6.1 引物设计 根据文献[7]合成NDV的1对特异引物及相应的探针。扩增片段位于M基因的保守区。引物由上海生工生物工程有限公司合成,探针由TaKaRa公司合成。预期扩增的片段为146 bp。上游引物:5'-AGTGATGTGCTCGGACCTTC-3',下游引物:5'-CCTGAGGAGAGGCATTTGCTA-3';探针:5'-[FAM]TTCTCTAGCAGTGGGACAGCCTGC[TAM RA]-3'。
1.6.2 组织样品处理 于接种后第4 d、7 d和14 d分别随机取两只鸽子(对照组取1只,濒死鸽随时解剖,存活鸽于第30 d解剖)进行病理解剖,记录剖检变化情况。采集气管、肾脏、脾脏、肺脏、肝脏、胰腺、十二指肠以及胸腺8种组织。按1 g组织样品加3 mL预冷PBS进行研磨,反复冻融3次后取上清,每份取250 μL上清用于RNA的提取。
1.6.3 RRT-PCR检测 按TRIzol法提取8种组织样品总RNA,以6碱基随机引物逆转录合成cDNA进行RRT-PCR检测。其反应体积为50 μL。并设阳性对照、阴性对照和定量标准品孔。反应程序为:95℃ 15 min;94℃10 s、52℃ 30 s、72℃ 10 s,共40个循环。荧光信号的收集及数据的采集定在52℃。检测结束,根据噪音情况设定和调整基线及阈值,根据荧光曲线和Ct值判断结果。
2 结 果
2.1 4株NDV的致病性 4株病毒的部分生物学特性进行测定结果见表1,综合MDT,ICPI和IVPI实验数据显示,JS-5-05-Go、JS-7-05-Ch和F48E8为强毒株,WX-10-07-Pi为中等毒力株。
2.2 临床症状和剖解病变
2.2.1 实验鸽发病及死亡情况 接种后48 h左右,JS-5-05-Go和F48E8试验组的鸽表现出明显的临床症状;接种后72 h,WX-10-07-Pi和JS-7-05-Ch仅表现出轻微的精神状态不佳。病鸽的临床表现主要有:体温升高;发病初期粪便呈黄白色或黄绿色或水样稀粪,后期为墨绿色粘性稀粪,耐过的病鸽粪便性状逐渐正常;眼睑发炎、眼睛半睁半闭,呼吸困难、咳嗽;大部分病鸽表现出翅膀悬垂或向两侧分开,两脚麻痹、呈劈叉姿势,并伴有阵发性痉挛瘫痪、转圈或震颤等神经症状。只有JS-5-05-Go和F48E8试验组的鸽出现死亡,死亡高峰期集中在接种后5 d~9 d。在1个月的实验期内,试验组鸽发病率为100%;除去剖解的病鸽外,F48E8和JS-5-05-Go试验组的死亡率分别为50%和100%,WX-10-07-Pi和JS-7-05-Ch组未见死亡。所有耐过的病鸽精神尚好,但明显消瘦。阴性对照组鸽未表现出异常症状。
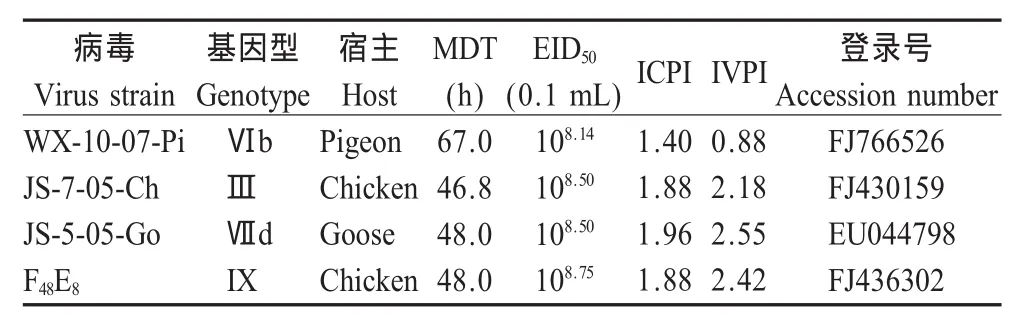
表1 4个病毒生物学特性及其登录号Table 1 Biological characteristics and accession numbers of four isolates
2.2.2 病理解剖学变化 死亡鸽子脾脏肿大、颜色呈黑铜色、表面有针尖至粟粒大的灰白色的坏死结节或伴有出血点,肝脏呈土黄色,边缘、表面及心叶有出血点和出血纹,胰脏肿大、有出血点,部分胸腺肿大、充血,鼻腔、喉头和气管内存有浆液性渗出物,气管和喉头充血、出血,小肠和直肠有弥漫性出血点。
2.3 泄殖腔排毒检测 每个泄殖腔棉拭子接种3个9日龄~10日龄非免疫鸡胚,接种鸡胚的死亡时间在36 h~96 h之间。JS-7-05-Ch和F48E8接种组仅有个别棉拭子检测到病毒,JS-5-05-Go和WX-10-07-Pi接种组的棉拭子中病毒分离率较高,实验结果见表2。

表2 JS-5-05-Go和WX-10-07-Pi接种后泄殖腔棉拭子分离病毒结果Table 2 Isolation for viruses from cloacal swabs in pigeons after inoculation with JS-5-05-Go and WX-10-07-Pi
2.4 抗体变化 4株病毒感染鸽后分别于第7 d、14 d和21 d翅静脉采血,分离血清进行HI试验,结果见表3。阴性对照组的HI结果为0。
2.5 RRT-PCR技术检测各组织脏器中病毒的分布检测结果表明,脾脏、胸腺和肺脏中病毒的检出率较高;其余组织检出率较低,其中,胰腺中病毒的检出率最低;JS-5-05-Go实验组的检出率最高,WX-10-07-Pi组和F48E8组检出率相当,JS-7-05-Ch组检出率最低。本实验中,呼吸系统的检出率高于消化系统,特别是滴鼻和点眼接种似乎偏重于呼吸道症状,与文献报道的一致[8]。各组织脏器中病毒检出结果见表4。

表3 NDV接种后血清中平均抗体效价检测Table 3 Titeration of HI titers in pig serum after inolulation with viruses
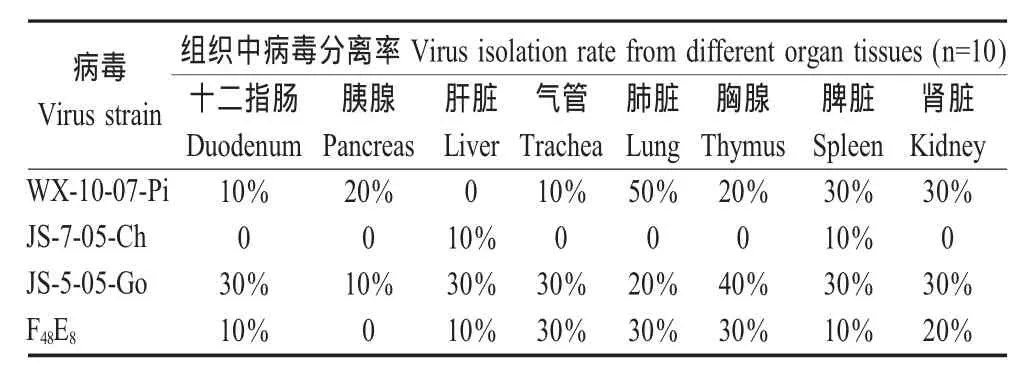
表4 NDV在不同组织中检出率Table 4 The detection of NDV distribution among tissues
3 讨 论
目前NDV对鸽的致病性的研究仅限于临床症状、泄殖腔排毒和抗体变化,很少涉及到组织学病理变化以及病毒在组织器官中的分布等方面,研究不同基因型(中等毒力和强毒株)NDV同时感染鸽的实验研究数据目前还比较缺乏。
本实验中,鸡源JS-7-05-Ch、鸽源WX-10-07-Pi、鹅源JS-5-05-Go和鸡源F48E8(基因型分别为Ⅲ、Ⅵb、Ⅶd和Ⅸ)感染美国白羽王鸽,仅JS-5-05-Go和F48E8能够引起感染鸽的死亡。剖检病理变化主要出现在脾脏、肝脏、肠和胰腺等器官,但其出现比例和严重程度都不很高,有个别病鸽虽然临诊症状相当严重,剖检病变却并不显著,与文献报道一致[9]。
RRT-PCR检测结果表明虽然不同基因型的NDV都能在鸽体内进行复制,但各NDV对鸽组织脏器的亲嗜性强弱有一定的差别。WX-10-07-Pi、JS-5-05-Go和F48E8组的胸腺、脾脏和肾脏的病毒检出率相当;WX-10-07-Pi组的肺脏中病毒检出率明显高于其他3组,表明WX-10-07-Pi对鸽的呼吸道亲嗜性可能最强。
在发病初期,尽管4个基因型NDV感染鸽的临床症状相似,但是只有基因Ⅶd亚型和基因Ⅵb亚型毒株导致鸽泄殖腔出现排毒。实验结果表明,尽管F48E8对鸽的致病性明显强于Ⅵb亚型毒株WX-10-07-Pi,但感染鸽泄殖腔却极少检测到排毒,一定程度上表明,古老的基因型(Ⅲ和Ⅸ)NDV不易在鸽群中传播。与JS-5-05-Go(Ⅶd)相比,WX-10-07-Pi(Ⅵb)感染组鸽的泄殖腔棉拭子在感染后第5 d至15 d内均可检测到排毒,而且排毒率明显高于JS-5-05-Go感染组。结果表明,鸽源毒株WX-10-07-Pi感染鸽后,其在体内的带毒时间长且排毒率明显高于其它基因型NDV感染组。由于感染基因Ⅵ型NDV的鸽的临床症状很轻,这些患病鸽生活习性改变不大;而感染基因Ⅶ型NDV的鸽的临床症状相当严重,死亡率可达100%,限制了鸽的活动。同时,基因Ⅵ型NDV感染鸽的泄殖腔排毒时间长、泄殖腔的病毒检出率高。从临床症状、泄殖腔的排毒时间以及泄殖腔的病毒检出率可以部分解释基因Ⅵb亚型NDV比基因Ⅶd型NDV更易在鸽群传播。这些结果一定程度上验证了目前在我国Ⅵb亚型是鸽群中所特有的基因型,鸽源NDV分离株绝大多数属于该亚型。值得注意的是,虽然基因Ⅶd型毒株JS-5-05-Go首次在鸽体内进行实验,但是接种后也能在泄殖腔中排毒,而且感染鸽的发病程度与死亡率明显高于Ⅵb亚型毒株WX-10-07-Pi,因此,鸽群感染Ⅶd亚型并造成发病和流行的风险依然存在。
[1]Miller P J,Decanini E L,Afonso C L.Newcastle disease:Evolution of genotypes and the related diagnostic challenges[J].Infect Genet Evol,2010,10:26-35.
[2]Alexander D J,Russell P H,Parsons G,et al.Antigenic and biological characterisation of avian paramyxovirus type I isolates from pigeons-an international collaborative study[J].Avian Pathol,1985,14:365-376.
[3]Alexander D J,Russell P H,Parsons G.Antigenic and biological characterization of avian paramyxovirus type 1 isolates from pigeons-an international collaborative study[J].Avian Pathol,1985,14:365-376.
[4]Kissi B.Studies on the virulence of pigeon paramyxovirus-1(PMV-1).I.Changes in the virulence of pigeon PMV-1 strains isolated in Hungary upon passage in chickens'embryonated hen eggs and pigeons[J].Acta Vet Hung,1988,36:283-292.
[5]梁荣,曹殿军,阎丽辉,等.新城疫病毒分离株的蚀斑纯化及影响蚀斑形成的主要因[J].中国兽医学报,2003,23:533-535.
[6]OIE编著(农业部畜牧兽医局译).哺乳动物、禽类和蜜蜂A类和B类疾病诊断试验和疫苗标准手册[M].北京:中国农业科技出版社,1996:140-146.
[7]Wise M G,Suarez D L,Seal B S,et al.Development of a real-time reverse-transcription PCR for detection of Newcastle disease virus RNA in clinical samples[J].J Clin Microbiol,2004,42:329-338.
[8]Beard C W,Easterday B C.The influence of the route of administration of Newcastle disease virus on host response[J].J Infect Dis,1967,117:55-70.
[9]万洪全,刘海侠,吴力力,等.鹅副黏病毒对鸽的致病性研究[J].中国兽医科技,2002,32:5-8.
