HBsAg水平与抗乙型肝炎病毒药物治疗远期效果相关性分析
2010-08-06王欣怡郭亚春张文彬刘金霞承德医学院附属医院承德市067000承德医学院承德市067000
王欣怡,郭亚春,张文彬,刘金霞#(1.承德医学院附属医院,承德市067000;.承德医学院,承德市067000)
慢性乙型病毒性肝炎(CHB)的抗病毒治疗药物包括干扰素、核苷酸类似物和核苷类似物,每类药物在疗效、副作用、适应证等方面都有很大差异,而且疗程长达1至数年,给患者心理或经济上带来巨大压力。因此,在抗病毒治疗中,有必要选择一个准确的简便的预测指标,用于治疗前的疗效评估和治疗后终点结果的预测。乙肝病毒共价闭合环状DNA(HBV cccDNA)是HBV前基因组RNA转录产物最原始的模板,是乙肝病毒持续感染的关键因素,是乙肝病毒复制最特异的指标,其准确性超过目前常用的HBV DNA检测。但目前通过肝活检来监测患者肝组织中的HBV cccDNA水平还存在着一定困难。本研究就干扰素和拉米夫定2种方案及用药不同时间点进行了系统观察,对患者的疗效和预后进行分析,最终选择血清HBsAg定量分析作为疗效预测和评估的最简易指标,以指导临床用药。
1 资料与方法
1.1 一般资料
2007年1月~2009年1月我院门诊和病房共收治CHB患者66例,随机分为2组,即干扰素组43例、拉米夫定组23例。每例患者均按2007年美国肝病研究学会慢性乙型肝炎防治指南入选[1],所有病例血清HBsAg、HBeAg、HBV DNA均阳性,丙氨酸氨基转移酶(ALT)高于正常值2倍以上,血清胆红素<34 μmol·L-1,持续6个月以上,从未接受任何的抗病毒治疗。甲、丙、丁、戊、庚等病毒性肝炎、人类免疫缺陷病毒(HIV)感染、药物性肝损伤、酒精性、非酒精性脂肪肝性肝病、代谢性肝病、自身免疫性疾病等除外。2组患者在年龄、性别、家族史、肝功能损伤严重程度等方面差异无统计学意义,具有可比性。
1.2 方法
所有患者均给予门冬氨酸钾镁、维生素C、复方甘草酸制剂等一般保肝对症治疗。另外,干扰素组给予干扰素IFN α-2b 500 MU,肌肉注射,隔日1次,用药时间1年。在用药前、用药过程中每2~4周检测血常规、甲状腺功能、抗核抗体等自身免疫性疾病的相关指标,做到能够及时发现干扰素的副作用,并给予对症处理或停药。干扰素组3例因副作用不能耐受被迫停药,不纳入疗效统计范围内。拉米夫定组口服拉米夫定100 mg,每日1次,观察时间1年。注意观察其耐药发生情况,一旦耐药,及时调整抗病毒治疗方案。拉米夫定组1例出现耐药,不纳入疗效统计范围内。
1.3 观察指标
1.3.1 HBV DNA。应用实时荧光定量PCR试剂盒检测血清中HBV DNA,操作方法严格按试剂盒说明书进行。用药前、用药后每隔3个月检测1次。
1.3.2 HBV抗原抗体系统的检测。采用酶联免疫吸附试验(ELISA)方法,应用全自动时间免疫荧光分析仪定量检测(HBV抗原、抗体检测试剂盒购自美国雅培公司)。对治疗前HBsAg进行分层,分为<100 ng·L-1、100~200 ng·L-1、>200 ng·L-13个等级。在治疗3个月时,HBsAg抑制率=(治疗前HBsAg定量-治疗3个月时HBsAg定量)/治疗前HBsAg定量×100%,以每隔10%进行计数,计算各层病例HBeAg/HBe-Ab血清转换率,应用Excel表格进行作图,观察HBeAg/HBeAb血清转换率与HBsAg抑制率的关系。
1.4 统计学处理
数据采用SAS 8.0软件进行统计分析,根据资料的性质分别采用t检验、χ2检验。
2 结果
2.1 血清HBsAg水平变化
拉米夫定组抗病毒治疗后,患者血清HBsAg水平无显著下降。干扰素组治疗后,HBsAg出现下降趋势,与拉米夫定组比较,治疗3个月开始,有显著性差异(P<0.05),随着治疗时间的延长,在治疗6个月以后,出现极显著性差异(P<0.01),如表1所示。
表1 CHB患者抗病毒治疗中HBsAg水平(±s )Tab 1 Quantity of HBsAg in antivirus therapy for CHB(±s )

表1 CHB患者抗病毒治疗中HBsAg水平(±s )Tab 1 Quantity of HBsAg in antivirus therapy for CHB(±s )
与拉米夫定组比较:*P<0.05vs.lamivudine group:*P<0.05
HBsAg定量/ng·L-1组别 例数0月3月6月9月12月干扰素组40239.9±22.7216.7±38.9*188.7±23.7*169.7±23.7*141.3±27.9*拉米夫定组22242.6±34.1235.4±29.4247.5±21.7217.5±25.1243.8±20.2 t值0.3732.0159.8837.64915.54 P值0.710.048<0.01<0.01<0.01
2.2 血清HBV DNA水平变化
2种抗病毒治疗方案均有不同程度抑制HBV DNA的作用,拉米夫定组在治疗6个月时几乎全部转阴,HBV DNA转阴率较高,与干扰素组比较,有极显著性差异(P<0.01),如表2所示。
表2 CHB患者抗病毒治疗中血清HBV DNA定量(±s )Tab 2 Quantity of HBV DNA in antivirus therapy for CHB(±s )

表2 CHB患者抗病毒治疗中血清HBV DNA定量(±s )Tab 2 Quantity of HBV DNA in antivirus therapy for CHB(±s )
与拉米夫定组比较:*P<0.05vs.lamivudine group:*P<0.05
组别干扰素组拉米夫定组t值P值例数40 22 HBV DNA定量(×1 000 copies·mL-1)0月4 987±238 5 052±241 1.02 0.31 3月1 321±256*238±231 16.48<0.01 6月929±231*<1 9月864±216*<1 12月916±238*<1------
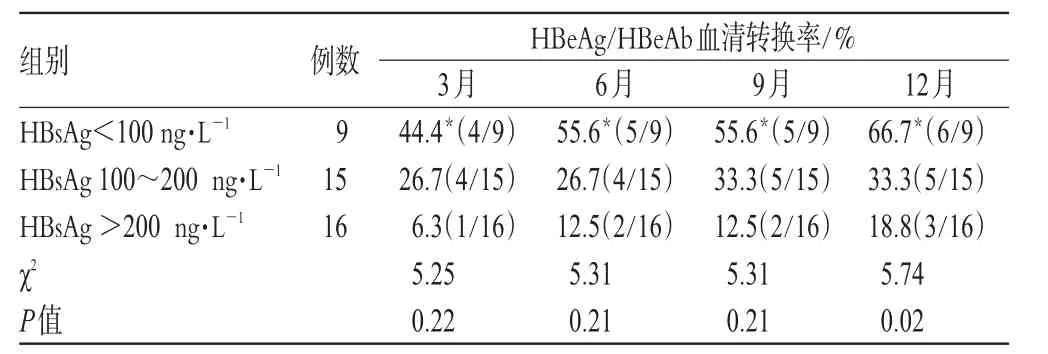
表3 干扰素治疗前HBsAg初始水平与HBeAg/HBeAb血清转换率(%%)Tab 3 Initial level of HBsAg before IFN-α2b treatment and seroconversion ratio of HBeAg/HBeAb(%%)
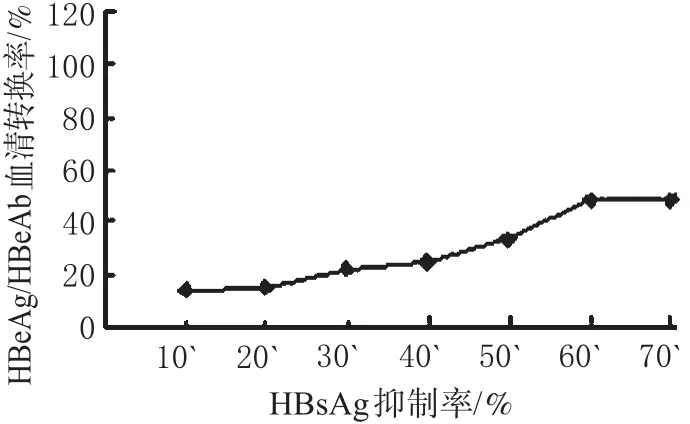
图1 干扰素治疗后3个月HBsAg抑制率与HBeAg/HBeAb血清转换率(%%)Fig 1 Inhibition rate of HBsAg after 3 months of IFN-α2b treatment and seroconversion ratio of HBeAg/HBeAb at the end of treatment(%%)
2.3 HBsAg水平与HBeAg/HBeAb血清转换率相关性分析
在治疗前,对各组患者的HBsAg分3个层次进行分析,发现拉米夫定组的HBeAg/HBeAb血清转换率与HBsAg水平无关。在干扰素组,随着HBsAg水平增加,HBeAg/HBeAb血清转换率显著下降,呈负相关趋势,如表3所示。在治疗3个月时,HBsAg抑制率超过50%,HBeAg/HBeAb血清转换率达47%。提示,随着HBsAg下降的幅度的增加,HBeAg/HBeAb血清转换率显著提高,呈正相关趋势,如图1所示。
3 讨论
CHB是一个全球性的健康问题,最终可发展为肝硬化、肝癌。乙型肝炎病毒(HBV)进入肝细胞,形成HBV cccDNA,难以清除。廖家杰等在第59届美国肝病研究学会(AASLD)年会提出肝组织中HBV cccDNA和血清中HBsAg定量的相关关系,HBsAg反映肝组织中HBV cccDNA情况,是一种非侵入性的反映抗病毒疗效的较好指标[2]。HBsAg清除是乙肝自然恢复过程中人体免疫系统控制病毒取得的最佳结果,取决于HBV、肝细胞以及宿主免疫应答之间的关系[3]。肝细胞感染HBV后可导致肝细胞发生炎症和死亡,HBV复制可继续感染其他肝细胞,而宿主免疫系统在控制HBV方面发挥重要作用[4]。
目前,用于治疗CHB的2类药物中,核苷类似物主要通过竞争性抑制HBV DNA聚合酶,减少HBV DNA的复制,发挥抗病毒作用,但不能清除细胞核内的HBV cccDNA,停药后又启动病毒复制循环,其HBsAg转阴率与自然转阴率相似,每年0.8%~1%;干扰素主要是诱导宿主细胞产生多种细胞因子发挥抗病毒和免疫调节双重作用,主要包括阻止病毒进入细胞,降解病毒mRNA,抑制病毒蛋白的转录、病毒增强子的活性和病毒包装。因此,干扰素既具有抑制病毒复制作用,阻断病毒再感染过程,又可诱导免疫应答,有效清除感染肝细胞,从而获得更高的HBsAg清除率。干扰素在临床上已经广泛应用于治疗CHB,许多指标用于评价的治疗应答,如ALT正常化、HBV DNA抑制至不可检测、HBeAg血清学转换等,而HBsAg清除更成为治疗CHB的终极目标,是可以获得的最接近治愈的状态[5,6]。监测HBsAg水平有助于准确了解患者对于治疗的应答情况。HBsAg初始低水平或治疗早期下降可作为治疗应答的早期预测指标。如果患者HBsAg水平不降低则认为对治疗无应答,可停止治疗。如果患者HBsAg水平下降较慢,则需延长治疗时间。本文发现以HBsAg治疗前的水平以及治疗3个月时的下降幅度作为评估抗病毒疗效的远期预测指标,是一种简单、经济、准确的方法,到目前为止,可能是唯一能够间接反映肝组织中HBV cccDNA情况的指标。但由于本研究病例数量有限,观察时间较短,缺乏肝组织中HBV cccDNA的指标,需要进一步增加病例数并跟踪观察。
[1]彭文伟主编.传染病学[M].第6版.北京:人民卫生出版社,2004:17~45.
[2]Akman SA,Okcu SC,Halicioğlu O,et al.Therapeutic efficacy of sequential and simultaneous treatments with interferon-alpha and lamivudine in children with chronic hepatitis B[J].Pediatr Int,2007,49(6):848.
[3]史正军,张海涛,张晓艳.苦参素联合α-2b干扰素治疗慢性乙型肝炎的临床疗效观察[J].中国药房,2007,18(27):2 139.
[4]Akhan SC,Yulugkural Z,Vahaboglu H,et al.Response to interferon-alpha in chronic hepatitis B patients with and without precore mutant strain and effects on HBsAg titers[J].Chemotherapy,2007,53(6):402.
[5]Kim SR,Imoto S,Fuki S.Case of adult genotype C HBV carrier after acute hepatitis B,losing HBsAg and acquiring HBsAb after IFN and lamivudine treatment[J].Hepatol Res,2006,36(2):149.
[6]陈安进,张 芳,徐 艳.干扰素与拉米夫定治疗慢性乙型肝炎的成本-效果分析[J].中国药房,2007,18(26):2 010.
