携带IBV DNA疫苗重组减毒沙门氏菌的构建及免疫原性研究
2010-08-06李玉玲王红宁曾瑜虹郭自成
李玉玲,王红宁,曾瑜虹,阳 泰,郭自成
(四川大学生命科学学院动物疫病防控与食品安全四川省重点实验室,四川成都610064)
禽传染性支气管炎(Infectious bronchitis,IB)是由IB病毒(IBV)引起鸡的一种急性、高度接触性的传染病,是目前危害养禽业最严重的病毒性传染病之一,给养禽业造成严重经济损失[1]。IB的控制主要依赖于疫苗的预防接种,灭活疫苗成本高,弱毒疫苗存在重组和毒力返强的危险。IBV主要通过呼吸道黏膜途径感染机体,因此在局部建立有效的黏膜免疫应答对于IB的控制有着重要的意义。减毒沙门氏菌X4550株是已注册认可的可用于口服的商用疫苗菌株,该菌株不含抗生素抗性基因,可以通过口服、滴鼻途径免疫,直接携带重组质粒进入动物细胞内表达相应的蛋白[2],对呼吸道黏膜免疫、体液免疫、细胞免疫和攻毒保护有增强作用。口服途径接种,适用于规模化养殖的群体免疫[3]。
本课题组前期研究结果表明,IBV3基因(S1基因、M基因、N基因)混合疫苗的免疫效果优于单基因免疫的效果[4]。本研究联合运用携带有IBV S1、M、N基因的pVAX1-S1,pVAX1-M,pVAX1-N重组质粒,将其转入减毒沙门氏菌X4550株,构建IBV S1、M、N基因DNA质粒重组减毒沙门氏菌X4550疫苗株(X4550/pVAX1-S1、X4550/pVAX1-M和X4550/pVAX1-N),用间接免疫荧光法(IFA)检测重组减毒沙门氏菌X4550疫苗株体外表达,经口服免疫SPF鸡,测定体内组织分布及稳定性、特异性IgG、IgA、CD4+和CD8+T细胞含量并进行攻毒实验。以期为研制IBV基因减毒沙门氏菌疫苗提供实验依据。
1 材料和方法
1.1 病毒株、质粒、疫苗、细菌株和鸡胚 IBV SAIBk株(DQ288927)、重组质粒pVAX1-S1、pVAX1-M和pVAX1-N由四川大学生命科学学院动物疫病防控与食品安全四川省重点实验室惠赠;IBV M41株、IBV阳性血清、阴性血清购自中国兽医药品监察所;鸡IBV高免血清为本实验室制备;IBV H120减毒苗购自瑞普(保定)生物药业有限公司;减毒沙门氏菌X4550株由美国亚利桑那州立大学生物设计中心Roy Curtiss教授惠赠;SPF鸡胚购自北京市实验动物中心。
限制性内切酶购自宝生物工程(大连)有限公司;反转录试剂盒和脂质体转染试剂购自Invitrogen公司;鸡IgA ELISA检测试剂盒购自美国Adlitteram Diagnostic Laboratories,Inc.;FITC 标 记 的 CD4+、PE标记的CD8+T细胞单克隆抗体(MAb)购自美国Southern Biotechnology;FITC标记兔抗鸡IgG荧光抗体购自Sigma公司;HRP标记兔抗鸡IgG酶标抗体购自武汉晶美生物工程有限公司。
1.2 IBV S1、M、N基因DNA质粒重组减毒沙门氏菌X4550疫苗株构建、鉴定及制备 按照《分子克隆实验指南》具体操作程序,用CaCl2法制备沙门氏菌X4550感受态细胞。分别将重组质粒pVAX1-S1、pVAX1-M、pVAX1-N及空质粒pVAX1转入减毒沙门氏菌X4550感受态,构建IBV S1、M、N基因DNA质粒重组减毒沙门氏菌X4550疫苗(X4550/pVAX1-S1、X4550/pVAX1-M、X4550/pVAX1-N)以及X4550/pVAX1。菌落PCR鉴定,酶切分析。
将含有 X4550/pVAX1-S1、X4550/pVAX1-M和X4550/pVAX1-N的LB液体培养基振荡培养后,用灭菌的 PBS,调整细菌浓度至 109cfu/mL,即OD600nm=0.6~0.8,按 1∶1∶1体积比将这 3种菌液混匀,作为动物免疫实验的3个基因混合疫苗。
1.3 pVAX1-S1、pVAX1-M和pVAX1-N真核质粒在细胞中的表达检测 3种重组真核质粒经纯化后转染COS-7细胞,采用IFA方法检测目的蛋白在细胞中的表达情况,一抗为鸡IBV高免血清,二抗为FITC标记兔抗鸡IgG荧光抗体。
1.4 免疫鸡及分组 将7日龄SPF雏鸡随机分成5组,每组30只鸡。7日龄为首免,两周后加强免疫一次,免疫前实验鸡禁水禁食4 h。
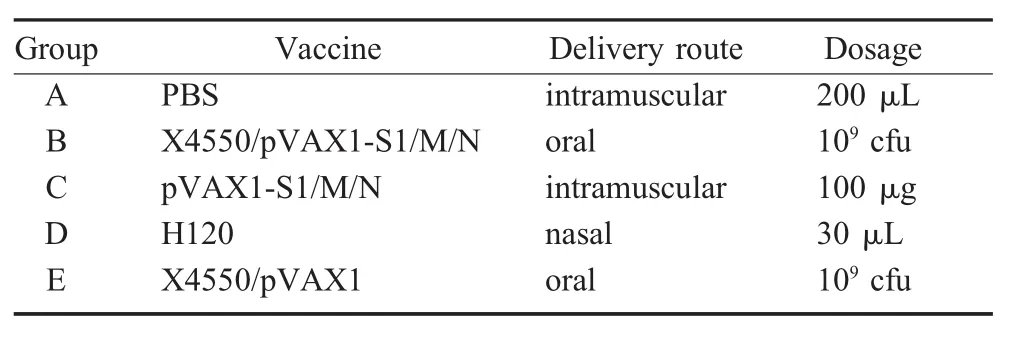
表1 免疫鸡分组Table 1 Experimental design
1.5 重组菌X4550/pVAX1-GFP的构建、组织分布及稳定性测定 将构建的重组菌X4550/pVAX1-GFP的浓度配制为109cfu,取15只7日龄SPF雏鸡,每只鸡喂食1 mL,分别于喂食后3 d、6 d、9 d各迫杀2只鸡,取心、肝、脾、肺、肾、睾丸(卵巢)、小肠7个组织,制备成冰冻切片,在荧光显微镜下迅速观察X4550/pVAX1-GFP在这7个组织的分布情况。
将 3种重组菌按 1∶1∶1(体积比)混匀,取 10只7日龄SPF雏鸡,口服接种3种重组菌的混合疫苗,免疫后6周随机迫杀4只鸡,取肺组织和肾脏,用PBS液制备组织匀浆,涂板培养后,做S1、M、N基因菌落PCR扩增检测。
1.6 特异性IgG测定 应用不连续蔗糖密度梯度离心法纯化IBV,包被ELISA酶标板。首免后2周及6周,每组随机选取5只鸡,翅静脉采血,室温静置,分离血清,采用间接ELISA法检测特异性IBV血清抗体,同时作阳性和阴性对照,二抗为HRP标记兔抗鸡IgG酶标抗体。
1.7 肠道黏膜IgA测定 首免后6周,每组随机迫杀5只鸡,按文献[5]方法采集并制备小肠粘膜样品,固相夹心ELISA测定肠道黏膜IgA浓度。具体步骤参照鸡免疫球蛋白A(IgA)ELISA检测试剂盒说明书。
1.8 淋巴细胞CD4+和CD8+T检测 首免后2周及6周,每组随机选取5只鸡,翅静脉采集全血,密度梯度离心法分离外周血淋巴细胞,FITC标记CD4+T细胞,PE标记CD8+T细胞,流式细胞仪检测CD4+和CD8+T细胞亚类含量,每个样品计数3万个细胞。
1.9 攻毒保护试验 首免后6周IBV M41104EID50,0.2 mL/羽,滴鼻和点眼(各一半)攻毒,每组15只鸡。观察鸡只有无不良反应和死亡情况,当日迫杀有症状及死亡鸡只,无菌采集有症状鸡只气管及肺组织制备匀浆,从气管、肺组织匀浆上清液中提取RNA,做S1、M、N基因RT-PCR,记录病毒的分离情况;观察死亡鸡只组织病变,确定死因。攻毒后第5 d及第10 d每组迫杀5只鸡,第15 d迫杀全部存活无症状鸡只,分离病毒,方法同上。死亡鸡和迫杀鸡病毒检出阳性的为未保护,迫杀和存活鸡只病毒检出阴性者判定为受保护。
1.10 统计学分析 采用PRISM软件对所得数据进行单因素方差分析,统计学差异设为p<0.05。
2 结果
2.1 IBV S1、M、N基因重组沙门氏菌疫苗构建鉴定结果 如图1显示,可扩增出和预期目的基因大小相符的片段以及质粒pVAX1片段,表明IBV S1、M、N基因已被正确插入到真核表达载体pVAX1,并成功转入减毒沙门氏菌X4550中。
2.2 pVAX1-S1、pVAX1-M、pVAX1-N真核质粒的体外表达检测结果 在蓝光激发下,转染了pVAX1-S1、pVAX1-M、pVAX1-N真核质粒的COS-7细胞,显示出特异性黄绿色荧光,而转染了pVAX1的细胞没有显示出任何特异荧光,表明IBV SAIBk株S1、M、N蛋白在COS-7细胞中均获得表达(图 2)。

2.3 重组菌X4550/pVAX1-GFP的组织分布及稳定性测定结果 实验鸡肠、脾、肝、心、肾、肺6个组织,在荧光显微镜下均能观察到绿色荧光蛋白GFP的表达,生殖器官睾丸(卵巢)未观察到GFP的表达(图 3)。

重组菌接种后6周,从肺和肾脏进行细菌分离,并进行S1、M、N基因的菌落PCR扩增,结果表明分离菌中均能扩增出与3个基因大小相符的DNA片段。
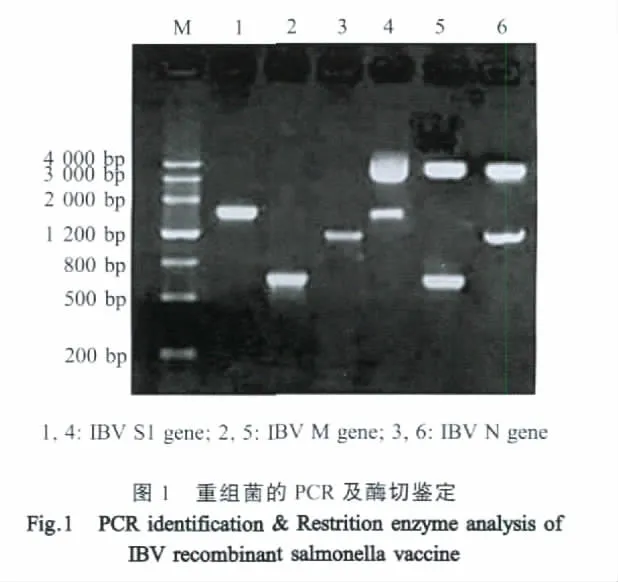
2.4 抗IBV特异性IgG检测结果 首免后2周,X4550/pVAX1-S1/M/N组即可刺激实验鸡产生IBV特异性IgG抗体,OD值高于PBS组(p<0.01)和 X4550/pVAX1组(p<0.05), 但 低 于 H120组(p<0.05)。二免后4周,X4550/pVAX1-S1/M/N组和H120组OD值继续升高,pVAX1-S1/M/N组OD值呈下降趋势且和PBS组比较已无统计学差异(p>0.05)(图4)。
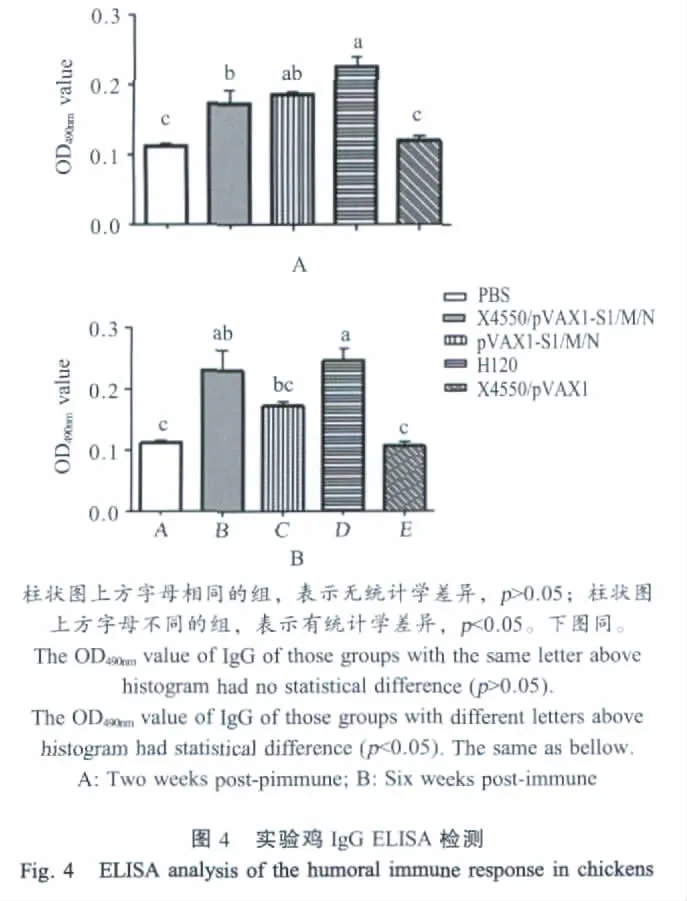
2.5 肠道黏膜IgA检测结果 首免后6周,经黏膜途径接种的X4550/pVAX1-S1/M/N组(口服)和H120组(滴鼻),均能诱发极高的黏膜IgA浓度,显著高于 PBS组和 X4550/pVAX1组(p<0.01);pVAX1-S1/M/N组不能刺激局部IgA浓度的升高(图5)。
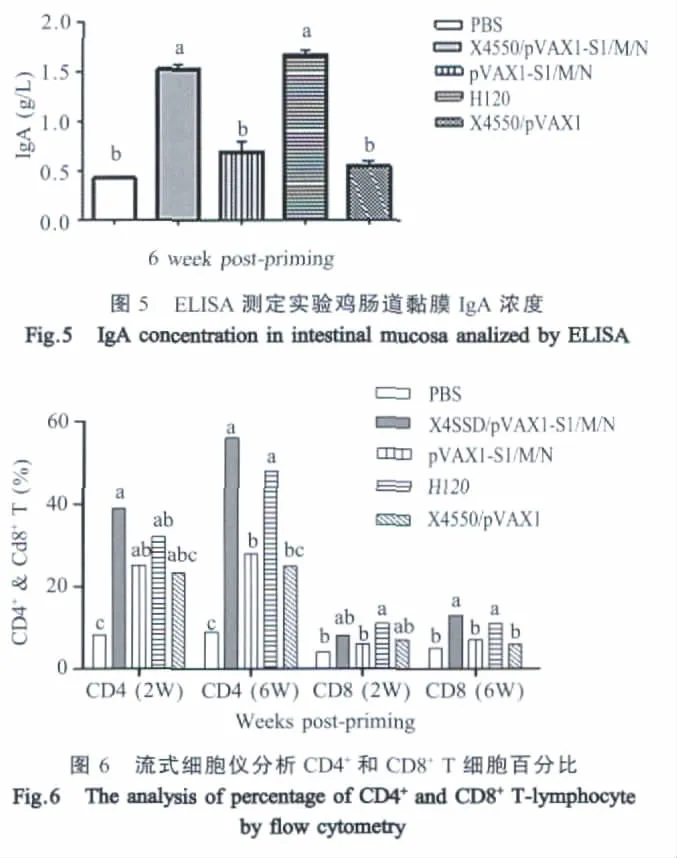
2.6 淋巴细胞CD4+、CD8+T检测结果 X4550/pVAX1-S1/M/N组的CD4+T淋巴细胞含量,仅需免疫一次,其水平就明显上升,首免后2周,显著高于PBS组(p<0.01),加强免疫后,含量继续升高,二免后4周显著高于PBS组、pVAX1-S1/M/N组及X4550/pVAX1组(p<0.01)。H120组动态变化趋势与X4550/pVAX1-S1/M/N组完全相同。接种X4550/pVAX1-S1/M/N组疫苗可以刺激CD8+T细胞含量逐渐升高,二免后4周显著高于PBS组、pVAX1-S1/M/N组及X4550/pVAX1组(p<0.01)。H120组CD8+T淋巴细胞含量始终稳定在较高水平,和PBS组比较差异显著(p<0.01),但与X4550/pVAX1-S1/M/N组无统计学差异(p>0.05)(图6)。
2.7 攻毒保护实验结果 将各次检测结果相加,H120组攻毒保护(12/15只鸡),X4550/pVAX1-S1/M/N组攻毒保护(11/15只鸡)和pVAX1-S1/M/N组攻毒保护(10/15只鸡),3组间无统计学差异(p>0.05),显著高于 PBS组和 X4550/pVAX1组(p<0.01)(表2)。表明X4550/pVAX1-S1/M/N疫苗具有免疫保护作用。

表2 IBV M41株攻毒后,各组保护效果比较Table 2 Protection rate of different groups challenged by IBV M41 strain
3 讨论
本实验结果表明,重组减毒沙门氏菌X4550疫苗株可致肠道黏膜IgA显著升高。减毒沙门氏菌可将重组质粒直接运送给APC并在其内表达,可刺激强烈的原位黏膜免疫反应,产生局部IgA,通过共同的黏膜免疫系统,还可致远处的黏膜表面(如呼吸道、口腔、生道、泪腺)诱发较强的黏膜免疫,形成抵抗病原侵入的第一道屏障[8]。IgG是血液循环中具有中和作用的主要抗体,可阻止病毒吸附于易感靶细胞,而降低病毒的传染性,减轻临床症状[9],本研究构建的重组菌疫苗,接种后可致IgG滴度显著高于PBS组及空载体组。重组减毒沙门氏菌X4550疫苗株还可致CD4+、CD8+T细胞含量显著升高,MHCⅠ限制的CD8+CTL可有效清除病毒粒子[10];MHCⅡ限制的CD4+Th1反应可以促使CD8+CTL的增殖、成熟和功能活化,有助于B细胞活性增加,并能直接诱导抗病毒的淋巴活素的产生[11]。细胞免疫不但可以对IBV最初的感染具有抑制作用,而且在IBV的攻毒保护中,起着重要的作用[9]。
IBV S1、M、N基因DNA质粒重组减毒沙门氏菌X4550疫苗,可经循环系统到达效应器官并稳定存在于其中;口服免疫SPF鸡,肠道黏膜IgA浓度、CD4+和CD8+T淋巴细胞显著增多,并产生良好的免疫保护效果;口服还方便了疫苗的接种。减毒沙门氏菌递送DNA疫苗进入机体,是否具有免疫原性,关键在于能否到达效应器官,并在效应器官稳定存在足够长的时间[6]。本研究减毒沙门氏菌X4550组织定位实验结果表明,除睾丸(卵巢)外,小肠、心脏、肝脏、脾脏、肺组织和肾脏6个器官均能观察到GFP的表达,提示X4550能将重组质粒带至远处实质性器官并释放重组质粒,目的基因开始转录并得到表达。本研究为研制IBV基因减毒沙门氏菌疫苗提供了实验依据。
[1]Cavanagh D,Naqi S.Infectious bronchitis[A].In:Calnek B W,Barnes H J,McDougald L R,editors.Diseases of poultry[C].10th ed.London:Mosby-Wolfe,1997.511-526.
[2]Gentschev I,Dietrich G,Spreng S,et al.Recombinant attenuated bacteria for the delivery of subunit vaccines[J].Vaccine,2001,19:2621-2628.
[3]Ashby D,Leduc I,Lauzon W,et al.AttenuatedSalmonellatyphimurium SL3261 as a vaccine vector for recombinant antigen in rabbits[J].J Immunol Meth,2005,299:153-164.
[4]周生.禽传染性支气管炎病毒分离株的全基因组及S1、M、N基因DNA疫苗研究[D].四川雅安:四川农业大学,2007.
[5]Fukutome K,Watarai S,Mukamoto M,et al.Intestinal mucosal immune response in chickens following intraocular immunizaion with liposome-associatedSalmonellaenterica serovar enteritidis antigen[J].J Dev Comp Immunol,2001,25(5):475-484.
[6]Wyszynska A,Raczko A,Lis M,et al.Oral immunization of chickens with avirulentSalmonellavaccine strain carryingC.jejuni72Dz/92 cjaA gene elicits specific humoral immune response associated with protection against challenge with wild-type Campylobacter[J].Vaccine,2004,22:1379-1389.
[7]戴贤君,方维焕.减毒沙门氏菌为载体的口服生长抑素DNA疫苗对草鱼的安全性[J].中国兽医学报,2005,25:356-358.
[8]姚碧涛,李鹏,焦新安,等.重组流感病毒H1N1活菌疫苗的构建及其免疫效果的初步研究[J].免疫学杂志,2006,22:686-689.
[9]Flo J,Tisminetzky S,Baralle F.Oral transgene vaccination mediated by attenuatedSalmonellaeis an effective method to prevent Herpes simplex virus-2 induced disease in mice[J].Vaccine,2001,19:1772-1782.
[10]Luria-Perez R,Cedillo-Barron L,Santos-Argumedo L,et al.A fusogenic peptide expressed on the surface ofSalmonellaenterica elicits CTL responses to a dengue virus epitope[J].Vaccine,2007,25:5071-5085.
[11]Tian L,Wang H N,Lu D,et al.The immunoreactivity of a chimeric multi-epitope DNA vaccine against IBV in chickens[J].BBRC,2008,377:221-225.
