我国A群牛轮状病毒感染的血清流行病学调查
2010-08-06常继涛刘海军
李 鑫,常继涛,刘海军,于 力
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/大动物传染病研究室,黑龙江哈尔滨150001)
A群轮状病毒(Group A Rotavirus,RV)是多种幼龄动物非细菌性腹泻的主要病原,属呼肠孤病毒科(Reoviridae)、轮状病毒属(Rotavirus)成员。成熟的病毒粒子包含11节段双股RNA基因组,可编码6种结构蛋白和5种非结构蛋白[1-2]。牛轮状病毒(Bovine Rotavirus,BRV)感染所引起的腹泻多发生在1月龄以内的犊牛,引起疾病的严重程度差别很大,包括无症状感染、温和的自限性腹泻以及伴有严重脱水的重度腹泻。BRV腹泻是我国牛消化道传染病的重要疫病之一,严重影响着我国养牛业的发展。
有报道显示BRV在不同的国家和地区均呈现地方性流行[3-4]。我国对BRV感染及其所致疾病的研究有限,已有的研究表明,BRV在我国的流行也比较广泛,所引起的危害也很大[5-6],但是尚无大规模系统的流行病学调查研究。为揭示BRV在我国的感染和流行情况,本研究首先建立了BRV抗体的检测方法,对在2005年~2006年期间采自12省市自治区的1760份牛血清进行抗BRV抗体检测,从而获得A群BRV在我国牛群中的感染和流行情况,为制订我国BRV感染的防制措施以及BRV疫苗的研究提供实验依据。
1 材料和方法
1.1 主要材料 BRV NCDV毒株购自中国兽医药品监察所,MA104细胞由本实验室保存;可拆酶标板购自美国Costar公司;HRP-山羊抗牛IgG抗体购自Sigma;四甲基联苯胺(TMB)显色液购自天根生化科技有限公司。
1.2 血清样品来源 1760份牛血清于2005年~2006年期间采自我国黑龙江省、云南省、四川省、江苏省、河北省、山西省、贵州省、山东省、北京市、内蒙古自治区、新疆自治区和西藏自治区12个省市自治区的1岁~8岁成年水牛、黄牛、牦牛及奶牛。用间接免疫荧光法从采自于黑龙江省的牛血清和采自于澳大利亚进口牛的血清中分别筛选出BRV抗体阳性血清和阴性血清。其中105份BRV抗体阴性血清均采自澳大利亚进口牛。
1.3 包被抗原的制备 BRV标准株(NCDV株)经50 μg/mL的胰酶 37℃处理1 h后接种于MA-104单层细胞,培养液中含5 μg/mL的胰酶,37℃ 5%CO2培养,90%以上细胞病变(CPE)出现时收毒。反复冻融3次,4000 r/min离心10 min,上清液-70℃冻存备用。
1.4 间接免疫荧光(IFA) 用NCDV株感染单层MA104细胞,以正常细胞作为阴性对照。用冰冻无水乙醇固定细胞15 min;风干后加入血清,37℃孵育40 min;用PBS洗涤后加入FITC标记的山羊抗牛IgG抗体,37℃孵育40 min;PBS洗涤后于倒置荧光显微镜下观察结果。
1.5 间接ELISA 碳酸盐缓冲液(pH9.6)稀释抗原,包被酶标板;37℃封闭1 h;之后加入待检血清,37℃作用1 h;加入HRP标记的山羊抗牛IgG抗体,37℃作用1 h;TMB显色液室温避光作用10 min;2M硫酸溶液终止反应,用酶标仪Zenyth 3100测定OD450nm值。
1.6 间接ELISA反应的术式 对ELISA工作条件进行优化,包括封闭液和作用时间、待检血清稀释倍数和作用时间、酶标抗体稀释倍数和作用时间及显色液和显色时间等。判定标准采用临界值(Cut-Off)法,将间接免疫荧光检测为BRV抗体阴性的105份澳大利亚进口牛血清进行ELISA测定,计算所有阴性血清ELISA OD450nm值的平均值(X)和标准差(SD)。将X+3SD作为阳性和阴性判定的临界值[7]。
2 结果
2.1 A群BRV间接ELISA抗体检测方法的建立
2.1.1 ELISA反应术式的确立 经过对抗原包被浓度和血清稀释度等条件的优化,确定ELISA的最佳工作条件为:抗原最佳包被浓度为25 μg/孔,4℃过夜包被;5%脱脂乳37℃封闭1 h;待检血清用PBST作1∶100倍稀释,37℃作用1 h;HRP-山羊抗牛IgG抗体作1∶10000稀释,每孔100 μL加入酶标板后37℃作用1 h;加入TMB底物室温避光显色10 min,每孔加入60 μL终止液终止反应,测定OD450nm值。
2.1.2 ELISA判定标准的确定 对105份BRV抗体阴性血清进行ELISA测定,其OD450nm平均值(X)为0.0987,标准差(SD)为0.0107,由此确定该ELISA方法的判定标准为X+3SD,即cut-off值为0.13。如果血清样品的OD450nm值>0.13为阳性,OD450nm值≤0.13为阴性。对大量被检血清样品的评估,确立了弱阳性、中等阳性及强阳性血清的判定标准,0.6≥OD450nm值>0.13的血清作为弱阳性血清;1.0>OD450nm值>0.6的血清作为中等阳性血清;OD450nm值≥1.0的血清作为强阳性血清。
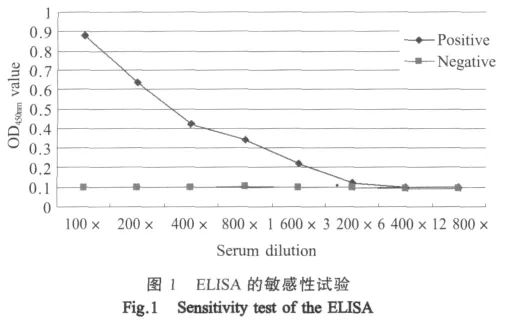
2.1.3 ELISA方法的敏感性试验 挑选OD450nm值>0.6的血清25份,0.6≥OD450nm值>0.13的血清18份,分别进行间接免疫荧光法检测。结果显示,OD450nm值>0.6的血清免疫荧光检测出23份阳性,0.6≥OD450nm值>0.13的血清免疫荧光检测出16份阳性,这两种方法的总复合率为91%。将阳性血清从100倍起连续2倍稀释进行ELISA检测,结果显示,阳性血清稀释1600倍时OD450nm值仍大于0.13,为阳性结果,而阴性血清OD450nm值始终低于0.1(图1),表明该ELISA方法具有较高的敏感性。
2.2 我国部分地区BRV感染率的调查和统计 用间接ELISA方法对采自12个不同地区的1760份血清样品进行检测,BRV抗体阳性血清1744份,总阳性率高达99%(表1)。采自不同地区的牛血清样品,抗体阳性率均在97%以上,其中河北、山西、云南、内蒙古、西藏、贵州的血清样品抗体阳性率高达100%;北京的血清样品最低,抗体阳性率也高达97.2%。这些数据表明,BRV在我国大部分地区呈普遍感染势态。
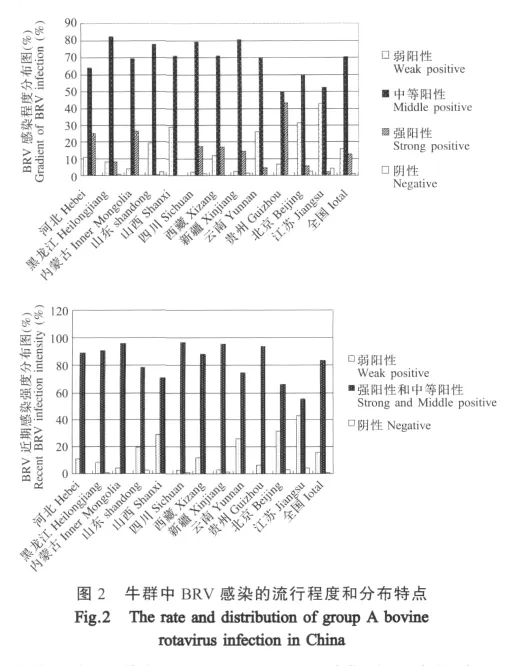
2.3 我国部分地区牛群中BRV的感染程度和分布特点 根据所检测的1760份牛血清抗体ELISA OD450nm值,本研究将OD450nm值划分为弱阳性抗体水平、中等阳性抗体水平及强阳性抗体水平3个范围,以便更直观地反应出这些地区BRV感染程度的不同。图2结果显示,大部分样品抗体水平属于中等阳性,其中黑龙江(82.3%)和新疆(80.8%)中等阳性血清比率最高,均超过80%;而中等阳性血清比率最低的为贵州省,其阳性率达50%;强阳性血清比率最高(43.4%)为贵州,其次是内蒙古(26.5%)和河北(25%),较低的是山东(0.5%)和山西(0)。
血清ELISA检测的OD450nm值越高,表明该地区在采集血清期间BRV的感染越严重。因此,将强阳性血清和中等阳性血清相加并与弱阳性血清、阴性血清的数量进行比较(图2),进而更清晰地反映出各省份近期BRV的感染和流行情况。从图中可以看出,所检测地区牛群的强阳性和中等阳性血清比率均超过了50%,其中黑龙江(90.7%)、内蒙古(95.9%)、四川(96.7%)、新疆(95.6%)、贵州(93.4%)均超过90%。最低的江苏省也达到了55.1%。上述结果表明,我国牛群中的BRV感染普遍且极为严重。

表1 我国部分地区牛血清BRV抗体的检测Table 1 Detection of the anti-group A bovine rotavirus antibodies in China
3 讨论
本研究对我国BRV感染进行首次大规模血清流行病学调查,虽然调查的范围并没有覆盖我国所有的省区,但选择的地域包含了我国的畜牧大省及牛群集中的地区,具有一定的代表性。由于我国没有BRV疫苗接种计划,所以不存在免疫接种来源的抗体,因此高水平抗体的存在可视为正在发生或曾经发生BRV感染。有文献报道,母猪感染RV后,哺乳仔猪血清中和母猪初乳中的抗体水平都很高,但在仔猪出生一个月之后其血清抗体则下降到很低的水平[8]。犊牛出生后血清中通过初乳获得的母源抗体在不经历再次感染的前提下能够持续多长时间,目前还没有详细的研究。但根据猪母源抗体资料判断,犊牛体内的母源抗体在出生后的一段时间内也会降到相对较低水平。本研究所采集的血清均为1岁~8岁的成年牛,1岁以上的牛如果还能够检测到较高水平的BRV抗体,应视为经历过BRV的感染。由此推断,本研究检测出的抗体尤其是中高水平的抗体是通过自然感染BRV而获得的,血清抗体的阳性率可以反映出BRV的感染情况。
由于环境中BRV的普遍存在,牛在生长期内会经历多次BRV的感染[9],所以牛群中血清抗体水平的高低可以反应出牛群BRV反复感染的频率。本研究结果显示,所调查的地区中大部分地区的中等阳性和强阳性血清所占比例达80%以上,表明BRV感染呈长期反复流行的状态,导致牛群的血清抗体处于较高的水平。
本研究通过对我国部分地区BRV感染的血清流行病学调查表明,BRV感染在我国牛群中普遍存在。根据本调查结果结合BRV的感染特点推断,我国牛群中不存在抗体阴性牛,只是不同地区抗体水平有所不同,本调查中检出的16头抗体阴性牛很可能来自澳大利亚进口牛。由于犊牛在出生后7 d内最为易感[10],而调查结果显示,在现地牛群中的BRV抗体水平又高低不同。因此,对我国犊牛BRV感染的免疫预防可给怀孕母牛在产前一段时间内注射疫苗,使母牛群体原本高低不等的血清抗体在产犊前跃升到同一水平,使整个犊牛群体在刚出生后的易感期内均能够获得足够的保护性抗体,从而实现对犊牛的有效保护。
[1]Penelope H,Dennehy R.Rotavirus vaccines-An update[J].Vaccine,2007,25:3137-3141.
[2]Shin-ichi I,Ningguo F,Bao Z T,et al.Quantification of systemic and local immune responses to individual rotavirus proteins during rotavirus infection in mice[J].J Clin Microbiol,1996,34(7):1694-1700.
[3]Reidy N,Lennon G,Fanning S,et al.Molecular characterisation and analysis of bovine rotavirus strains circulating in Ireland 2002-2004[J].Vet Microbiol,2006,117(2-4):242-247.
[4]Monini M,Cappuccini F,Battista P,et al.Molecular characterization of bovine rotavirus strains circulating in northern Italy,2003-2005[J].Vet Microbiol,2008,129(3-4):384-389.
[5]何孔旺,何家惠.我国动物轮状病毒研究概况[J].江苏农业科学,1994,4:61-63.
[6]常继涛,崔久辉,李建军,等.我国部分地区牛轮状病毒的病原学调查及一株G10P[11]型牛轮状病毒的分离鉴定[J].中国预防兽医学报,2008,30(10):755-759.
[7]Parreno V,Hodgins D C,de Arriba L,et al.Serum and intestinal isotype antibody responses to Wa human rotavirus in gnotobiotic pigs are modulated by maternal antibodies[J].J Gen Virol,1999,80(Pt 6):1417-1428.
[8]Fu Z F,Hampson D J,Wilks C R.Transfer of maternal antibody against group A rotavirus from sows to piglets and serological responses following natural infection[J].Res Vet Sci,1990,48(3):365-373.
[9]Cao D J,Blessing I,Yuan L J,et al.A longitudinal cohort study in calves evaluated for rotavirus infections from 1 to 12 months of age by sequential serological assays[J].Arch Virol,2009,154:755-763.
[10]Tzipori S R,Makin T J,Smith M L,et al.Clinical manifestations of diarrhea in calves infected with rotavirus and enterotoxigenicEscherichia coli[J].J Clin Microbiol,1981,13(6):1011-1016.
