鸢尾组织培养过程中根系的诱导与移栽试验
2010-07-31吴秋峰毛军平吴月燕
吴秋峰,毛军平,吴月燕
(1.浙江省兰溪市林业局,浙江 兰溪 321100;2.浙江万里学院 生物与环境学院,浙江 宁波 315100)
鸢尾属植物花姿奇特,花色艳丽而丰富,其品种繁多,适应性强,在园林中应用广泛,是绿化、美化和香化城市,装饰花坛、花径、花带、路旁及草坪的优良材料。全世界鸢尾属植物300种以上,我国约有60种,13个变种以及5个变型,约占全球鸢尾属植物的1/5,主要分布在西南、西北及东北[1]。国内鸢尾种苗多数从国外引进,数量少,并且有很多品种不能形成种子,分株繁殖率较低,通过组织培养快速繁殖是尽快满足应用需求的最为有效的途径[2]。目前,国内对香根鸢尾、荷兰鸢尾、德国鸢尾、蝴蝶花、杂种鸢尾和有髯鸢尾的等组织培养均已获得成功。虽然目前国内外对鸢尾属一些植物的组织培养与快速繁殖已经有成功报道,但由于鸢尾属植物不同品种组织培养和快速繁殖所需要的条件差异比较大,因此,对一些新品种进行组织培养和繁殖方面的研究十分必要。路易斯鸢尾原产美国路易斯安那州,在宁波市气候条件下为常绿水生 (湿生)植物,具有较高的观赏价值以及在污染水体或湿地的环境的重建中具有重要的应用价值,近几年在浙江省逐渐推广。路易斯鸢尾在自然条件下,以分株或种子繁殖为主,繁殖率较低,限制了品种的推广。我们在获得组织培养无根苗的基础上,选择不同的培养基、激素配比和添加剂进行生根试验以及组培苗的移栽试验。以选择路易斯鸢尾组织培养过程中生根的最佳配比和组培苗移栽的最佳环境条件,为路易斯鸢尾的快速繁殖提供途径。
1 材料与方法
1.1 材料
试验于2009年3月进行。在路易斯鸢尾组织培养愈伤诱导和芽分化成功试验的基础上,选取高度在5~6 cm,粗细均匀的路易斯鸢尾组培苗作为根系诱导的材料,并以生根的组培苗作为炼苗材料;以高度14~15 cm,粗细均匀,根数在4~5条的生根苗作为移栽材料。
1.2 试验设计
1.2.1 生长调节剂种类和浓度试验
根据董然等[3-17]研究和前期试验的结果,选MS为基本培养基,采用不同浓度的植物生长调节剂 (萘乙酸NAA,吲哚丁酸IBA,吲哚乙酸 IAA,6-苄氨基嘌呤 6-BA),进行 3水平 4因素的 L9(34)正交试验 (表1)。
1.2.2 炼苗试验
选取培养30 d的生根组培苗作为试验对象。将生根苗的瓶口打开,取出生根苗,用清水冲洗根部培养基后,移植到装有50 mL营养液 (含0.1%的尿素和0.2%KH2PO4)的瓶子中,每瓶1株,每次处理为10瓶,重复3次。分别在人工气候箱中设置条件和室温自然条件下炼苗,炼苗时间为7 d。人工气候箱培养条件为温度20~25℃,光照强度2 000 lx,光照时间12 h·d-1;自然培养条件为培养温度7~16℃,自然光。
1.2.3 移栽试验
炼苗结束后,选取生根苗高度在18~20 cm的生根苗进行移栽试验。移栽时轻轻取出生根苗,洗净根部营养液,分别移栽到泥炭∶珍珠岩∶蛭石3∶3∶4加适量缓释复合肥 (C1)、河沙 (C2)和粘质黄土 (C3)3种不同基质的无纺布网袋容器中,容器直径为5~10 cm,高度为10~15 cm。移栽前基质经过消毒,然后立即浇清水,移栽,自然条件下培育。

表1 各因素水平及其处理组合
1.3 统计方法
试管苗生根培养过程中观测不同处理根系的生长状况,18 d开始统计生根培养基的接种数、生根开始时间、平均每株的生根数、平均长度和生根率等,观测的结果用 DPS数据处理系统软件进行分析。对生根苗进行炼苗试验过程中每天观察植物的形态特征变化,至7 d时统计不同处理根的长度、成活株数和成活率。生根苗移栽后每隔5 d观测植株的生长变化,30 d时开始统计生根苗的生长状况、成活株数和成活率。
以上组织培养过程中根系诱导条件为培养室温度 (25±2)℃,光照强度2 000 lx,光照时间11 h·d-1。
2 结果与分析
2.1 不同生长调节剂配比对生根的影响
无根组培苗接入到生根培养基上10~13 d根的基部发生变化,开始生根,并逐渐生长增大,但不同生长调节剂对路易斯鸢尾生根诱导的作用存在差异性。在9个处理组合中,A9、A8、A6和 A7生根诱导率高于其它组合的诱导率,诱导率分别达到83.3%、76.7%、70.0%和66.7%,其中以A9最高,因此,试验结果最佳生根诱导培养基为MS+NAA 1.0 mg·L-1+ IBA 1.0 mg·L-1+ IAA 0.5 mg·L-1+6-BA 0.2 mg·L-1。A1 和 A2 组合的生根率较低,其中A1的生根率为36.7%,低于其它8个组合 (表2)。

表2 各处理组合对生根诱导的影响
通过DPS数据处理系统Duncan新复极差法分析得出,在4个因素3个水平中,NAA和IBA在水平3时均值最大,IAA和6-BA在水平1时均值最大;不考虑4个因素中各因子之间的交互作用,NAA的均方高于其它3种生长调节剂,IBA次之,6-BA最小,因此,在4个因素中,NAA对路易斯鸢尾生根诱导影响最大,IBA次之,6-BA最小。计算机分析结果路易斯鸢尾生根诱导最佳培养基也为 MS+NAA 1.0 mg·L-1+IBA 1.0 mg·L-1+IAA 0.5 mg·L-1+6-BA 0.2 mg·L-1,与试验结果相符。
2.2 不同环境对炼苗成活的影响
人工气候箱炼苗的植株,根系较长,较细,侧根较多,平均根长为3.2 cm,成活率为93.3%;室温条件下的植株根系稍短,较粗,侧根较多,平均根长为2.9 cm,成活率为90.0%。综合分析,在人工气候箱恒温条件和室温条件下炼苗无明显差异,在2种环境下炼苗不存在显著性差异,因此,可以选择在自然条件下炼苗 (表3)。

表3 不同环境炼苗对生根成活的影响
2.3 不同栽培基质对生根苗成活的影响
将生根苗分批次移栽到3种不同配比的基质中,试验结果 (表4)表明,在泥炭∶珍珠岩∶蛭石3∶3∶4加适量缓释复合肥栽培基质下,生根苗植株的成活率最高,达到93.3%,高于其它2种组合,苗生长健壮和茂盛;在河沙栽培基质中,生根苗植株的成活率为76.7%,在粘质黄土栽培基质下,生根苗植株的成活率为66.7%,苗生长细弱。
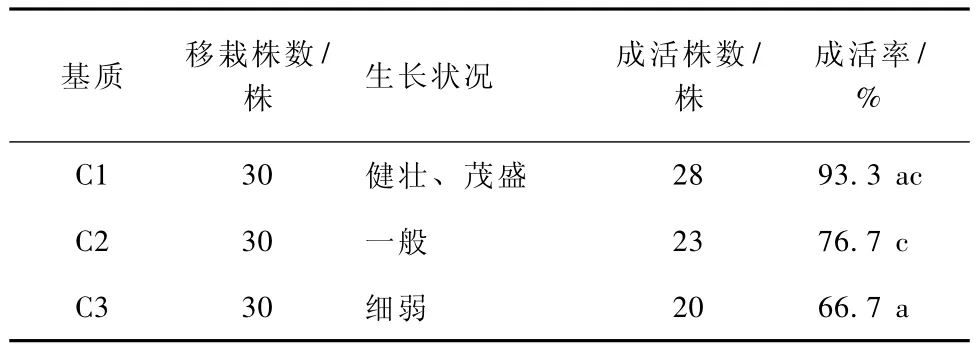
表4 不同栽培基质对移栽生根苗成活的影响
4 小结与讨论
路易斯鸢尾组织培养过程中最高生根率为83.3%,最低生根率仅36.7%,最佳生根培养基和生长调节剂配比为 MS+NAA 1.0 mg·L-1+IBA 1.0 mg·L-1+IAA 0.5 mg·L-1+6-BA 0.2 mg·L-1。影响根系诱导的主要因素为生长调节剂的种类和浓度。在NAA、IBA、IAA和6-BA 4个因素中,NAA和IBA生理作用主要为促进细胞伸长生长、细胞分裂、诱导愈伤组织形成和促进生根,IAA主要促进细胞伸长生长,6-BA主要促进细胞分裂和器官分化为不定芽[15]。本试验中对路易斯鸢尾生根诱导影响最大为 NAA,其次为 IBA,而IAA和6-BA影响最小,这与在其它植物中研究结论相似[18-19]。另外,本试验研究中发现,较高浓度供试浓度的NAA和IBA以及较低浓度供试浓度的IAA和6-BA有利于根的生长。
在炼苗试验过程中,试管苗的成活率受诸多因素的影响,但路易斯鸢尾对环境适应性较强。本试验中发现在自然条件下和在人工气候箱条件下炼苗的成活率无明显差异,表明路易斯鸢尾对炼苗环境要求不严格,因此可以选择在自然条件下炼苗。
路易斯鸢尾移栽成活在很大程度上取决于栽培基质,3种不同栽培基质对植株成活率影响不同。应选择易取得,好用、通风排水佳、不易酸化腐烂和易植且便宜的栽培基质[20-21]。泥炭∶珍珠岩∶蛭石3∶3∶4加适量的缓释复合肥栽培基质是3种中最符合这一条件,透气性好,呈弱酸性,不易腐烂;河沙营养贫瘠,透气性好,呈中性,不易腐烂;粘质黄土,营养一般,透气性差,呈中性,不易腐烂。在本试验中泥炭∶珍珠岩∶蛭石3∶3∶4加适量的缓释复合肥作为栽培基质,移栽的成活率取得最好,达到了93.3%高于其它处理,这样的配比很好地协调了营养、透气性、酸性等方面的问题,是鸢尾生根苗移栽的理想基质。而河沙作为基质,生根苗移栽成活率为76.7%,生根苗在前期生长良好,但到了后期因为营养的缺乏,造成了生根苗的枯死。而在粘质黄土中生长的生根苗,移栽成活率只有66.7%,研究表明,移栽过程中,透气性差不利于生根苗的生长,如果没有很好的透气性,将直接影响植株呼吸作用,影响整个植株的生长,同时,不同光照和温度也会对移栽苗成活造成一定的影响。
在根系诱导过程中,由于培养基成分、培养环境、生长激素和碳水化合物等各种因素而引起的组培苗失活[15],部分叶片顶端或整株黄化,这一现象在植物组织培养中尤其是花卉中比较常见。本试验根系诱导30 d,发现部分生根苗顶端出现黄花现象。造成这一现象的主要原因是培养基中营养缺失,未能正常供给生根苗正常生长。因此,在生根培养30 d后,需要一个转接过程,转接到新的培养基中继续培养或者进行炼苗试验。生根苗炼苗是苗移栽前的一个过渡过程,让生根苗在外界环境条件下生长的一个适应过程。在本试验炼苗试验过程中,不同环境的炼苗对生根苗成活没有显著性差异,表明生根苗在移栽前不需要人工气候箱中炼苗,可以直接在自然条件下炼苗,说明路易斯鸢尾生根苗生长成活和适应强。在移栽试验过程中,需要注意以下几点:注意培养基质的酸碱性,偏酸性条件下有利于鸢尾植株的生长;无纺布网袋容器的排水性和透气性要好;选择光照充足的地方进行栽培,因为光照是影响路易鸢尾生长的重要因素,光照充足有利于叶片生长和根对营养吸收;温度也是影响鸢尾植株苗成活的一个重要因素,温度过高或过低都不利于植株生长,路易斯鸢尾6~35℃都可以生长。
[1]黄苏珍,韩玉林,谢明云,等.中国鸢尾属观赏植物资源的研究与利用 [J].中国野生植物资源,2003,22(1):4-7.
[2]吴月燕,毛军平,周倩倩.路易斯鸢尾组织培养过程中愈伤组织的诱导和芽的分化 [J].浙江农业科学,2009(1):86-89.
[3]董然,,赵坚洁.鸢尾属花卉研究进展与应用开发 [J].北方园艺,2006(2):86-89.
[4]刘青林,吴涤新,田砚亭.鸢尾体细胞无性系的建立与变异 [J].西北植物学报,1994,14(4):267-272.
[5]袁梅芳,顾炜.球根鸢尾的离体培养和试管成球 [J].植物生理学通讯,2002,3(2):28-29.
[6]黄洁,马登萍.德国鸢尾的组织培养试验 [J].青海农业科技,2008(1):15-16.
[7]李雪莹.鸢尾属 (Iris L)部分植物组织培养及耐荫性的研究 [J].园林植物与观赏园艺,2007(3):23.
[8]江明,谢文申.香根鸢尾的组织培养和快速繁殖 [J].园艺学报,1995,22(3):301-302.
[9]黄苏珍,韩玉林,佟海英,等.荷兰鸢尾的组织培养[J].植物资源与环境学,1999,8(3):48-52.
[10]黄苏珍,韩玉林,谢明云,等.德国鸢尾的组织培养[J].江苏林业科技,2000,27:37-44.
[11]张金政,石雷,王平,等.有髯鸢尾“常春黄”的组织培养 [J].植物生理学通讯,2004,40(2):210.
[12]黄苏珍,韩玉林,谢明云,等.杂种鸢尾的组织培养和植株再生 [J].植物生理学通讯,2003,39(6):638.
[13]Gozu Y, Yokoyama M, Nakamura M, etal. In vitro propagation of Iris pallida [J].Plant Cell Reports,1993,13(1):12-16.
[14]Laublin G, SainiH S, Cappadocia M. In vitro plant regeneration via somatic embryogenesis from root culture of some rhizomatous irises [J].Plant Cell Tissue and Organ Culture,1991,27(1):15-21.
[15]唐道城,梁顺祥.观赏植物组织培养研究进展 [J].青海大学学报,2006,24(4):5-9.
[16]牟少华,郄光发,彭镇华,等.我国鸢尾属植物种质资源的研究与利用 [J].草业科学,2007,24(8):21-24.
[17]陈德芬,杨焕婷,马钟艳.外源激素对鸢尾组织培养的影响 [J].天津农业科学,1997(9):18-20.
[18]杨玉萍,韦鹏霄,岑秀芬.不同诱导培养基对冬小卖组织培养效果的影响 [J].新乡师范高等专科学校学报,2007,21(2):56-60.
[19]周晓燕,赵小梅,廉玉姬.马铃薯大西洋组培苗的生根诱导及移栽 [J].广西农业科学,2006,8(4):145-147.
[20]吴月燕,刘秀莲,汪财生.乐昌含笑组织培养过程中根的诱导 [J].园艺学报,2007,34(4):991-994.
[21]黄建,林霞,张庆,等.蝴蝶兰激素处理与生长状况相关性研究 [J].浙江农业科学,2008(1):34-37.
