Al2O3负载催化空气氧化3-氧代-α-紫罗兰酮合成 1-羟基-4-氧代-α-紫罗兰酮
2010-07-31唐瑞仁李菲张瑞荣周亚平
唐瑞仁,李菲,张瑞荣,周亚平
(中南大学 化学化工学院,湖南 长沙,410083)
1-羟基-4-氧代-α-紫罗兰酮是合成稀有香料脱落酸的重要中间体[1-2],也是一种重要的香料[3],被广泛地用于食品、化妆品等行业[4]。其合成通常以 α-紫罗兰酮或3-氧代-α-紫罗兰酮为原料,通过氧化得到。有专利报道[5]:在强碱叔丁醇钾体系中,以二甲亚砜为溶剂,可将3-氧代-α-紫罗兰酮氧化为1-羟基-4-氧代-α-紫罗兰酮,产率只有35%;Bum等[6]用叔丁基铬酸盐为氧化剂,将 α-紫罗兰酮直接被氧化为 1-羟基-4-氧代-α-紫罗兰酮,总收率达41%,或用三氧化铬为氧化剂,收率为27%。但是,上述反应普遍存在反应条件苛刻,需使用金属铬或强碱等对环境造成污染的试剂等问题,影响其应用范围。氧化铝是一种被广泛使用的吸附剂和固体酸碱催化剂[7],其吸附活性和催化功能在表面部分脱羟基后显露出来[8]。目前,有关Al2O3催化氧化的报道并不多,谷源鹏等[9]用酸性氧化铝做催化剂,以过氧化氢为氧化剂对蓖麻油进行环氧化,反应克服了硫酸等催化剂在环氧化过程中需加添加剂、存在副反应和后处理繁琐等不利因素,所得产物的环氧值高;张勇等[10]以浸渍法制备的 Al2O3负载金属氧化物为催化剂,丙酮为溶剂,用氧气氧化巴豆醛制备巴豆酸,克服了生产成本高、反应条件苛刻、分离困难、环境污染严重等缺点。本文作者在前期开展紫罗兰酮等化合物烯丙位氧化工作基础上[11-15],采用廉价、绿色的空气作氧化剂,在温和的条件下,将反应底物3-氧代-α-紫罗兰酮负载吸附在三氧化铝上,之后缓慢通入空气将 3-氧代-α-紫罗兰酮氧化制备 1-羟基-4-氧代-α-紫罗兰酮。考察反应温度、反应时间、Al2O3用量、Al2O3酸碱性等对反应的影响,优化反应工艺条件。
1 实验部分
1.1 试剂和仪器
试剂为:3-氧代-α-紫罗兰酮(自制);薄层色谱板(GF-254,德国Merck公司生产);其他试剂,均为市售分析纯或化学纯试剂。
仪器为:Varian INOVA-300 MHz型核磁共振仪(美国Varian公司生产),TMS为内标,CD3Cl为溶剂;Agilent GC-MS 6890-5973型气相色谱-质谱联用仪(美国安捷公司生产)。
1.2 3-氧代-α-紫罗兰酮的空气氧化
在100 mL圆底烧瓶中,将10.0 g (0.052 mol)3-氧代-α-紫罗兰酮用适量正己烷溶解,加入一定量的中性或碱性柱层析Al2O3,在室温下充分搅拌30 min,减压蒸馏除溶剂后,3-氧代-α-紫罗兰酮吸附在 Al2O3上,静置12 h;转移至色谱柱中,通过空气压缩机从上端缓慢通入空气,空气流量为0.6 MPa/min,进行催化氧化反应。反应一定时间后,定时取出少量吸附在Al2O3上的反应物,用体积比为5∶1的 CHCl3-CH3OH浸泡,洗脱吸附在Al2O3上的有机物,用GC-MS检测,跟踪反应进程(见图1)。反应完成后,用CHCl3-CH3OH混合溶剂洗涤 Al2O3,使反应产物转移至溶剂中进行分离,减压蒸馏除去溶剂得产物1-羟基-4-氧代-α-紫罗兰酮,产物用 GC-MS进行定性和定量检测。根据气相色谱中各物质峰面积计算反应的转化率及各产物的产率。
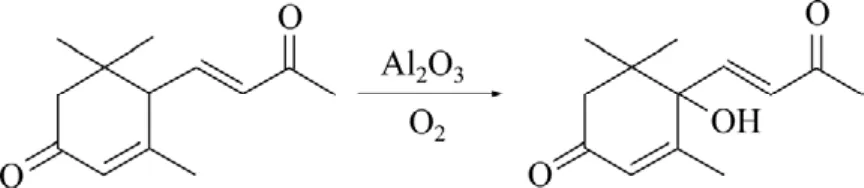
图1 空气氧化3-氧代-α-紫罗兰酮制备1-羟基-4-氧代-α-紫罗兰酮Fig.1 Preparation of 1-hydroxy-4-oxo-α-ionone from 3-oxo-α-ionone oxidized by air
反应物3-氧代-α-紫罗兰酮保留时间为19.26 min,产物 1-羟基-4-氧代-α-紫罗兰酮的保留时间为 16.2 min。粗产品用CHCl3-CH3OH重结晶,得白色固体,沸点为68~70 ℃;MS(m/z):220(M+),207,180,166,124,43(见图 2);1HNMR:δ1.027(s, 3H, CH3),δ1.111(s,3H, CH3),δ1.890(s, 3H, CH3),δ2.309(s, 3H, CH3),δ2.367(d, 1H,J=9.0 Hz),δ2.535(d, 1H)和δ2.478(d, 1 H),δ5.960(d, 1H,J=2.4 Hz),δ6.470(d, 1H,J=15.6 Hz)和δ6.840(d, 1H,J=15.6 Hz)。
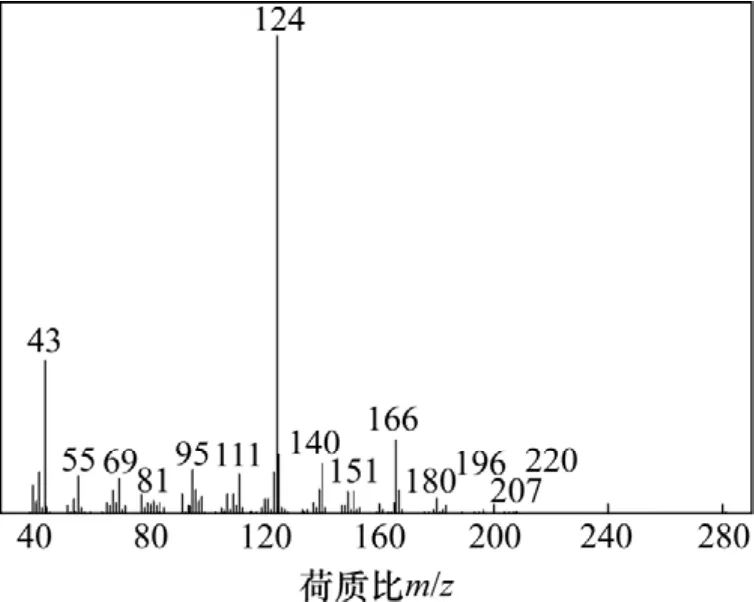
图2 1-羟基-4-氧代-α-紫罗兰酮的质谱图Fig.2 MS spectrum of 1-hydroxy-4-keto-α-ionone
1.3 色谱条件和质谱条件
1.3.1 色谱条件
采用 HP-Ultra2毛细管色谱柱;柱温采取程序升温:初温为100 ℃,保持1 min后,以8 ℃/min 的速度升温至280 ℃,在280 ℃保留2 min,进样口温度为250 ℃,质谱接口温度为280 ℃;载气为高纯氦气,进样体积为1.0 µL;柱流速为1.0 mL/min;分流进样,分流比为 20∶1。
1.3.2 质谱条件
连接杆温度为250 ℃;电离方式为电子轰击(EI),电离能量为70 eV;离子源温度为200 ℃;检测器电压为1 kV;溶剂延时3 min;扫描范围为m/z=50~550。
1.4 产率计算
采用内标法,根据产物的气相色谱图中各物质峰面积计算转化率及收率,根据分离后所得产物纯品的质量计算其产率。设定总的峰面积为 100,计算公式如下:
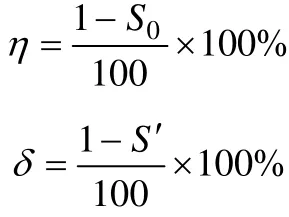
其中:η为转化率,%;S0为氧代-α-紫罗兰酮的峰面积;δ为收率,%;S′为 1-羟基-氧代-α-紫罗兰酮的峰面积。
2 结果与讨论
2.1 Al2O3用量对收率的影响
Al2O3在本反应中既作为反应物的载体,也作为反应的催化剂。实验首先考察了Al2O3与3-氧代-α-紫罗兰酮的质量分数比w(Al2O3)∶w(3-氧代-α-紫罗兰酮)分别为 35∶1,35∶2,10∶1,7∶1 和 4∶1 时对反应结果的影响,结果如表1所示。由表1可知:随着w(Al2O3)∶w(3-氧代-α-紫罗兰酮)的增加,反应的转化率和 1-羟基-4-氧代-α-紫罗兰酮的产率大体上增加,当w(Al2O3)∶w(3-氧代-α-紫罗兰酮)由 7∶1 增加到 10∶1 时(实验 3~7),在相同反应时间内,变化最明显,反应的转化率和1-羟基-4-氧代-α-紫罗兰酮的收率和转化率分别由46.1%,58.2%,增加到 86.1%和 92.8%;当w(Al2O3)∶w(3-氧代-α-紫罗兰酮)≥10∶1 时,反应 13~20 h,反应效果相差不大(实验1~4),其转化率最高可达到100%,1-羟基-4-氧代-α-紫罗兰酮的收率为 84.2%以上;当w(Al2O3)∶w(3-氧代-α-紫罗兰酮)为 4∶1 时,反应物 Al2O3表面吸附的分散度很小,反应难以进行,其转化率和收率仅为 42.9%和 6.1%。Al2O3的用量越多,3-氧代-α-紫罗兰酮在其表面吸附分散得越好,同时与空气接触的机会越多,故 Al2O3催化性能越强,反应的转化率和收率增加。Al2O3的大量使用,对反应效果没有很明显的改善,且造成不必要的浪费。实验表明:在w(Al2O3)∶w(3-氧代-α-紫罗兰酮)达到 10∶1 时,反应20 h左右,反应转化率接近100%。最后,确定Al2O3的用量为w(Al2O3)∶w(3-氧代-α-紫罗兰酮)=10∶1。

表1 Al2O3用量对氧化反应的影响Table 1 Influence of amount Al2O3 on oxidation reaction
2.2 Al2O3的酸碱性对反应的影响
氧化铝的活性与氧化铝表面的酸碱性有关。有研究[8]表明:酸性部位的数量和它们的酸强度是影响氧化铝催化活性的重要因素。市售不同类型的氧化铝催化3-氧代-α-紫罗兰酮氧化反应的结果如表2所示。结果表明:当w(Al2O3)∶w(3-氧代-α-紫罗兰酮)为 10∶1 时,分别使用碱性和中性 Al2O3,在相同反应时间内,反应的转化率和产物的收率相近,收率均为85%左右(实验1和2);而用酸性Al2O3负载3-氧代-α-紫罗兰酮时,在相同条件下,反应的转化率和目标产物的收率都减少(实验3)。酸性氧化铝与碱性氧化铝的主要差异在于酸性氧化铝的碱中心基本被屏蔽,这说明碱性中心在3-氧代-α-紫罗兰酮氧化反应中表现出较强的催化作用。因此,选用中性或碱性的 Al2O3作为氧化反应的载体。
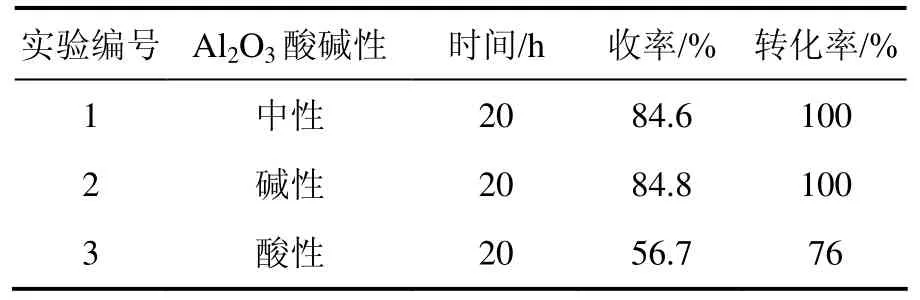
表2 Al2O3类型对氧化反应的影响Table 2 Influence of type of Al2O3 on oxidation reaction
2.3 Al2O3颗粒大小对反应的影响
分别使用颗粒粒径为 18.8,37.5~75.0和 75.0~112.5 µm的Al2O3进行实验,发现Al2O3颗粒粒径对反应有一定影响:Al2O3颗粒粒径太大,其比表面积小,底物难以吸附上去,反应无法进行;虽然 Al2O3颗粒粒径越小,其比表面积越大,反应物在 Al2O3表面分散得越好,其催化性能可能越强,但当使用粒径为75.0~112.5 µm的Al2O3时,空气通过Al2O3速度较慢,使反应不能进行;当选用粒径为37.5~75.0 µm的Al2O3时,底物的吸附较好且空气通过顺畅,故粒径为37.5~75.0 µm的Al2O3是较为适合的。
2.4 空气湿度对反应的影响
空气湿度对反应有较大的影响,主要表现在当空气比较潮湿、空气中水分含量较大时,反应速率较快,在相同的反应时间内,转化率较高。这可能是因为:催化剂氧化铝碱中心量随着水含量的增加而增加,当吸附水达一定值后,导致碱性中心表现出较高的活性[16]。当w(Al2O3)∶w(3-氧代-α-紫罗兰酮)=10∶1 时,分别导入经浓硫酸干燥和未经干燥的空气,实验结果如表3所示。结果表明:当空气经干燥时,反应转化率和产物收率都降低,反应难以进行(实验4~6);而未经干燥时,收率可达到 80%左右(实验 1~2)。因此,选择未经干燥的空气为氧化剂。
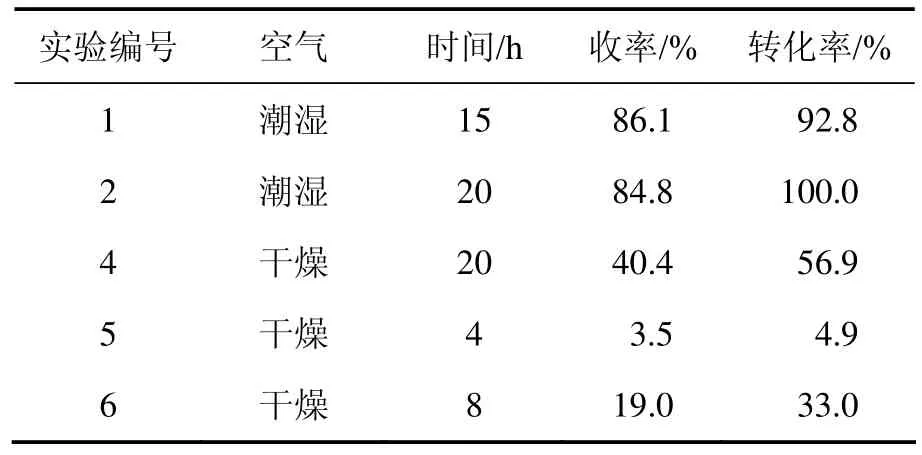
表3 空气湿度对氧化反应的影响Table 3 Influence of humidity of air on oxidation reaction
2.5 温度对反应的影响
以粒径为37.5~75.0 µm的中性或碱性Al2O3为催化剂,当w(Al2O3)∶w(3-氧代-α-紫罗兰酮)=10∶1 时,分别在25 ℃和60 ℃水浴温度下反应,考察温度对实验结果的影响。导入未经干燥的空气,反应4 h,在60 ℃时,1-羟基-4-氧代-α-紫罗兰酮的收率为37.0%,比25℃时的收率高0.2%。这说明在不同反应温度下,Al2O3催化性能相似,对反应的影响远远小于空气湿度对反应的影响。因此,选择在室温下进行反应。以氧化铝为催化剂,H—H键的活化(键解离)在78~150 K即能进行;C—H键的活化(如双键异构化)在300 K就能进行;在氧化铝表面,室温就能使烷烃的C—H键解离。因此,在理论上说,碱性氧化铝完全有可能在室温下有效地催化反应的进行。同时,反应在室温下进行,便于操作。
2.6 反应时间对反应的影响
分别在不同的反应时间段,取产物进行 GC-MS检测,考察时间对反应的影响,结果如表4所示。从表 4 可见:当w(Al2O3)∶w(3-氧代-α-紫罗兰酮)为 10∶1时,随着反应的进行,反应的转化率和产物的收率逐渐增加,前8 h增加最为明显;8 h后,反应转化率达83.6%,1-羟基-4-氧代-α-紫罗兰酮的收率达 69.6%;随着反应的进行,吸附于Al2O3上的3-氧代-α-紫罗兰酮浓度减小,与空气的接触机会减小,反应速率减慢;8 h后,目标产物收率增幅趋于缓和,反应速率减慢;反应15 h,转化率和收率分别为92.8%和86.1%,与12 h反应的结果(89.7%和83.6%)相比,增幅不大;15 h以后,反应进行很慢,当反应20 h时,收率几乎不变。因此,确定15~20 h为合适的反应时间。
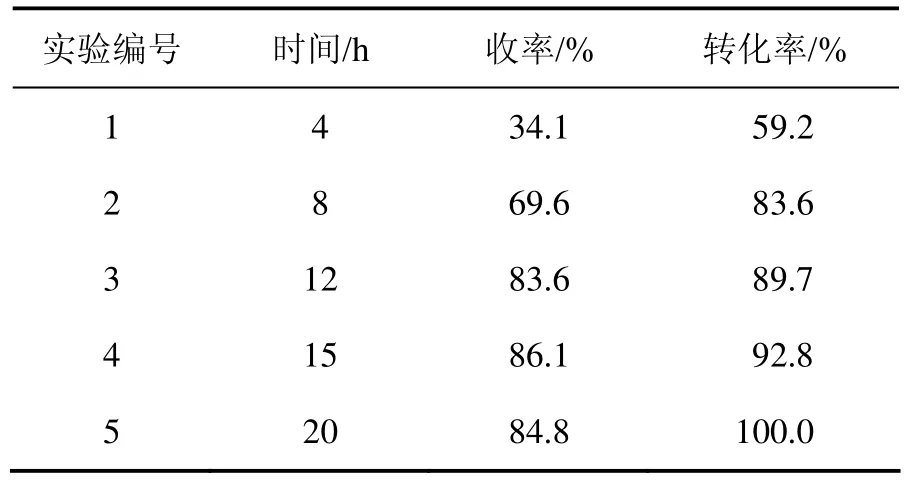
表4 反应时间对氧化反应的影响Table 4 Influence of reaction time on oxidation reaction
2.7 Al2O3的回收与套用
Al2O3干燥活化后重复使用,当反应20 h后,反应转化率可达100%,当使用次数分别为1, 2, …, 6次时,目标产物的收率分别为 85.1%, 86.4%, 87.9%,88.0%, 88.3%和87.6%,表明Al2O3的重复使用性很好。回收利用后,Al2O3的催化和吸附性能未减弱或失活,反而随重复次数的增加,收率略有提高,可能因为搅拌过程中,Al2O3颗粒粒径变小,其比表面积增加,更有利于反应物的吸附,Al2O3催化性能反而增强。
3 反应催化机理探讨
氧化铝表面的Bronsted酸性很弱,但Lewis酸性很强,因此,氧化铝表面酸主要是Lewis酸。这主要是由于脱水的氧化铝表面产生了歪扭的 Al—O—Al键。在形成Lewis酸中心的同时,生成的表面O离子起到碱中心作用。也就是说,Lewis酸中心越多,对应的碱中心也越多。氧化铝水合物经脱水而产生Lewis酸中心及碱中心,这一过程可用图3进行描述。反应过程中,3-氧代-α-紫罗兰酮被吸附于碱性氧化铝的活性部位,碱中心进攻反应物活性H部位,再在氧气条件下进行自由基反应产生 1-羟基-4-氧代-α-紫罗兰酮。此过程可由图4来描述。
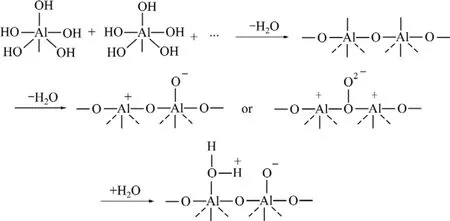
图3 氧化铝表面酸中心和碱中心的形成Fig.3 Forming of acidic core and basic core on surface of Al2O3 gel
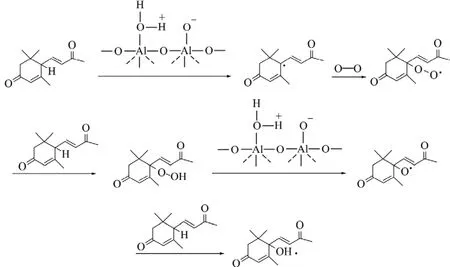
图4 氧化铝负载催化氧化3-氧代-α-紫罗兰酮为1-羟基-4-氧代-α-紫罗兰酮Fig.4 Catalytic oxidation of 3-oxo-α-ionone to 1-hydroxy-4-oxo-α-ionone supported on Al2O3
4 结论
(1)以廉价、清洁、环境友好型的空气为氧化剂,以颗粒粒径为37.5~75.0 µm的中性或碱性Al2O3为载体进行催化氧化,w(Al2O3)∶w(3-氧代-α-紫罗兰酮)为10∶1,室温下通未经干燥的空气反应20 h,3-氧代α-紫罗兰酮的转化率接近100%,产物1-羟基-4-氧代-α-紫罗兰酮的收率达85%以上。
(2)产物经体积比为5∶1的CHCl3-CH3OH混合溶剂洗脱与催化剂分离,Al2O3活化后,重复使用性好。
[1] 吴清来, 毛淑芬, 谭兆海. 脱落酸的合成[J]. 化学通报,2004(10): 729-736.WU Qing-lai, MAO Shu-fen, TAN Zhao-hai. Synthesis of abscisic acid[J]. Huaxue Tongbao, 2004(10): 729-736.
[2] Asami T, Sekimata K, Wang J M. Preparation of (±)-[1,2-13C2]abscisic acid for use as a stable and pure internal standardy[J]. Journal of Chemical Research(Synopses), 1999(11):658-659.
[3] 黄致喜, 王慧辰. 萜类香料化学[M]. 北京: 中国轻工业出版社, 1999: 496-497.HUANG Zhi-xi, WANG Hui-chen. Terpene perfumechemistry[M]. Beijing: China Light Industry Press, 1999:496-497.
[4] 刘大雄, 李卫东. 紫罗兰芳香化合物的合成与应用[J]. 广西化工, 1991, 4: 19-23.LIU Da-xiong, LI Wei-dong. Synthesis and application of ionone complexes[J]. Guangxi Chemical, 1991, 4: 19-23.
[5] Heckman A R. Oxidation of α-ionone: US, 50096[P].1969-06-17.
[6] Bum T K, Yong K M. Synthesis of 2-fluoroabscisic acid: A potential photo-stable abscisic acid[J]. Tetrahedron Letters, 1997,38(10): 1797-1800.
[7] 李传润, 冯乙己. 介孔氧化铝的研究进展[J]. 化学进展, 2006,18(11): 1482.LI Chuan-run, FENG Yi-ji.The Research progress of mesoporous alumina[J]. Progress in Chemistry, 2006, 18(11): 1482.
[8] 张志强, 苏志国. 氧化铝催化 7-表-紫杉醇转化为紫杉醇的机理探索[J]. 生物工程学报, 2000, 16(3): 378-382.ZHANG Zhi-qiang, SU Zhi-guo. Studies of the mechanism of 7-epi-taxol converted to taxol from taxus extract catalyzed with Al2O3[J].Chinese Journal of Biotechnology, 2000, 16(3):378-382.
[9] 古源鹏, 李晓辉. 氧化铝催化蓖麻油的环氧化[J]. 辽宁师范大学学报, 2002, 25(3): 285-287.GU yuan-peng, LI Xiao-hui. The catalysis of Al2O3in the epoxielation castor oic[J]. Journal of LiaoNing University, 2002,25(3): 285-287.
[10] 张勇, 蔡哲斌. 金属氧化物/活性氧化铝催化氧化巴豆醛制备巴豆酸[J]. 精细石油化工进展, 2007, 8(12): 22-30.ZHANG Yong, CAI Zhe-bin. Research progress on preparation and catalytic performance of chitosan-supported catalysts[J].Advances in Fine Petrochemicals, 2007, 8(12): 22-30.
[11] GONG Nian-hua, TANG Rui-ren, ZHOU Ya-ping, et al.Solvent-free aerobic chemoselective oxidation of β-ionone catalyzed by N-hydroxyphthalimide/Co(acac)2[J]. Synthetic Communication, 2008, 38(7): 1020-1027.
[12] 唐瑞仁, 刘长辉, 罗一鸣, 等. 组胺酸水杨醛 Schiff碱铜(Ⅱ)配合物催化氧化 β-紫罗兰酮的反应研究[J]. 应用化学, 2006,36(6): 718-722.TANG Rui-ren, LIU Chang-hui, LUO Yi-ming, et al. Studies on the catalytic oxidation of β-ionone to oxo-β-ionone[J]. Apply Chemistry, 2006, 36(6): 718-722.
[13] 刘长辉, 唐瑞仁, 罗一鸣, 等. 乙酰丙酮合铜(Ⅱ)催化合成 3-氧代-α-紫罗兰酮[J]. 应用化学, 2008, 25(5): 622-625.LIU Chang-hui, TANG Rui-ren, LUO Yi-ming, et al. Synthesis of 3-oxo-α-ionone from α-ionone oxidized with oxygen catalyzed by Cu(acac)2[J]. Apply Chemistry, 2008, 25(5):622-625.
[14] TANG Rui-ren, ZHOU Ya-ping, GONG Nian-hua, et al. Aerobic oxidation behavior of α-ionone catalyaed by N-hydroxyphthalimide combined with, acetylacetone cobalt(Ⅱ)[J]. Journal of Central South University of Technology,2008, 15(4): 474-478.
[15] 罗一鸣, 刘长辉, 唐瑞仁, 等. 氯酸钠氧化法合成4-氧代-β-紫罗兰酮[J]. 中南大学学报: 自然科学版, 2006, 37(3): 521-526.LUO Yi-ming, LIU Chang-hui, TANG Rui-ren, et al. Synthesis of 4-oxo-β-ionone by oxidation of sodium chlorate[J]. Journal of Center South University: Science and Technology, 2006, 37(3):521-526.
[16] 田部浩三, 御圆生诚, 小野嘉夫. 新型固体酸和碱及其催化作用[M]. 郑禄彬, 等, 译. 北京: 化学工业出版社, 1992:66-67.Tanabe K, Makoto M, Yoshio O. New-style solid acid and base and their catalysis[M]. ZHENG Lu-bin, et al, translation. Beijing:Chemical Industry Press, 1992: 66-67.
