毛细管电泳/柱端安培检测血清中谷氨酰胺
2010-07-26刘大星王修德刘延秋
刘大星,王修德,刘延秋
谷氨酰胺(glutamine,Gln)是一种具有特殊营养作用的“条件必需氨基酸”[1],作为体内含量最丰富的氨基酸,体内谷氨酰胺代谢的恒定对许多疾病的发生与发展有密切联系[2]。快速而有效地测定血中的谷氨酰胺对于谷氨酰胺代谢有关疾病以及临床肠内外营养研究等方面具有重要意义。目前测定谷氨酰胺常用的方法有液相色谱法[3,4]、氨基酸自动分析仪法、纸层析法[5]、毛细管电泳法[6~8]等。 其中毛细管电泳技术以其高效、快速、灵敏、低耗等优点在氨基酸分析中得到快速发展。但目前国内外毛细管电泳技术测定谷氨酰胺的检测法多采用紫外吸收法[8]和激光诱导荧光法[7],这些检测法存在灵敏度低或仪器昂贵等缺点。而电化学检测法与上述两种检测法相比,具有质量检出限低、线性范围宽、选择性好、设备简单、价格低廉、高效快速等优点[9]。本文采用毛细管电泳/柱端安培检测系统,选用萘二羧基醛(DNA)作为柱前衍生剂,研究了谷氨酰胺分离与检测情况,确定了最佳实验条件,并进行了人血清中谷氨酰胺分离检测。
1 材料与方法
1.1 仪器与试剂 83-2.5型自动新伏安仪(闽东分析仪器厂);3086型X-Y记录仪(四川仪表四厂);高压电源及JF-01型微电流伏安仪(山东省化工研究院与山东大学联合研制);碳纤维(山东大学碳纤维研究中心)。碳纤维工作电极(制作方法同文献[10])。 弹性石英毛细管(30 μm i.d.,360 μm o.d.;J&W Scientific incorporated,USA)。L-谷氨酰胺(第二军医大学政翔科技实业服务部化学试剂研究室,层析纯),NDA(Fluka公司,纯度≥99%),其它试剂均为分析纯,实验用水均为亚沸蒸馏水。
1.2 实验方法
1.2.1 循环伏安法 在微型电解池中移入1 ml缓冲液,将柱状碳纤维束工作电极插入溶液中,接通电解池,记录底液的伏安曲线,加入待测试剂,混匀后记录样品的循环伏安曲线。
1.2.2 毛细管区带电泳/柱端安培检测 选好一根长度合适的毛细管,高压电源正极与毛细管进样端插入同一缓冲液池中,负极与毛细管出口端的缓冲液池连通,与充满电泳缓冲液的毛细管构成回路,形成毛细管区带电泳分离系统。调节三维工作台上的操作器,在显微镜下把工作电极对准毛细管的出口。为避免外界干扰,毛细管出口端的三电极检测系统放入屏蔽盒内,屏蔽盒接地。高压电源负极与伏安分析仪的辅助电极相连并接地。向检测池中注入电泳缓冲液,导通高压回路与检测系统,选择好合适的工作电势,加高压,20 min后毛细管中电流趋于稳定,开始电渗进样,电泳分离检测。柱端安培检测器构造同文献[11],本实验中所有电势值均相对于饱和甘汞电极。
2 结果与讨论
2.1 谷氨酰胺与NDA在CN-存在下衍生产物的伏安特性 在室温下,在pH=9.7的Na2B4O7-NaOH缓冲液中,在2.70×10-3mol/L CN-存在下,9.00×10-4mol/L谷氨酰胺与2.70×10-3mol/L NDA的衍生化反应产物在碳纤维电极上有良好、稳定的氧化响应,峰电势约为0.63 V。衍生化反应时间在0.5~8h所得的循环伏安图的峰电流值最大且不变;在不同pH的缓冲液中谷氨酰胺进行衍生化反应,在pH=9.7时衍生物有一最大峰电流。因此选择柱前谷氨酰胺与NDA和CN-衍生化反应的条件是:pH=9.7的Na2B4O7-NaOH缓冲液,反应时间为30min。
2.2 毛细管区带电泳/柱端安培检测谷氨酰胺最佳条件
2.2.1 缓冲液的pH值 在pH=9.7左右,用Na2B4O7-NaOH缓冲体系选择了5个pH值,研究谷氨酰胺衍生产物的毛细管区带电泳/柱端安培检测情况。随pH增加,衍生反应产物的迁移时间tm、柱效N随pH增加而减小,而峰电流ip在pH=9.9时有一最大值。综合考虑缓冲液pH对迁移时间tm、柱效N、峰电流ip的影响,本文选择pH为9.7的Na2B4O7-NaOH缓冲液,此时峰电流ip值较大,柱效N值较高,迁移时间tm较短。
2.2.2 分离电压 随分离电压Vs的增大,迁移时间tm减小。当Vs=20 kV时,峰电流ip和柱效N均有最大值,故选择分离电压为20 kV。此时峰电流、柱效最大,迁移时间较短,基线平稳,峰形好。
2.2.3 检测电势 在0.95~1.10 V随检测电势Ed的增加,ip值迅速增大,当检测电势超过1.10 V时,峰电流ip值基本不再随检测电势Ed的变化而变化。由于检测电势过高,基线噪音较大,应尽量选择较低的检测电势,故本文选择的检测电势为1.10 V。此时检测灵敏度高,测量重现性好,且基线噪音较小,峰形好。
2.2.4 缓冲液浓度 随缓冲液浓度的增加,谷氨酰胺衍生物的迁移时间tm延长,柱效N呈上升趋势。峰电流ip开始随缓冲液浓度的增加而加大,当浓度达到 2.19×10-3mol/L Na2B4O7-9.39×10-4mol/L NaOH时峰电流ip值达到最大值后缓慢下降。无其它氨基酸干扰时,选择该浓度的缓冲液能得到低的检测限。但血清中的酪氨酸(Tyr)干扰谷氨酰胺的测定,在此浓度的缓冲液中,谷氨酰胺与酪氨酸不能分开(图1-1)。为提高柱效,增加了缓冲液的浓度, 在 2.00×10-2mol/L Na2B4O7-8.57×10-3mol/L NaOH缓冲液中,虽然谷氨酰胺的峰高有所降低,峰变宽,但却可以使谷氨酰胺与酪氨酸很好地分离(图1-2),分离度为2.0。所以在测定血清中谷氨酰胺时,本研究选择的缓冲液为:2.00×10-2mol/L Na2B4O7-8.57×10-3mol/L NaOH。
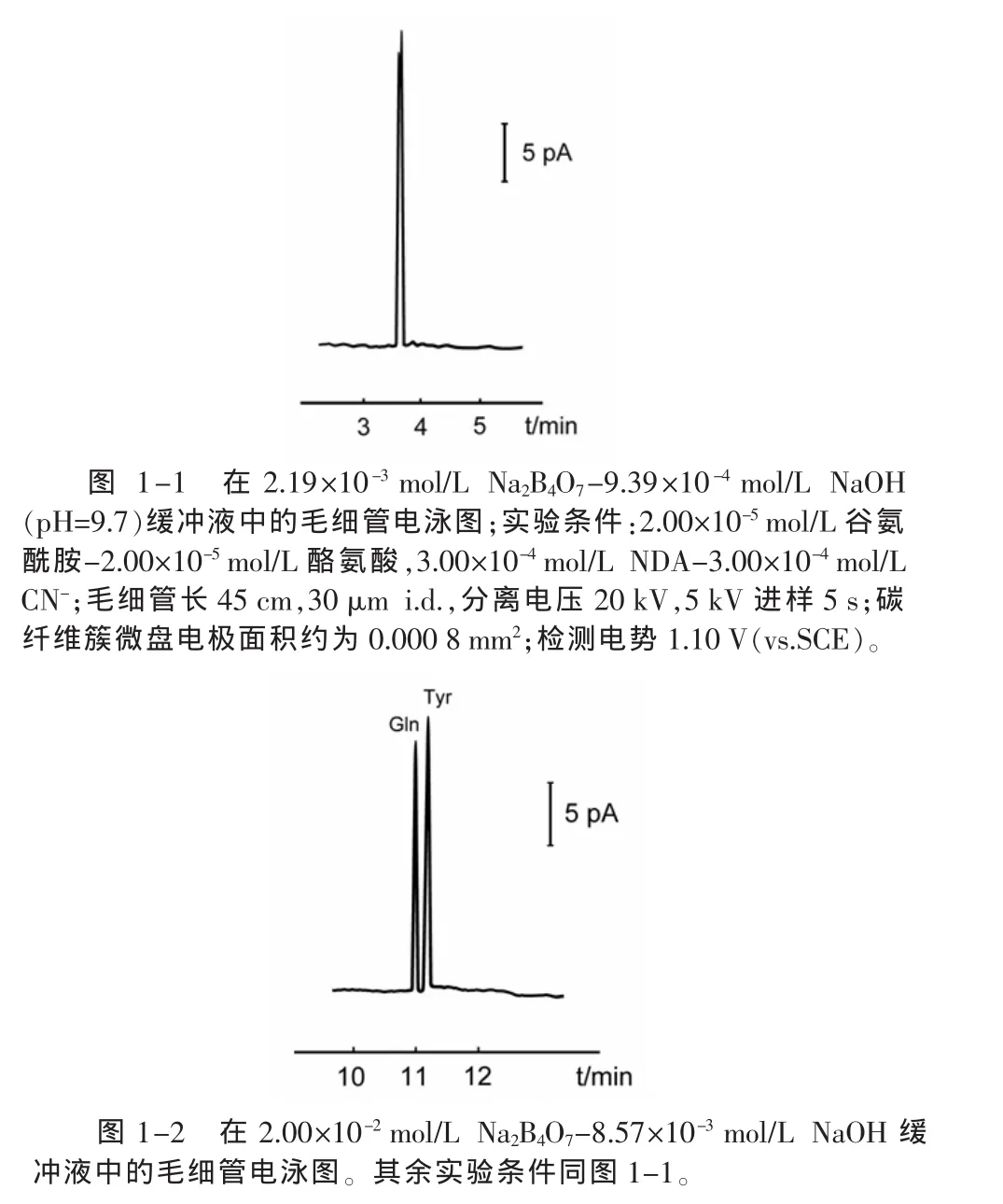
图1 谷氨酰胺、酪氨酸衍生产物电泳图
2.3 分析应用
2.3.1 重现性、检测限和线性范围 对5.00×10-5mol/L的谷氨酰胺衍生产物测定8次,迁移时间tm、峰电流ip的相对标准偏差分别为2.2%和3.1%。对1.00×10-6mol/L的谷氨酰胺衍生产物进行毛细管区带电泳/柱端安培检测,得到高于基线3倍的响应值,因此得到信噪比S/N=3时谷氨酰胺的浓度检测限为1.0×10-6mol/L,质量检测限为1.08×10-15mol/L(1.08 fmol)。谷氨酰胺的线性范围为 1.00×10-6mol/L~1.00×10-4mol/L,斜率为 1.1 pA/μmol·l,截距为0.27 pA,线性回归系数为0.999 8。
2.3.2 人血清中谷氨酰胺的测定 取人血清200 μl,加99%的乙醇600 μl,立即在旋涡振荡器上充分混合振荡,置4℃冰箱中10min后,1500×g离心15min除去血清中的蛋白,取上清液备用。取去除蛋白的血清 40 μl,分别加入缓冲液 900 μl,0.01 mol/L CN-30 μl和 0.01 mol/L NDA 30 μl, 反应 30 min 后进行毛细管区带电泳/柱端安培检测,得到人血清毛细管区带电泳图(图2)。用标准加入法测得人血清中谷氨酰胺的含量为619 μmol/L。回收率为95%~103%。
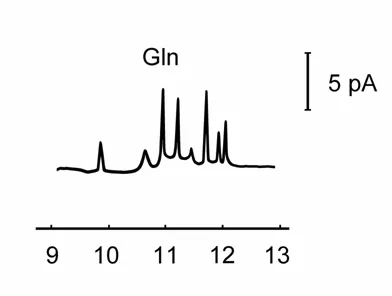
图2 血清中谷氨酰胺毛细管电泳图其余实验条件同图1-2
[1]蒋朱明,蔡 威.临床肠外与肠内营养.北京:科学技术文献出版社,2000.123.
[2]许霖水.谷氨酰胺与临床.国外医学临床生物化学与检验学分册,1994,15(2):50.
[3]Tom Teerlink,Marcel WT, Hennekes Paul A,et al.Rapid determination of glutamine in biological samples by high-performance liquid chromatography.Clin Chim Acta,1993,218(2):159.
[4]骆春迎,黎源倩,邹晓莉,等.2,4-二硝基氯苯衍生高效液相色谱法测定血清中的谷氨酸和谷氨酰胺.现代预防医学,2008,35(10):1900.
[5]王 霞,张伟国.发酵液中L-谷氨酰胺的定性定量测定.食品与生物技术学报,2008,27(6):111.
[6]Miao-Jen Lu,Tai-Chia Chiu,Po-Ling Chang,et al.Determination of glycine,glutamine,glutamate,andγ-aminobutyric acid in cerebrospinal fluids by capillary electrophoresis with light-emitting diode-induced fluorescence detection.Anal Chim Acta,2005,538:143.
[7]Takashi Kaneta,Hiromasa Maeda,Mari Miyazaki,et al.Determination of amino acids in urine by cyclodextrin-modified capillary electrophoresis-laser-induced fluorescence detection.J Chromatogr Sci,2008,46(8):712.
[8]吴 键,邓留杰,郭利芬,等.毛细管电泳检测转化液中谷氨酰胺和谷氨酸. 食品科学,2008,29(4):328.
[9]刘青青,贾 丽.毛细管电泳技术在氨基酸分析中的研究进展.分析测试学报,2009,28(1):123.
[10]Jin Wenrui,Weng Qianfeng,Wu Jianren.Determination of bovine serum albumin by capillary zone electrophoresis with end-column amperometric detection at the carbon fiber microdisk array electrode.Anal Chim Acta,1997,342(1):67.
[11]Daxing Liu,Wenrui Jin.Determination of midecamycin by capillary zone electrophoresis with electrochemical detection.J Chromatogr B Analyt Technol Biomed Life Sci,2003,783(2):509.
