抗肌萎缩蛋白在不同类型肌营养不良症中表达的研究
2010-07-16王伟文廖晓阳吴渝宪王庆松
王伟文,廖晓阳,吴渝宪,王庆松
Duchenne型肌营养不良症 (Duchenne muscular dystrophy,DMD)和Becker型肌营养不良症 (Becker muscular dystrophy,BMD)是男性最常见的 X连锁隐性遗传病。目前已经确认 DMD的致病基因位于 X染色体短臂 XP21上,并编码 427 k D的抗肌萎缩蛋白 (dystrophin,Dys)。Dys分布于骨骼肌细胞膜的质膜面,起细胞支架作用,Dys表达障碍可导致肌纤维膜的不稳定及肌纤维细胞坏死,最终导致DMD或 BMD不同的临床表型[1]。尽管Dys在 DMD/BMD患者肌细胞中的表达缺乏已经明确,但其表达形式与临床表型的关系以及在其他类型肌营养不良症患者肌组织中的表达情况国内还少有报道。现应用免疫组化技术对我科近 10年来所搜集的 DMD、BMD、肢带型肌营养不良(limb-girdle muscular dystrophy,LGMD)、面肩肱型肌营养不良 (facioscapulohumeral muscular dystrophy,FSHD)和神经性肌萎缩患者的肌组织进行 Dys检测,并结合其不同的临床表型从蛋白分子机制上加以探讨,为肌营养不良症的诊断、分型及预后判定提供依据。
1 资料与方法
1.1 一般资料 DMD患者 71例,BMD患者17例,均为汉族男性。患者均符合DMD/BMD临床诊断标准,并按运动功能障碍分级 (由轻到重分Ⅰ ~Ⅹ级)。另外搜集 LGMD患者 8例,FSHD患者 4例,神经源性肌萎缩患者 11例,所有患者来源于我院神经内科门诊。对照组为无神经肌肉疾病的急诊创伤患者。
1.2 组织病理标本制备 选择患者轻、中度受累的肌肉组织,在局麻无菌情况下行肌肉组织活检术,将修剪后的组织块放入液氮冷却的异戊烷中快速冷冻,并置于液氮中保存。
1.3 免疫组化染色 冷冻切片厚约 4 μm,抗 Dys特异性抗体 Anti5-7由第四军医大学分子生物技术中心惠赠,使用效价为 1∶2 500,链菌素亲生物素 -过氧化物酶免疫组化试剂盒购置 Maxim Biotech公司。组化程序参照试剂盒说明进行。DAB-H2O2显色,并用苏木素复染胞核,设立阴性空白对照和正常人组织标本阳性对照。
1.4 统计学方法 计量资料的组间比较采用 t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 Dys在 DMD/BMD患者肌肉组织中的表达 免疫组化染色结果显示,Dys在正常对照的肌肉组织中呈阳性表达,且沿肌细胞膜分布 (见图 1a)。71例临床表型为 DMD的患者中,有63例肌细胞中未检测到 Dys阳性表达,细胞膜边界不可见,细胞核排列紊乱 (见图 1b);有 8例肌细胞膜上检测到 Dys呈弱阳性表达,阳性表达率为 11%,可见 Dys呈不连续的斑片状,沿肌细胞膜分布。17例临床表型为 BMD的患者肌细胞膜上可染出不连续的斑片状,Dys呈弱阳性表达 (见图1c)。
2.2 肌肉组织中有无 Dys表达的 DMD患者的运动功能障碍分级情况及年龄和病程比较 肌肉组织中无 Dys阳性表达的DMD患者,其运动功能障碍分级≥Ⅲ级,而肌肉组织中 Dys呈阳性表达的 DMD患者,其运动功能障碍分级为Ⅱ级。肌肉组织中有无 Dys表达的 DMD患者的年龄、病程间差别均无统计学意义 (P>0.05,见表 1)。
2.3 Dys在其他肌营养不良症患者肌肉组织中的表达 8例 LGMD,4例 FSHD,11例神经源性肌萎缩患者的肌肉组织中均检测到 Dys阳性表达,并且完整的勾画出肌细胞膜的边界,但肌纤维横径明显缩小并粗细不一 (见图1d)。
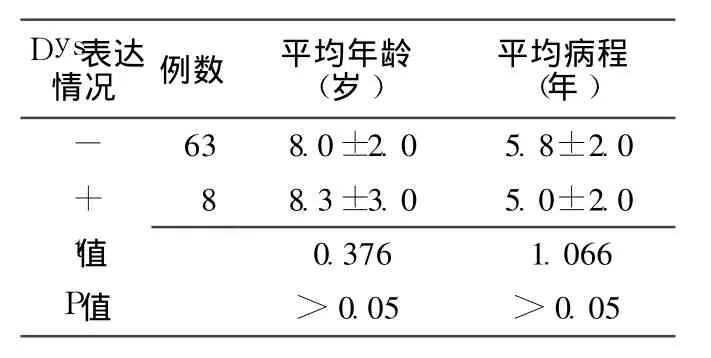
表 1 肌肉组织中有无Dys表达的 DMD患者的运动功能障碍分级情况及年龄和病程的比较Table 1 The relation between dystrophin in muscle and dyskinesia grade from DMD or BMD
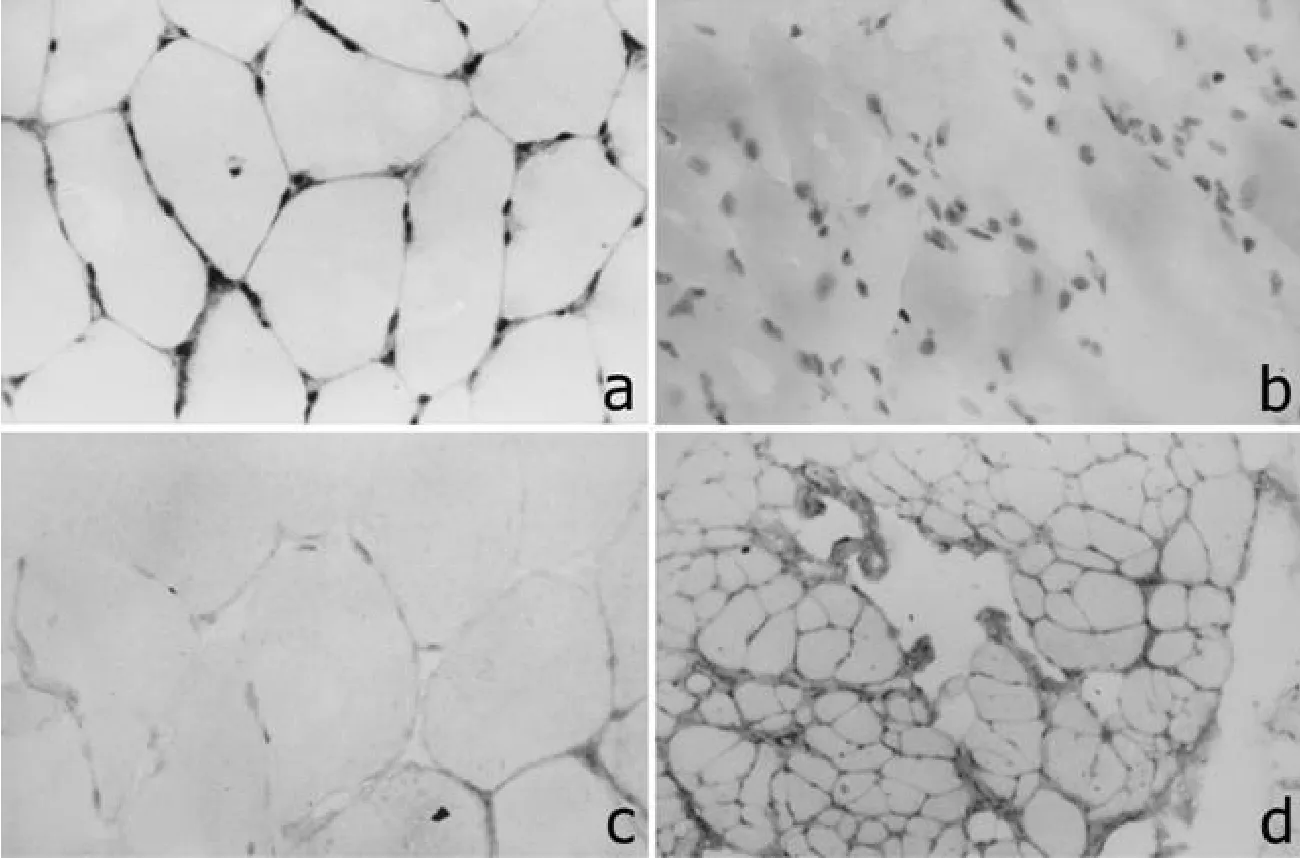
图 1 a.Dys在正常人肌细胞膜上呈阳性表达 (SP法 ×400);b.Dys在 DMD患者肌肉组织中呈阴性表达,细胞膜边界不可见,细胞核排列紊乱 (SP法 ×400);c.Dys在 BMD患者肌肉细胞膜上呈斑片状、不连续的弱阳性表达 (SP法 ×400);d.Dys在神经源性肌萎缩患者的肌细胞膜上呈阳性表达,肌纤维横径粗细不一 (SP法 ×100)Figure 1 a.Positive dystrophin immunostaining was localized to the sarcolemma from the nomal individusls(SP×400);b.No detectable dystrophin in muscle of DMD(SP×400);c.Thin dystrophin immunostaining from BMD consisted of a patchy or discontinuous staining pattern aroud most fibers(SP×400);d.Positive dystrophin immunostaining was detected in sarcolemma from the muscle of neurologic dystriophy,and fiber diameter wasvariable(SP×100)
3 讨论
Dys是 DMD基因的表达产物,含3 685个氨基酸,分子量约 427 kD,主要分布于肌细胞的质膜面,是横纹肌细胞膜骨架蛋白的重要组成部分,其在保护肌细胞结构完整、维持肌细胞正常收缩功能中起重要作用。该蛋白分为 4个结构区域:N端区、棒状区、半胱氨酸富集区和C端区[1]。
Anti5-7多克隆抗体是针对 Dys棒状区 15-18重复区域的抗体。以往的研究表明,该抗体能特异地检测到正常人肌细胞膜上的 Dys表达[2]。本研究结果提示,71例临床表型为 DMD的患者中,63例患者肌细胞上未检测到 Dys的表达,8例患者的肌细胞膜上可检测到斑片状、不连续的 Dys弱阳性表达,阳性表达率为 11%。再将这 8例患者的运动功能障碍分级、年龄、病程与上述 63例 DMD患者相比较,结果发现在他们年龄、病程均较接近的情况下,Dys呈弱阳性表达的患者,其运动功能障碍分级较 Dys阴性表达的患者低,亦即 Dys弱阳性表达患者的症状较阴性表达患者的症状轻。多数临床表型为 DMD的患者其肌细胞膜上缺乏 Dys的表达,这与我们以往的研究结果相一致。而就另外8例临床表型考虑 DMD的患者而言,可能因 DMD基因突变造成外显子以外区域的移码,仍部分维持了开放阅读框架的完整性,而产生一个具有部分功能、短小的小分子蛋白,对肌细胞的结构和功能的维持起到一定的作用,而表现为一个较轻的临床表型。当然,这 8例患者是否是BMD有待于我们今后进一步的临床随访。
与 DMD相比,BMD有着较轻的临床表型及较低的发病率。17例临床表型为BMD的患者其肌肉组织中均检测到 Dys弱阳性表达,且呈斑片状沿肌细胞膜分布。根据开放阅读框架学说,当基因突变时,若邻近外显子仍能维持开放阅读框架不变,则产生一个尚有部分功能的 Dys,由于该蛋白的结构和功能不同于正常的Dys,致使肌细胞膜的通透性、稳定性发生了改变,而表现为一个较 DMD轻的临床表型[3-4]。结合上述 8例存在少量 Dys表达的患者的临床运动功能障碍分级,可以推断 Dys是否表达及其质或量的改变是我们推断肌营养不良症临床表型及判定临床预后的重要依据。
进行性肌营养不良症除了 DMD、BMD外,还包括先天性肌营养不良、强直性肌营养不良、FSHD及 LGMD等。本研究对 8例 LGMD,4例 FSHD患者的肌肉组织 Dys检测的结果显示,患者肌细胞膜上均检测到 Dys阳性表达。该结果也预示着这两类肌营养不良症的病理机制与Dys表达无关。另外,本研究对 11例神经源性肌萎缩患者肌肉组织 Dys检测结果显示,该类患者均存在着 Dys阳性表达,勾画出的肌细胞膜边界提示肌纤维横径明显缩小并粗细不一。
总之,DMD/BMD的临床表型与肌细胞膜上 Dys表达的缺乏密切相关,Dys表达的质或量的改变是鉴别其临床表型及判断临床预后的重要依据。免疫组化检测骨骼肌肉组织 Dys的方法可用于复杂性DMD/BMD与不典型 FSHD、LGMD、神经源性肌萎缩等疾病的鉴别。
1 Deconinck N,Dan B.Pathophysiology of duchenne muscular dystrophy:current hypotheses[J].Pediatr Neurol,2007,36(1):1-7.
2 van Essen AJ,Kneppers ALJ,van der Hout AH,et al.The clinical and molecular genetic approach to Duchenne and Becker muscular dystrophy:an updated protocal[J].J Med Genet,2007,34:805-812.
3 Arahata K,Hoffman EP,Kunkel LM,et al.Dystrophin diagnosis:comparison of dystriohin abnormalities by immunofluorescence and immunoblot analyses[J].Proc Natl Acad Sci USA,2007,86:7154-7158.
4 Wells DJ.Sarcolemmal ion channels in dystrophin-deficient skeletal muscle fibres[J].J Muscle Res Cell Motil,2006,27(5-7):387-98.
