红花多糖对人PBMC增殖活性及分泌细胞因子的影响*
2010-07-13石学魁阮殿清周明瑶王亚贤
石学魁,阮殿清,陶 冀,周明瑶,王亚贤
(1.牡丹江医学院病原生物学教研室,牡丹江 157011;2.木兰县疾病控制中心,哈尔滨 151900;3.黑龙江中医药大学微生物与免疫学教研室,哈尔滨 150040)
红花是一味重要的活血化瘀药,具有活血、祛瘀、止痛之功效,在历代医书及《本草纲目》中均有详细记载,是传统复方和现代临床组方中常用的中药。红花成分复杂,作用多样。据研究,红花的重要成分之一——红花多糖(SPS)具有免疫调节功能,如增加溶血空斑数量,并能显著对抗泼尼松抑制溶血空斑的作用[1];红花多糖也具有抗肿瘤作用[2]。本研究通过检测人外周血单个核细胞(PBMC)的增殖作用及PBMC诱生细胞因子水平,探讨SPS对机体免疫功能的影响,以期为该药应用于抗肿瘤提供实验依据。
1 实验材料
1.1 细胞株 小鼠T细胞(CTLL-2,协和医科大学免疫室惠赠)、人羊膜上皮细胞(WISH,卫生部药品检定所刘兰教授惠赠)、小鼠成纤维细胞(L929,空军总院刘丽博士惠赠)。
1.2 主要试剂 RPMI-1640培养基(GIBCO-BRL公司);胎牛血清(FCS,GIBCO-BRL公司);Ficoll-Urografin淋巴细胞分离液(上海试剂二厂);植物凝集素 P(PHA-P,Serva产品);水疱口炎病毒(VSV,卫生部药品检定所刘兰教授惠赠);重组白细胞介素-2(rIL-2,军事医学科学院中化技术研究所张明伟教授惠赠);重组肿瘤坏死因子α(rTNF-α)和基因重组干扰素γ(rIFN-γ,邦定生物医学公司);氚标记胸腺嘧啶核苷(3H-TdR):比放射活性100 mci/mL(中科院原子能所提供)。
1.3 仪器和设备 CO2培养箱(池本理化株式会社,日本);倒置显微镜(Olympus,日本);酶标微量板测定仪(BIO-T EK INSTRMENTS INC.,美国)。
1.4 红花多糖的制备 红花1000g,充分浸渍,90℃提取4 h,边提边搅拌,过滤,残渣重复提取1次,合并两次提取液浓缩至一定体积,加乙醇终浓度至85%。沉淀物加适量水溶解,置分液漏斗中,加氯仿充分振荡,放置片刻,除去氯仿层,如此反复操作6次,以除去蛋白质。水层加95%乙醇沉淀,沉淀物先后用无水乙醇、乙醚洗涤3次,干燥后即得SPS。根据预实验结果,实验前配制成不同浓度的多糖水溶液,无菌过滤后冰箱保存。
2 实验方法
2.1 PBMC的分离 取健康人外周抗凝血5 mL,用淋巴细胞分离液,按常规方法分离PBMC。将分离出的细胞用5 mL RPMI 1640培养液洗涤3遍,制成细胞悬液(1×109个/L)。
2.2 PBMC增殖活性检测 于96孔圆底培养板中每孔加入1×105个人PBMC,分为正常对照组(不加红花多糖或PHA),植物血球凝集素(PHA)刺激组(PHA终浓度为1g/L),PHA加多糖组(PHA终浓度为1 g/L,红花多糖浓度为 1.25 g/L),多糖组 1(5 g/L),多糖组2(2.5g/L),多糖组 3(1.25 g/L),多糖组 4(0.625 g/L),多糖组5(0.312 g/L)。每孔液量为200 μL,作平行3孔。培养 72 h,每孔加3H-TdR 10 μL ,孵育 6 h。用液闪仪测定3H-TdR掺入量,结果以每分钟脉冲数(cpm)表示。
2.3 细胞因子生物活性检测 于24孔板中每孔加入1×106个PBMC,分组同2.2。每孔总液量为1 mL,每5孔为1个实验组。刺激48h,每孔取上清500μL,分装5份检测细胞因子。
2.3.1 白介素-2(IL-2)生物活性检测 取CTLL-2细胞,洗涤3次,以完全培养基调细胞浓度至2×109个/L,按每孔75 μL加入96孔平底培养板中。将IL-2标准品倍比稀释8个梯度,最大浓度为4×105U/L,每孔25μL,设平行3孔。另取培养上清25μL加入孔中,每份样品设复孔。对照孔加完全培养基25 μL。5%二氧化碳(CO2)孵箱中孵育 20~22 h,待对照孔细胞死亡大于90%后,每孔加入噻唑蓝(MTT)15 μL,继续培养4 h,每孔加溶解液 100 μL,置孵箱中孵育8 h后,酶标仪上测其光密度值(OD值),测定波长570 nm,参考波长630 nm。
2.3.2 肿瘤坏死因子-α(TNF-α)生物活性检测培养的L929细胞,用0.25%的胰酶消化,收集细胞,洗涤2次,用完全培养基调细胞浓度为3×108个/L。按每孔90 μL细胞悬液加入96孔平底培养板中,孵箱中孵育18h细胞长成单层后,加放线菌素D 10 μL(终浓度800 μg/L)。将TNF-α标准品5倍稀释8个梯度,最大浓度为2×108U/L,每孔加标准品或待测上清样品10 μL。酶标仪检测同IL-2。
2.3.3 干扰素-γ(IFN-γ)生物活性检测 用0.25%的胰酶消化培养的羊膜(WISH)细胞,洗涤2次调细胞浓度为3×108个/L,96孔平底培养板中每孔加入上述细胞悬液100 μL,5%CO2孵箱中孵育2 h。标准品倍比稀释8个梯度,最大浓度为5×106U/L,每孔加标准品或待测上清25 μL,培养过夜,以每孔100 TCID50水泡性口腔炎病毒(VSV)攻击WISH细胞,再孵育24 h,待对照组细胞病变大于75%时结束培养。以下MTT测定同IL-2测定。
2.4 统计学分析 使用SPSS 10.0统计软件分析,计量资料用均数±标准差(x±s)表示,组间比较采用单因素方差分析P<0.05为差异有统计学意义。
3 结果
3.1 SPS对人PBMC增殖活性的影响 经SPS作用后,PBMC增殖活性均比正常对照组高,尤以1.25g/L和0.625 g/L剂量组作用显著(P<0.05),呈现明显的促进作用,最适宜促进效应浓度为0.625 g/L。PHA和PHA+SPS 1.25 g/L组比较,未见明显差异,表明SPS对PHA所致的PBMC增殖反应无协同或拮抗作用。PHA组与SPS各组比较差异显著,说明SPS虽然对PBMC的增殖有促进作用,但作用程度远低于PHA。见表1。
表1 SPS对人PBMC增殖的影响(n=7,±s)Tab 1 The influence of SPS on the proliferation of PBMC in human body(n=7,±s)
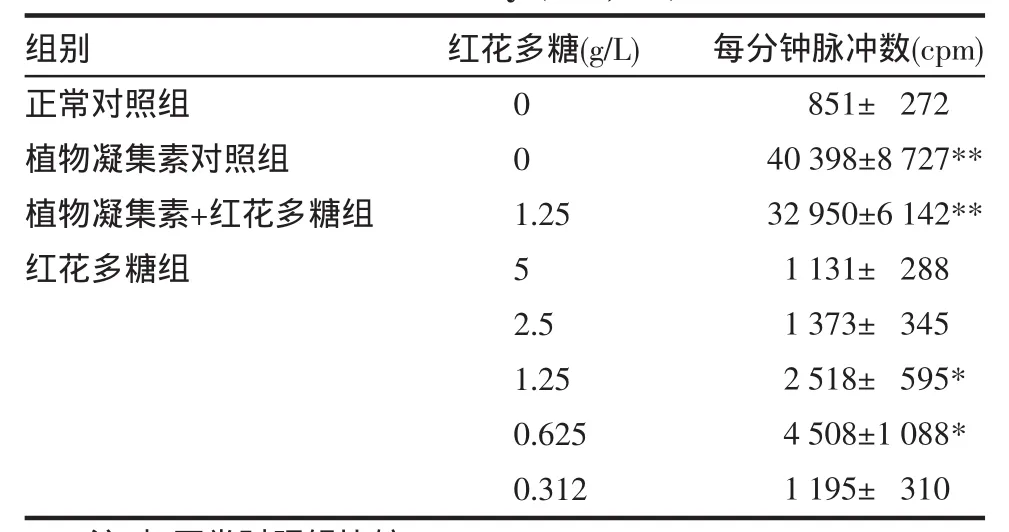
表1 SPS对人PBMC增殖的影响(n=7,±s)Tab 1 The influence of SPS on the proliferation of PBMC in human body(n=7,±s)
注:与正常对照组比较,*P<0.05,**P<0.01。
组别正常对照组植物凝集素对照组植物凝集素+红花多糖组红花多糖组红花多糖(g/L)001.2552.51.250.6250.312每分钟脉冲数(cpm)851± 27240398±8727**32950±6142**1131± 2881373± 3452518± 595*4508±1088*1195± 310
3.2 SPS对PBMC产生细胞因子的影响 SPS对IL-2和IFN-γ的产生有明显的诱导作用,与正常对照组比较差异显著(P<0.05),但其作用不及PHA(与正常对照组比较P<0.01)。PHA和PHA+SPS 1.25 g/L组比较,未见明显差异,表明SPS对PHA刺激PBMC产生IL-2和IFN-γ无协同或拮抗作用。TNF-α 各组之间无显著性差异(P>0.05),即 SPS对TNF-α的分泌无明显诱导作用。见表2。
表2 不同浓度SPS对PBMC产生细胞因子的影响(n=7,±s)Tab.2 The influence of different concentration of SPS on the cytokines release produced by PBMC in vitro(n=7,±s)103U/L

表2 不同浓度SPS对PBMC产生细胞因子的影响(n=7,±s)Tab.2 The influence of different concentration of SPS on the cytokines release produced by PBMC in vitro(n=7,±s)103U/L
注:与正常对照组比较,*P<0.05,**P<0.01。
组别正常对照组植物凝集素对照组植物凝集素+红花多糖组红花多糖组红花多糖(g/L)001.251.250.6250.312 IL-216.45±3.3462.56±13.89**64.57±14.28**38.78±7.98*44.54±9.23*34.12±6.54*IFN-γ 23.55±4.43157.44±29.69**148.67±27.87**76.45±13.87*98.65±17.45*88.43±16.13*TNF-α 5.66±1.766.12±2.346.67±2.894.30±1.454.98±1.895.54±2.86
4 讨论
红花具有抗肿瘤作用,在于其活血、祛瘀、止痛之功效。肿瘤在中医学中相当于噎膈、癥积、石瘕、痞癖、肠覃、肚腹结块等,且历代医家也多认为肿瘤与瘀血有密切关系,如王清任《医林改错》中指出:“肚腹结块者,必有形之血。”说腹内肿块,多由血瘀所致,故活血化瘀法是治疗肿瘤的主要法则之一。在多种癌症的临床治疗中以红花为主药单用或适当配伍,常常获得良好疗效,原因在于此。红花多糖是红花的主要成分之一,作为免疫调节剂具有抗肿瘤作用。本研究红花多糖(SPS)对PBMC的增殖及PBMC分泌细胞因子的影响,探讨其免疫调节作用,为进一步研究红花多糖的抗肿瘤机制打下基础。
PBMC主要包括淋巴细胞和单核细胞,而以T细胞占多数。T细胞承担着抗微生物、移植物排斥和肿瘤的免疫监视等一系列重要生理功能,是细胞免疫的主要执行者,在体内通过分泌IL-2而发挥一系列重要的免疫效应。IL-2主要由CD4、CD8 T细胞产生,可激活单核/巨噬细胞,并增强其杀瘤活性;促进自然杀伤(NK)细胞的细胞毒活性及产生细胞因子,诱导淋巴细胞因子激活的杀伤细胞(LAK)增生;激活B细胞及产生抗体等。淋巴细胞因子活化杀伤细胞(IFN-γ)能促进CTL成熟及活性;激活NK细胞杀伤活性;激活巨噬细胞并促进其活性。研究发现,许多中药多糖及中药提取物就是通过促进淋巴细胞增殖及诱生细胞因子的分泌而发挥免疫调节及抗肿瘤作用[3-5]。有些中药复方也能促进淋巴细胞增殖及提高细胞因子如IL-2的分泌[6]。实验中,SPS促进PBMC的增殖,进而增强其活性,有助于提高机体的细胞免疫,发挥抗肿瘤、抗感染等作用。SPS诱导PBMC分泌大量细胞因子,尤其是1.25 g/L和0.625 g/L剂量作用显著。说明SPS具有明显促进淋巴细胞活化以及促进内源性IL-2、IFN-γ的产生。其结果表明这些细胞因子是SPS发挥药效的分子介质和物质基础,是增强机体对各种有害因素的非特异性抵抗力的药效机制之一。
另外,SPS对TNF-α的分泌无明显诱导作用,其原因将进一步研究。
综上所述,红花多糖(SPS)可促进人PBMC增殖,提高PBMC分泌IFN-γ、IL-2,具有免疫调节作用。因此,SPS可作为免疫调节剂而用于肿瘤治疗。
[1] 黄 虹,俞曼雷,翟世康.等.红花多糖的免活性作用[J].现代免疫学,1982,2(6):7-8.
[2] 何素芳,王志刚,任爱农,等.红花多糖对H22荷瘤小鼠的抑瘤作用及瘤细胞VEGF,Ki67表达的影响[J].中国中药杂志,2009,34(6):795-797.
[3] 魏志文,高晓雯,郑维发.芫花根总黄酮抗肿瘤活性研究[J].解放军药学学报,2008,24(2):116-119.
[4] 祝 绚,鲍依稀,李 进,等.云芝糖肽、丹参酮ⅡA对荷瘤小鼠的抗肿瘤及免疫调节作用[J].中国免疫学杂志,2008,24(6):526-529.
[5] 王冬艳,张洪泉.中药诱生内源性IL-2、增强免疫功能及抗肿瘤作用研究概况[J].药学进展,2006,30(4):162-165.
[6] 杨志强,王润田,崔 澂,等.中药复方抑瘤饮影响荷S180瘤小鼠免疫功能的动态研究[J].现代免疫学,2006,26(1):65-68.
