牡丹花蕾大小对花药组培诱导率的影响
2010-07-09朱向涛彭镇华律春燕郑宝强高云瑞
朱向涛,王 雁,彭镇华,律春燕,郑宝强,高云瑞
(中国林业科学研究院林业研究所,国家林业局林木培育重点试验室,北京 100091)
牡丹(Paeonia suffruticosaAndr.),属芍药科芍药属的名贵观赏和药用木本植物[1],冠有“花中之王”美誉[2]。牡丹的组织培养研究已经有较长的历史,近年来也取得了一定进展。但在牡丹花药诱导愈伤组织方面仍然存在愈伤组织诱导困难、诱导率低、生长缓慢等问题[3-6]。关于花药培养诱导率低的原因有很多,而花粉的发育时期是影响培养效果的重要因素之一,这在其他植物上如番茄[7]、黄瓜[8]、金银花[9]已有较详细的研究报道,而牡丹花粉的发育时期与花蕾大小相关性及其愈伤组织诱导率方面的研究尚未见报道。笔者通过对不同花蕾大小的牡丹花粉母细胞发育时期的观察,探讨了花蕾大小与花粉母细胞发育时期的相关性,并对不同发育时期的花药进行愈伤组织诱导,以期通过花蕾大小的外观判断,推断和确定花粉母细胞发育时期,从而为提高愈伤组织诱导率提供科学的理论依据。
1 材料与方法
1.1 材料
供试牡丹品种为“凤丹”,种植于中国林业科学研究院试验田,田间管理按照常规方法进行。
愈伤组织诱导的培养基:MS+2.0 mg/L 2,4-D+1.5 mg/L 6-BA+1.0 mg/L NAA,蔗糖6%,琼脂0.7%,pH 5.8,121℃高压灭菌 20 min。
1.2 方法
2008 年 4 月,于晴天上午 10:00~11:00 之间,从生长良好的植株上选取不同长度的花蕾,用游标卡尺测量花蕾长度后,分装于卡诺氏固定液(无水乙醇∶冰醋酸=3∶1)固定 24 h,经 95%、80%乙醇冲洗后转入70%乙醇中4℃保存备用。采用醋酸洋红压片法压片,显微镜观察拍照。
每份材料取不同大小10个花蕾,3次重复,每个花蕾取1个花药,每个花药观察10个不同视野,通过视野中花粉母细胞发育时期的细胞数与总细胞数比例来确定花粉母细胞发育时期。并对不同时期单个细胞进行显微镜拍照。
花药接种时,自来水冲洗2 h,2%次氯酸钠消毒20 min,无菌水冲洗4~5遍,70%酒精消毒20 s,之后再用无菌水冲洗4~5遍,用滤纸将多余水分吸干,在无菌条件下将花药剥离接种。每处理接种10瓶,3次重复。接种后的花药置于在(25±2)℃条件下暗培养,诱导愈伤组织。
2 结果与分析
2.1 牡丹各发育阶段的细胞学特征
2.1.1 四分体时期 如图1所示,花粉母细胞经过减数分裂形成四分体,四分体的4个小孢子被共同的胼胝质包被,各个小孢子之间也有胼胝质分割。
2.1.2 单核早期 如图2所示,小孢子从四分体中释放,细胞体积小,细胞质中无液泡,核大,居于中间位置。
2.1.3 单核中期 如图3所示,细胞质中产生小液泡,细胞体积增加到正常大小,核大,居中央,特化细胞壁逐步形成,细胞壁周围出现萌发孔。
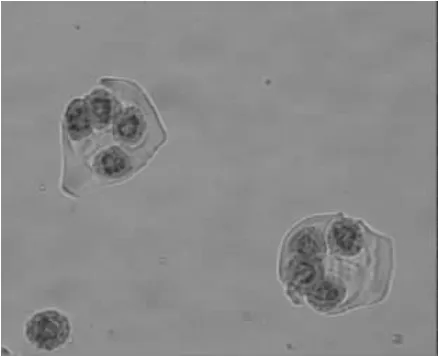
图1 四分体时期

图2 单核早期
2.1.4 单核晚期 如图4所示,随着小孢子的发育,细胞质液泡化,出现小液泡,小液泡增多相互合并形成大液泡,将细胞核挤压到靠近细胞壁。
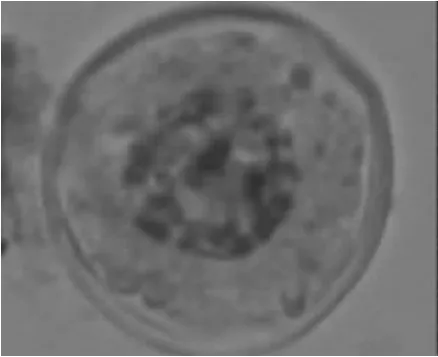
图3 单核中期
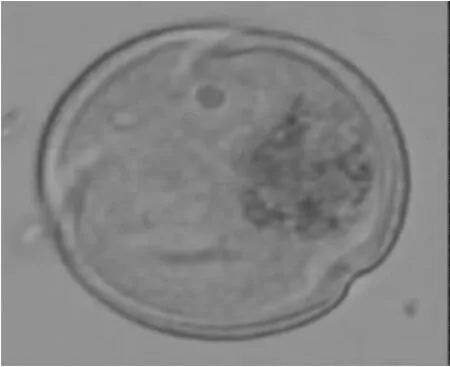
图4 单核晚期
2.1.5 双核期 如图5所示,细胞核在靠近细胞壁位置进行有丝分裂形成两个子核,其中一个较小并贴近细胞壁,为生殖核,另一个明显较大而且处于近中央位置及营养核,营养细胞和生殖细胞构成了二细胞花粉。
2.2 花蕾长度与花粉母细胞发育的关系
如表1所示,花蕾长度在16.0~18.0 mm时,绝大多数花粉母细胞发育时期为四分体时期,有少数处于单核早期和单核中期,四分体时期的细胞数目占总细胞数目的92.4%。
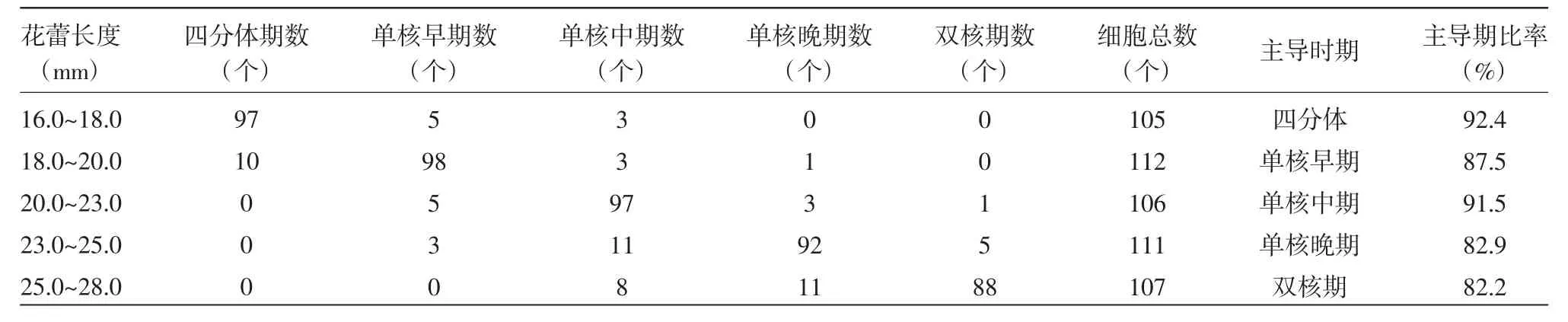
表1 花粉母细胞发育时期与花蕾长度的相关性
在花蕾长度为18.0~20.0 mm时,多数花粉细胞的发育时期为单核早期,占到总细胞数目的87.5%,有少数细胞处于四分体时期和单核中期,极少数细胞已经发育到单核晚期。
花蕾长度在20.0~23.0 mm时,多数花粉细胞发育时期为单核中期,有部分细胞发育时期为单核早期和单核晚期,极少数细胞发育时期为双核期,单核中期的细胞数目占细胞总数的91.5%。
当花蕾长度为23.0~25.0 mm时,花粉细胞中多数细胞的发育时期处于单核晚期,少数细胞的发育时期为单核早期和单核中期,另外有部分细胞的发育时期为双核期,单核晚期的细胞数目占总细胞数目的82.9%。
花蕾长度为25.0~28.0 mm时,花粉细胞中大多数细胞处于双核期,占总细胞数目的82.2%,少数细胞处于单核中期和单核晚期。
2.3 花药不同发育时期愈伤组织诱导率
由表2可以看出,不同的发育时期的牡丹花药都能诱导出愈伤组织,但诱导率有所不同。从四分体时期开始诱导率逐渐升高,在单核中期达到最高,其后逐渐降低。单核中期的愈伤组织诱导率为45.8%,其次为单核晚期,诱导率为18.3%。单核早期和双核期愈伤组织诱导率均为13.3%,四分体时期愈伤组织诱导率仅为8.3%。诱导出的愈伤组织均为白色致密愈伤组织(图6)。

表2 花粉不同发育时期对愈伤组织诱导的影响

图5 双核期

图6 花药诱导的愈伤组织
3 结论与讨论
牡丹花药培养过程中,取材时期具有关键性作用。在大规模的小孢子培养过程中,通过显微镜观察每一个小孢子的发育时期是有很大困难的,因此,通过花蕾长度来简单的判断花粉的发育时期具有重要的作用。牡丹花粉的发育时期包括四分体时期、单核早期、单核中期、单核晚期和双核期。在花药发育的四分体时期,植物的花药尚未发育完全,不利于诱导愈伤组织产生,而单核中期,细胞质中小液泡产生,细胞体积增加到正常大小,特化的细胞壁逐渐形成,此时的细胞生长最为旺盛,营养成分也较为充足。另外花粉进入单核期后,即将进入有丝分裂,此时花药对诱导条件最为敏感,容易引起染色体轴向的改变,导致花粉细胞进行脱分化分裂而开始花粉脱分化,所以容易产生愈伤组织。这在观赏茄[10]、仙客来[11]、羽衣甘蓝[12]、中国水仙[13]等植物上也取得了同样的结果。单核晚期由于细胞质中的小液泡联合成为一个大的液泡,对诱导条件反应不够敏感,所以诱导率较低。
本试验确定在花蕾长度为20.0~23.0 mm时,牡丹的大多数花粉母细胞发育处于单核中期,此时期花粉诱导愈伤组织的诱导率达到最高的45.8%。实践证明,在牡丹小孢子培养过程中,通过花蕾大小及形态特征的观察,无需制片镜检,即可快速、准确地找到适合小孢子培养发的花蕾,可避免每次取样时需要制片观察确定小孢子发育时期的繁琐程序,具有方便、快捷、准确的特点,有利于提高小孢子培养的效率。
[1]陈有民.园林树木学[M].北京:中国林业出版社,1988.
[2]王莲英.中国牡丹品种图志[M].北京:中国林业出版社,1996.
[3]Shoyama Y,Yamada Y,Nishioka I,et a1.Depigmentation and inhibition of cell growth of B-16 melanoma cells by compounds isolated from Paeonia suffruticosa callus[J].Plant Cell Reports,1990,8(12):711-713.
[4]Roberts M,Sunderiand N.Pollen Culture in Paeonia [J].John Innes Annu Rep,1977,(68):60-61.
[5]Sunderiand N,Dunwell J M,Roberts M.Anther culture in the genus Paeonia[J].John Innes Annu Rep,1975,(66):57-60.
[6]陈怡平,丁 兰,赵敏桂.用紫斑牡丹不同外植体诱导愈伤组织研究[J].西北师范大学学报(自然科学版),2001,37(3):66-69.
[7]朱丽萍,陈火英,庄天明,等.番茄不同花药长短及花粉发育时期其愈伤组织诱导率的相关性[J].上海交通大学学报(农业科学版),2005,23(3):239-243.
[8]谢 淼,秦丽颖,潘俊松,等.黄瓜花器形态发生、小孢子发育与花药培养[J].西北植物学报,2005,25(6):1096-1100.
[9]彭明珠,杨 进,朱习红,等.树型金银花花蕾大小与花粉发育关系的研究[J].安徽农业科学,2008,36(14):5828-5829,5846.
[10]宋 明,汤青林,邹 建,等.不同因素对观赏茄花药愈伤组织诱导的影响 [J].西南农业大学学报(自然科学版),2005,27(4):534-536.
[11]王延玲,丰 震,赵兰勇,等.仙客来花药培养外植体消毒研究[J].山东林业科技,2004,(4):8-9.
[12]邹金美,张国广,潘一山.羽衣甘蓝花药培养技术体系的研究[J].漳州师范学院学报(自然科学版),2005,18(2):94-97.
[13]Lin J C,Xue Y Z,Li G,et a1.Efficient callus induction and plant regeneration from anther of Chinese narcissus(Narcissus tazetta L.var.chinensis Roem)[J].Plant Cell Reports,2005,24(7):401-407.
