Taqman三重实时PCR快速检测原料乳中致泻性大肠埃希氏菌
2010-07-09张红宇孟祥晨张伟钦
张红宇,孟祥晨,姜 博,张伟钦
(乳品科学教育部重点实验室,东北农业大学食品学院,哈尔滨 150030)
通常将致泻性大肠埃希氏菌分为五大类,肠致病性大肠埃希氏菌(Enteropathogenic E.coli,E PEC)、肠产毒性大肠埃希氏菌(Enterotoxigenic E.coli,ETEC)、肠侵袭性大肠埃希氏菌(Enteroin-vasive E.coli,EIEC)、肠出血性大肠埃希氏菌(Enterohemorrhagic E.coli,EHEC)以及肠集聚性大肠埃希氏菌(Enteroaggregative E.coli,EAEC)[1]。致泻性大肠埃希氏菌的致病症状主要是引发不同程度的腹泻,其感染剂量一般为106~108cfu[2]。
近年来,各国由致泻性大肠埃希氏菌引起的食物中毒事件时有发生。1996年6月到12月,日本爆发O157∶H7大肠埃希氏菌感染事件,出现了大量食物中毒病人,感染期间全国共中毒9451人,死亡6人[3]。南昌市1998年8月发生一起由肠侵袭性大肠埃希氏菌[EIEC O124∶ K72(B17)]引起的食物中毒爆发,致27人发生感染性腹泻病[4]。青岛市区东部某乡镇由ETEC引起的井水污染,从2006年9月17日出现首例病人至9月29日出现最后1例发病病人,共发现169例患者出现恶心、呕吐、腹痛、发热等症状并伴有大量水样腹泻[5]。在各起致泻性大肠埃希氏菌感染事件中,最常见的有三种,即EPEC、EIEC、ETEC,针对基因型的检测通常采用eae、ipaH、lt和st基因[6-9]。对于ETEC,相对于st、lt是更主要的毒素。本研究即针对以上3种常见的致泻性大肠埃希氏菌的三种致病基因,采用Taqman探针检测技术,建立了可快速检测原料乳中致泻性大肠埃希氏菌三重实时PCR方法。
1 材料与方法
1.1 材料与仪器
1.1.1 仪器与主要试剂
7500实时荧光PCR仪和9700PCR仪(美国Applied Biosystems公司);凝胶成像系统(美国UVP公司);1360型生物洁净工作台(北京东联哈尔仪器制造有限公司);TaqDNA聚合酶、dNTPs和细菌基因组DNA提取试剂盒(北京天根生化科技有限公司);致泻性大肠埃希氏菌诊断血清试剂盒(宁波天润生物药业有限公司)。
1.1.2 菌株与培养基
肠致病性大肠埃希氏菌44706、肠侵袭性大肠埃希氏菌44350和单增李斯特菌NICPBP54002(中国药品生物制品检定所);肠产毒性大肠埃希氏菌CVCC197(中国兽医药品监察所);大肠埃希氏菌ATCC25922和金黄色葡萄球菌ATCC25923(黑龙江省应用微生物研究所);荧光假单胞菌As1.1082(中国科学院北京微生物研究所);枯草芽孢杆菌ATCC6051(中国普通微生物菌种保藏中心);植物乳杆菌KLDS1.0314和鼠伤寒沙门氏菌ATCC14028(均由本实验室保存)。大肠埃希氏菌的继代培养使用LB培养基,分离鉴别培养使用伊红美兰琼脂培养基,其他参考菌株选择营养肉汤液体培养基。
1.1.3 原料乳来源
采自哈尔滨市周边农场及农户的原料乳。
1.2 引物与探针
依据文献[10]针对eae致病基因设计的引物和探针分别由上海Invitrogen公司和大连TaKaRa有限公司合成,其探针的发光基团和淬灭基团分别为JOE和TAMRA;依据文献[11-12]针对ipaH致病基因设计的引物和探针分别由上海Invitrogen公司和大连TaKaRa有限公司合成,其探针的发光基团和淬灭基团分别为FAM和BHQ1;依据文献[13-14]针对lt致病基因设计的引物和探针均由上海Invitrogen公司合成,其探针的发光基团和淬灭基团分别为CY5和BHQ2。具体序列见表1。

表1 所用引物和探针Table 1 PCR primers and TaqMan probes used in this study
1.3 方法
1.3.1 原料乳中细菌基因组DNA的提取
为降低乳中所含物质对DNA提取纯度的影响,本文对Rademaker的方法[15]进行了改良:取1 mL待测原料乳,加入150 μL 18%(W/V)的柠檬酸钠和 100 μL 4%(W/V)NaOH,10 000 r·min-1离心 10 min,收集菌体细胞,加入1 mL PBS缓冲液吹打沉淀,于12 000 r·min-1离心2 min,弃上清,再加入1 mL 1×TE 吹打沉淀,于 12 000 r·min-1离心 2 min,弃上清,将收集到的菌体用细菌基因组DNA提取试剂盒提取DNA。
1.3.2 Taqman三重实时PCR方法的反应条件
本试验选用50 μL反应体系,具体组分为:3 U的 Taq DNA 聚合酶,10×PCR缓冲液(无 Mg2+)5 μL,dNTPs(各2.5 mmol·L-1)5 μL,Mg2+(25 mmol·L-1)5 μL,EPEC、EIEC 和 ETEC 模板各 2 μL,Rox参比染料(1×)1 μL,eae探针(10 μmol·L-1)2.0 μL,ipaH探针(10 μmol·L-1)1.8 μL,lt探针(10 μmol·L-1)1.2 μL, eae 上下游引物(10 μmol·L-1)各 2 μL,ipaH 上下游引物(10 μmol·L-1)各 3 μL, lt上下游引物(10 μmol·L-1)各 3 μL。
所确定的三重Taqman荧光PCR体系的循环参数为:
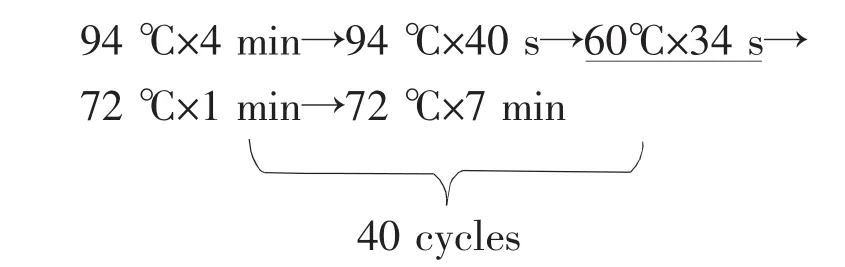
有下划线的步骤表示在此阶段末端收集荧光信号。
1.3.3 人工污染致泻性大肠埃希氏菌乳样的制备
将EPEC或EIEC或ETEC培养液按照1%接种量接种于超高温灭菌乳中,37℃,200 r·min-1振荡培养16 h,即为人工污染乳样。
1.3.4 特异性检测
以EPEC 44706、EIEC 44350和ETEC CVCC197的DNA为阳性模板,以大肠埃希氏菌ATCC25922、金黄色葡萄球菌ATCC25923、鼠伤寒沙门氏菌ATCC14028、单增李斯特菌NICPBP54002、植物乳杆菌KLDS1.0314、荧光假单胞菌As1.1082和枯草芽孢杆菌ATCC6051的DNA为阴性模板,建立11个三重PCR反应体系,第1个反应管中加入EPEC、EIEC和ETEC的DNA,第2~4个反应管中分别加入EPEC、EIEC和ETEC两两组合的DNA,第5~11个反应管中分别加入7种阴性对照的DNA,同时以去离子水做空白对照,进行同一批次的三重实时PCR扩增,检测各个反应中JOE、FAM和CY5荧光基团有无指数期增长变化,以此判定本试验所采用引物及探针的特异性是否良好。
1.3.5 灵敏度检测
将已知 EPEC 含量(约为 4.30×107cfu·mL-1)的乳样加入到一系列灭菌原料乳中,分别调节乳样中EPEC 浓 度 约 为 4.30 ×106、 4.30 ×105、 4.30 ×104、4.30×103、4.30×102、2.15×102、1.08×102、4.30×101和 4.30×102cfu·mL-1;将已知 EIEC 含量(约为2.81×108cfu·mL-1)的乳样加入到一系列灭菌原料乳中,分别调节乳样中 EIEC浓度约为2.81×107、2.81×106、2.81×105、2.81×104、2.81×103、2.81×102、1.41×102、2.81×101cfu·mL-1;同样,将已知ETEC 含量(约为 1.08×108cfu·mL-1)的乳样加入到一系列灭菌原料乳中,分别调节乳样中ETEC浓度约 为 1.08 ×107、 1.08 ×106、 1.08 ×105、 1.08 ×104、1.08×103、5.40×102、2.70×102、1.08×102、1.08×101cfu·mL-1。再按照1.3.1方法分别提取上述乳样中细菌基因组DNA,提取的DNA分别用Taqman三重实时PCR进行扩增,根据扩增曲线的形态及Ct值确定该方法的检测限。
同时分别将菌含量均约为1 cfu·mL-1的EPEC、EIEC和ETEC乳样置于37℃,200 r·min-1摇床培养,分别于培养0、1、2和3 h后各取1 mL,按照1.3.1方法提取细菌基因组DNA,所提DNA用于Taqman荧光PCR扩增,以确定当检测限为1 cfu·mL-1时的增菌时间。
1.3.6 重复性检测
将 37 ℃振荡(200 r·min-1)培养 16 h后,已知 EPEC浓度约为 4.30×107cfu·mL-1,EIEC浓度约为 2.81×108cfu·mL-1,ETEC 浓度约为 1.08×108cfu·mL-1的3种乳样,分别进行10和100倍稀释,按照1.3.1方法分别提取乳样的基因组DNA,每种菌株各得到3组浓度不同的DNA模板,按照已经确定的1.3.2方法对3组不同浓度的DNA进行批内和批间重复性检测。在批内重复性检测中,DNA模板选取以上3种浓度;在批间重复性检测中,DNA模板只选取一种浓度(所对应的ETEC的浓度约为1.08×108cfu·mL-1,EIEC 的浓度约为 2.81×107cfu·mL-1,EPEC浓度约为4.30×105cfu·mL-1),分5批次重复进行PCR反应。以上每一种反应体系均同时做3个重复,最后对获得的Ct值进行汇总,通过计算样品不同Ct值的变异系数来评定该方法的重复性。
1.3.7 原料乳中致泻性大肠埃希氏菌的检测
采集哈尔滨市内及周边地区小型奶牛场或奶牛养殖户共38份原料乳样品,于37℃,200 r·min-1摇床培养2 h后,按照1.3.1方法提取DNA,所提取的DNA按照1.3.2方法进行三重荧光PCR扩增。同时采用中华人民共和国国家标准GB/T 4789.6-2003文献[6]。比较国标方法和本研究所建立方法的检测结果。
2 结果与分析
2.1 特异性检测
三种原料乳中常见的致泻性大肠埃希氏菌和7种阴性对照菌株经三重实时PCR检测后结果见图1。每个反应管中均含JOE、FAM和CY5(分别代表eaeP、ipaHP和ltP探针的荧光信号)3种荧光探针,管与管之间的区别在于DNA种类的不同。管1中含有三种菌的DNA,对管1检测到3条荧光曲线,一条为JOE荧光形成,一条为FAM荧光形成,另一条为CY5荧光形成。管2中有EPEC和EIEC两种菌的DNA,故只有两条荧光曲线。管3中只有EIEC和ETEC两种菌的DNA,故只有FAM和CY5的荧光曲线。管4中只有EPEC和ETEC两种菌的DNA,故只有JOE和CY5的荧光曲线。管5~11分别为其他菌的DNA,均未检测到荧光增加信号,表现为阴性。由此看出,三重荧光PCR反应时3种探针的荧光扩增曲线,与3种探针两两组合反应时并无明显区别,也说明引物和探针与其他致病菌无交叉反应,三重荧光PCR具有良好的特异性。
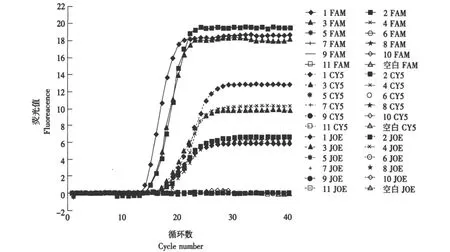
图1 以目的菌株DNA与阴性对照菌株DNA为模板的Taqman三重实时PCR扩增Fig.1 Taqman triplex real-time PCR amplication curves with DNA of target strains and negative control strains
2.2 灵敏度检测
从图2可以看出,当EIEC含量在2.81×108~1.41×102cfu·mL-1时,均能检测到荧光信号和Ct值,但在EIEC含量为1.41×102cfu·mL-1时,扩增曲线已经不明显,且Ct值为32.67,明显大于30,因此,Taqman三重实时PCR对EIEC的检出限可达到2.81×102cfu·mL-1,同理可得出,Taqman 三重实时PCR对EPEC的检出限可达到2.15×102cfu·mL-1(见图3),对ETEC的检出限可达到5.40×102cfu·mL-1(见图 4)。
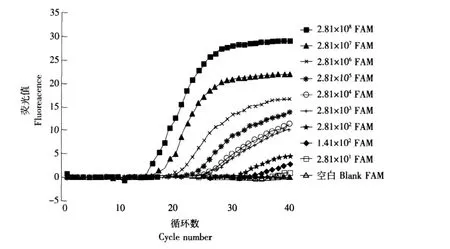
图2 Taqman三重实时PCR对不同浓度的EIEC的扩增Fig.2 Taqman triplex real-time PCR amplication curves with artificial polluted milk containing EIEC of different concentrations

图3 Taqman三重实时PCR对不同浓度的EPEC的扩增Fig.3 Taqman triplex real-time PCR amplication curves with artificial polluted milk containing EPEC of different concentrations
此外,由于通常致泻性大肠埃希氏菌在原料乳中的数量较小,甚至达到每毫升个位的数量,所以需要对采集的原料乳进行一定时间的前增菌处理,以提高该方法于实际应用中的可行性,并且可以通过缩短增菌时间的方式,来达到快速检测的目的。将3种原始菌体浓度均为1 cfu·mL-1的奶样于摇床培养2 h后提取细菌基因组DNA,然后进行Taqman三重实时PCR,即可出现典型S型扩增曲线。说明该方法在2 h增菌处理后检测限可达到 1 CFU·mL-1。
2.3 重复性检测
表2是3种不同浓度的模板批内重复性试验的Ct值结果。从表2可看出,虽然3组中所用DNA浓度不同,但各自扩增Ct值的SD和CV值都较低,CV值均小于5%,说明用不同浓度的DNA所做的Taqman三重荧光PCR扩增所得结果稳定可靠。在同一菌体范围内,随着菌体浓度的减小,SD和CV值有上升趋势,即稳定性降低,所以在应用此方法时要尽量提高菌液浓度以减小误差提高稳定性。
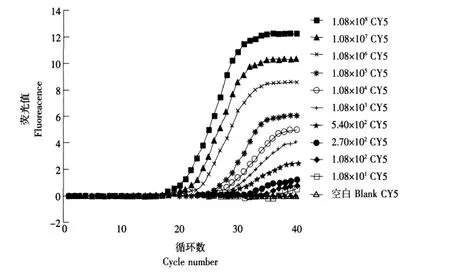
图4 Taqman三重实时PCR对不同浓度的ETEC的扩增Fig.4 Taqman triplex real-time PCR amplication curves with artificial polluted milk containing ETEC of different concentrations

表2 所建立的Taqman三重实时PCR法的批内重复性检验的Ct值
表3为批间重复性试验结果,该表中显示的CV值均在合理的范围内(CV<5%)。虽然EIEC的浓度比ETEC低,但Ct值是最小的,说明EIEC的扩增最为理想。
批内和批间的重复性试验结果说明,该试验的稳定性和重复性较好。
2.4 市售原料乳中致泻性大肠埃希氏菌的检测
分别采用国标GB/T 4789.6-2003的方法和Taqman三重实时PCR方法检测所采集的38份原料乳样品,两种方法所获得结果高度一致:均共检出致泻性大肠埃希氏菌10株,其中EPEC 4株,ETEC 4株,EIEC 2株。说明本试验所建立的Taqman三重实时PCR检测原料乳中致泻性大肠埃希氏菌的方法准确可行,且Taqman三重实时PCR方法检测样品只需6 h即可完成全部过程,操作简便,而国标GB/T 4789.6-2003方法检测样品需耗时4~5 d。
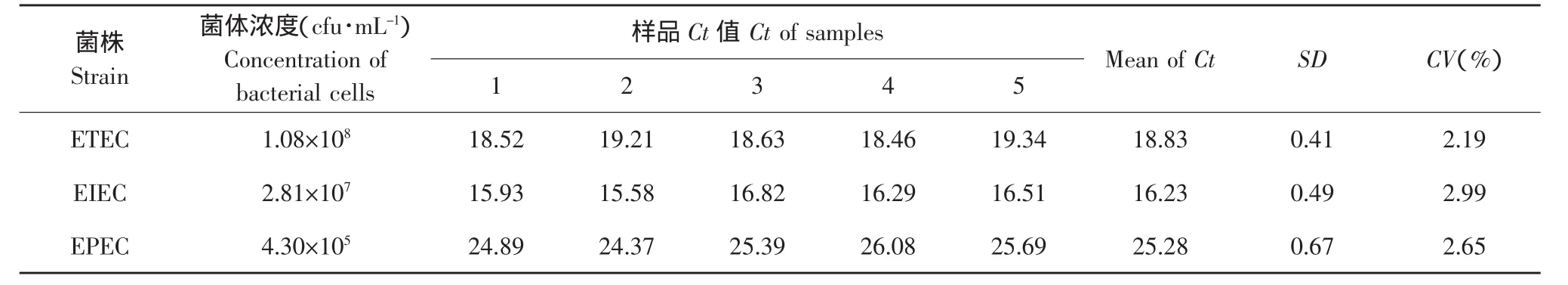
表3 所建立的Taqman三重实时PCR法的批间重复性检验的Ct值Table 3 Threshold cycle value of inter-assay of reproducibility test of Taqman triplex real-time PCR
3 讨论
针对致泻性大肠埃希氏菌的常规分离培养方法主要是指GB/T 4789.6-2003中所用方法,该方法主要分为增菌、分离、生化试验、血清学试验、肠毒素试验五个部分,前后耗时约4 d,该方法的优点是结果准确可靠,可检测出致泻性大肠埃希氏菌的血清型,缺点是所耗时间较长,且操作繁琐,检测结果无法表明致病菌所携带的致病基因[17]。免疫学检测方法存在与非抗原物质之间的非特异性反应,从而会产生假阳性结果,而如果待测抗原被样品中一些物质或其他优势菌群所掩蔽,又会产生假阴性结果。大肠杆菌的抗原很复杂,各种肠道细菌之间可能会发生基因的水平转移,而且还存在抗原表达不完全和抗原间抑制抗原-抗体凝集反应的现象,从而影响了免疫学方法的特异性和敏感性。PCR技术因其特异性强、灵敏度高、操作简便、所需时间短等优点,成为当前最先进、最广泛使用的检测技术。而加染料或探针的荧光实时PCR既保持了PCR技术灵敏、快速的特点,又克服了以往PCR技术中存在的假阳性污染和不能进行准确定量的缺点,可实现实时监控,且不需要普通PCR的后处理,极大地减少了污染的机会,同时也避免了染色剂对人体的毒害作用[9,13]。致泻性大肠埃希氏菌包括很多致病基因,若要实现在同一个反应中将致病基因全部检出的目的,就需要应用多重PCR技术。根据所用荧光物质的不同,荧光实时PCR技术主要分为SYBR GreenⅠ染料法、Taqman探针法和分子信标法。本文所研究的Taqman多重实时PCR技术即可在同一PCR反应管内同时检出3种病原微生物,有效地解决了单基因PCR体系1次只可检测1个基因型的低效缺点,具有高效、快捷、灵敏的特点。
本方法对3种致泻性大肠埃希氏菌的检出限均可达到102cfu·mL-1,但通常致泻性大肠埃希氏菌在原料乳中的数量较小,能达到每毫升几十个甚至几个的数量,由于如果直接从所采集的样品中提取DNA后,进行Taqman三重实时PCR扩增,势必会造成假阴性的结果,所以需要对原料乳进行一定的增菌处理,以提高该方法于实际应用中的可行性。本研究在2 h增菌处理后可达到1 cfu·mL-1,符合致泻性大肠埃希氏菌在原料乳中的实际存在状况,具备实际应用价值。
张伟钦对EPEC和EIEC原始菌体浓度分别为为8.8和6.7 cfu·mL-1的两份乳样进行2 h的增菌处理后,进行双重实时PCR,两种菌均可出现扩增曲线,但Ct值要略高于本试验[7]。Bottero等对模拟乳样过夜增菌后,在多重PCR中加入六对引物检测致泻性大肠埃希氏菌的基因型,对于ETEC的st和lt的检测限分别为 5×104和 5×106cfu·mL-1[8],由于常规PCR较荧光PCR灵敏度不够,同时多对引物间的竞争作用提高体系的复杂性,从而降低扩增效果,使得检测限较高,但可看出若选择st基因作为ETEC的目的基因,于相同条件下可相对提高检测限。
4 结论
本研究采用已建立了反应体系和循环参数的三重实时PCR方法可快速检测原料乳中致泻性大肠埃希氏菌,达到了一次PCR反应即可检测3种病原菌的目的。试验证实此方法特异性强,重复性良好,CV值均小于5%,对EIEC的检出限可达到2.81×102cfu·mL-1,对 EPEC 的检出限可达到2.15×102cfu·mL-1,对 ETEC的检出限可达到 5.40×102cfu·mL-1,同时当致泻性大肠埃希氏菌菌体浓度达到1 cfu·mL-1时,只需富集培养2 h,即可检出阳性结果,大大提高了灵敏度,完成全部检测过程只需大约6 h,简便快捷,可实时监控反应进程。
[1]Nataro J P,Kaper J B.Diarrheagenic Escherichia coli[J].Clinical Microbiology Reviews,1998,11(1):142-201.
[2]陈萍,李泽鸿,邴伟.致泻性大肠杆菌研究进展[J].上海畜牧兽医通讯,2007(4):11-13.
[3]姚敬业,金庆.1996年发生在日本的大肠菌O157食物中毒[J].安徽预防医学杂志,2000,6(1):79-80.
[4]陈海婴,邹国和,范义兵.南昌市一起肠侵袭性大肠埃希氏菌(EIEC)致感染性腹泻病爆发的临床与实验室研究[J].现代诊断与治疗,1999(1):83-84.
[5]王慧,胡智慧,张洪花.一起由产毒性大肠埃希菌引起的腹泻暴发疫情[J].中国病原生物学杂志,2008,3(8):636-637.
[6]李玉锋,代娟,康薇,等.肠毒素大肠埃希菌定时定量PCR法检测[J].中国公共卫生,2007,23(9):1146-1147.
[7]张伟钦.Taqman双重实时PCR快速检测原料乳中致泻性大肠埃希氏菌方法的建立[D].哈尔滨:东北农业大学,2009.
[8]Bottero M T,Dalmasso A,Soglia D,et al.Development of a multiplexPCRassayfortheidentificationofpathogenicgenesof Escherichia coli in milk and milk products[J].Molecular and Cellular Probes,2004,18:283-288.
[9]Zhang T N,Li J C,Lu C W,et al.A multiplex PCR assay for the detection of pathogenic genes of EPEC,ETEC and EIEC[J].Journal of Northeast Agricultural University:English Edition,2006,13(1):51-54.
[10]Fu Z,Rogelj S,Kieft T L.Rapid detection of Escherichia coli O157:H7 by immunomagnetic separation and real-time PCR[J].International Journal of Food Microbiology,2005,99(1):47-57.
[11]Toma C,Lu Y,Higa N,et al.Multiplex PCR assay for identification of human diarrheagenic Escherichia coli[J].Journal of Clinical Microbiology,2003,41(6):2669-2671.
[12]Ibekwe A M,Watt P M,Grieve C M,et al.Multiplex fluorogenic real-time PCR for detection and quantifcation of Escherichia coli O157:H7 in dairy wastewater wetlands[J].Applied and Environmental Microbiology,2002,68(10):4853-4862.
[13]West D M,Sprigings K A,CASSAR C.Rapid detection of Escherichia coli virulence factor genes using multiplex real-time Taqman PCR assays[J].Veterinary Microbiology,2007,122(3-4):323-331.
[14]Köppel R,Ruf J,Zimmer F,et al.Multiplex real-time PCR for the detection and quantification of DNA from beef,pork,chicken and turkey[J].Eur Food Res Technol,2008,227:1199-1203.
[15]Rademaker J L W,Hoolwerf J D,Wagendorp A A,et al.Assessment of microbial population dynamics during yoghurt and hard cheese fermentation and ripening by DNA population fingerprinting[J].International Dairy Journal,2006,16(5):457-466.
[16]GB/T 4789.6-2003,食品卫生微生物学检验致泻大肠埃希氏菌检验[M].北京:中国标准出版社,2003.
[17]付宇.原料奶中致泻性大肠埃希氏菌的调查研究[D].哈尔滨:东北农业大学,2009.
