不同类型化学平衡的热力学本质
2010-07-02张志红赵秀峰
张志红 赵秀峰
(昌吉学院化学与应用化学系 新疆昌吉831100)
式中,是标准压力pθ下纯凝聚相物质的摩尔Gibbs自由能。注意,(4)式和(1)式有明显的不同。
设想反应是在封闭的定温定压反应器中进行(图2)。当反应进度从ξ增大到ξ+dξ,根据(4)式,系统的Gibbs自由能变量为:
自学之友
不同类型化学平衡的热力学本质
张志红 赵秀峰
(昌吉学院化学与应用化学系 新疆昌吉831100)
探讨了定温定容下气相化学平衡、复相化学平衡和纯凝相化学平衡的热力学本质。指出,对于不同类型的反应,建立化学平衡的根本原因其实是不相同的,不能简单地都归因于混合过程对系统Gibbs自由能的影响。
化学平衡是一个普遍的化学现象,阐明化学平衡的热力学本质是物理化学教学的重要内容。对于定温定压下的气相化学平衡,大部分物理化学教科书都有讨论。化学平衡的存在归因于物质的混合,导致系统Gibbs自由能G对反应进度ξ的曲线中出现一个极小值,这样就从热力学上证明了化学平衡的存在[1-4]。
但是,对于在定温定容下的气相化学平衡,从热力学上应当如何理解?另外,一些复相反应(如CaCO3(s)=CaO(s)+CO2(g))和纯凝聚相反应(如8Hg(l)+S8(s,a)=8HgS(s))并不存在物质的混合(类似气体或溶液那样混合成为一个相),这些反应是否存在化学平衡?或者在什么条件下能够建立化学平衡?现有的物理化学教科书对上述问题很少涉及,本文将就这些问题进行热力学分析。
1 定温定容下气相化学反应
在定温条件下,多组分系统中物质的化学势μi可以有两种形式不同但数值相等的定义:



式中pi为混合气体中i组分的分压,pθ为标准压力为在指定温度T和标准压力pθ下气体i的化学势。
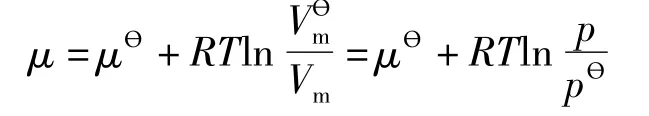

可以看出,不论以G还是以A定义化学势,(1)式都成立。



和(1)式,可以类似地证明

式中,Δr是c mol纯C与b mol纯B在指定温度T、标准压力pθ下的Helmholtz自由能的差值,定温下是一个常量。若正反应可以进行完全,ξ从0增大到1mol,则从-∞增大到+∞。所以,不论反应的Δr是正值还是负值,系统的必然也会从-∞逐渐增大到+∞,即A-ξ曲线必然有一个极小值由于在定温定容下的过程不可能自发进行,反应必然会在处达到平衡。因此,对于定温定容下理想气体化学反应,化学平衡是必然存在的。
为了阐明在定温定容下理想气体化学平衡的热力学本质,设想反应通过3步虚拟的定温过程完成(图1)。
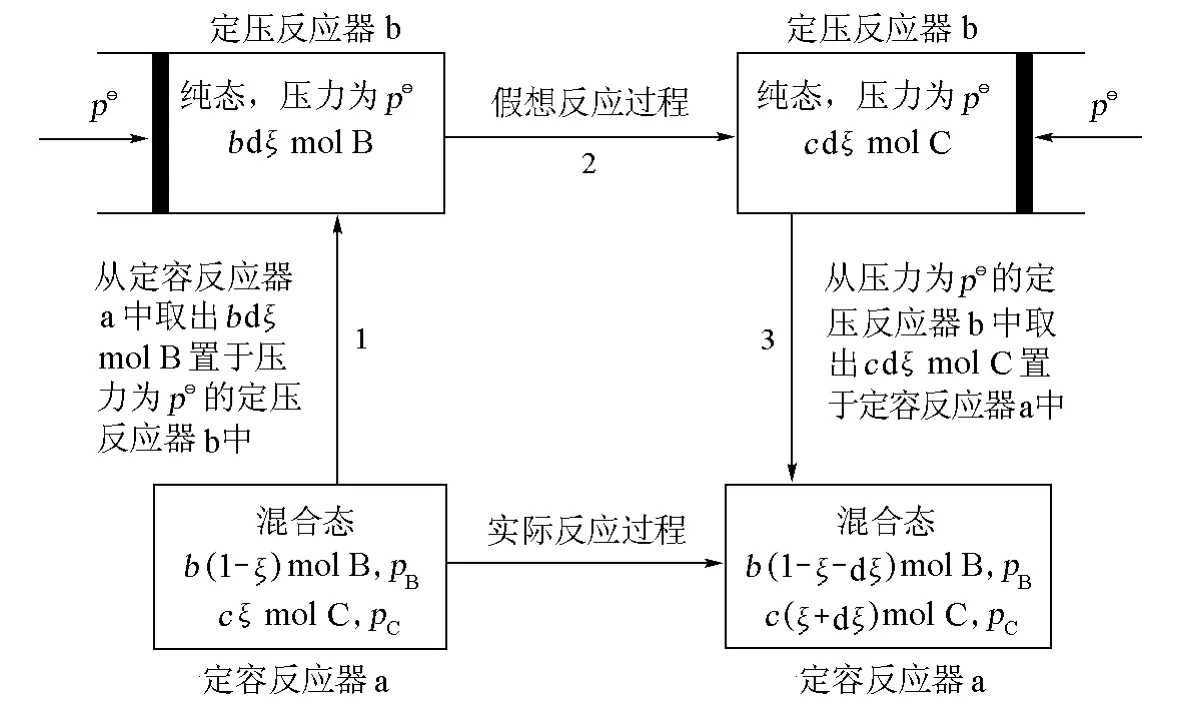
图1 定温定容下气相化学反应b B=c C的3步虚拟定温过程
1)在反应进度为ξ时,将b dξmol分压为pB的B从定容反应器a中取出,置于一个压力为pθ的定压反应器b中,Helmholtz自由能变量为:

2)在压力为pθ的定压反应器b中,b dξmol纯B转化为c dξmol纯C,Helmholtz自由能变量为:

3)将c dξmol压力为pθ的C从定压反应器b中转入到定容反应器a中,C的分压变为pC,Helmholtz自由能变量为:
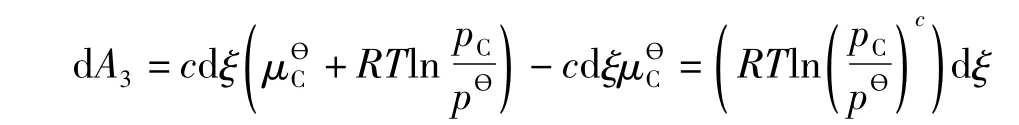
3步总的Helmholtz自由能变量为:
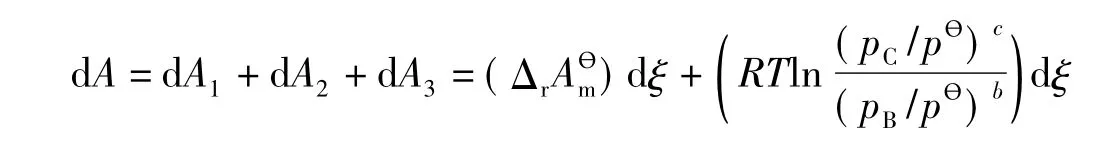
则:

对于定温定容下的实际气体反应,只要将压力改为逸度,上述推导仍然成立。
2 复相化学反应
下面以反应CaCO3(s)=CaO(s)+CO2(g)为例,讨论复相化学平衡的热力学本质。假设反应开始时,系统中只有1mol CaCO3固体。
设想反应在一个真空的定温定容封闭系统中进行,则应当用系统的Helmholtz自由能讨论反应的方向。因为3种物质不相互混合,其摩尔Helmholtz自由能Am等于化学势μ,在定温条件下,满足d Am=dμ=-p d Vm。对于CaCO3(s)和CaO(s),可以忽略压力对其摩尔体积Vm的影响,那么它们的摩尔Helmholtz自由能近似为常量,数值上可以近似为标准压力下的摩尔Helmholtz自由能,分别记为Aθm(CaCO3)和Aθm(CaO)。设CO2为理想气体,在温度T下,CO2的摩尔Helmholtz自由能(即化学势)可以根据(1)式表示为:
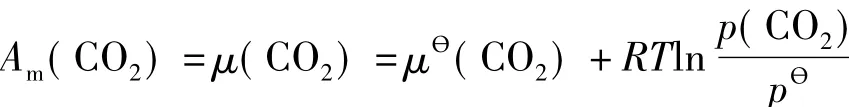
显然,它是CO2压力p(CO2)(也就是系统的压力)的函数。
在温度T下,当反应进度从ξ增大到ξ+dξ,系统的Helmholtz自由能变量为:
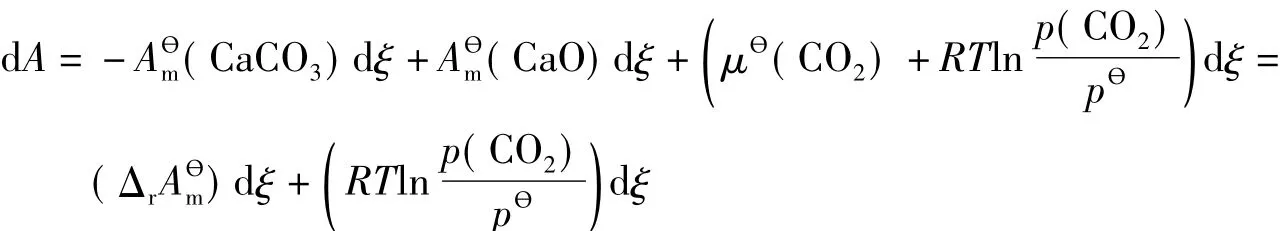
若反应能够达到平衡,必有:

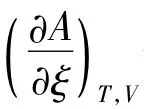
如果CaCO3(s)的分解反应在定温定压下进行,容易证明,满足化学平衡的条件是:

显然,在指定温度T下,建立化学平衡的压力peq(CO2)也是唯一的。因此在定温定压反应器中,只有当反应器的压力p恰好等于该温度T下的平衡压力peq(CO2)时,反应才可以达到平衡。若反应器的压力p小于平衡压力peq(CO2),CaCO3(s)将分解完全;若反应器的压力p大于平衡压力peq(CO2),CaCO3(s)不发生分解,两种情况下,均不存在化学平衡。
总之,对于复相反应CaCO3(s)=CaO(s)+CO2(g),化学平衡并不总是存在的。反应系统中,两个固相(CaCO3和CaO)和一个气相(CO2)均为单组分,化学平衡能否建立,取决于系统的压力是否可能等于peq(CO2)。
3 纯凝聚相反应
下面以反应8Hg(l)+S8(s,a)=8HgS(s)为例,讨论纯凝聚相化学平衡的热力学本质。
纯凝聚相在定温条件下均满足dμ=d Gm=Vmd p,若忽略汞Hg(l)、硫S8(s,a)和硫化汞HgS(s)的摩尔体积Vm随压力的变化,并将其近似为标准压力pθ下的摩尔体积Vθm,则它们的化学势,即摩尔Gibbs自由能Gm随压力的变化可以推导如下:

设想反应是在封闭的定温定压反应器中进行(图2)。当反应进度从ξ增大到ξ+dξ,根据(4)式,系统的Gibbs自由能变量为:
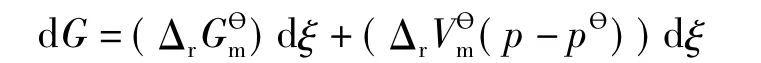
式中Δr和Δr是标准压力pθ下反应的Gibbs自由能变量和体积变量。反应达平衡时有:

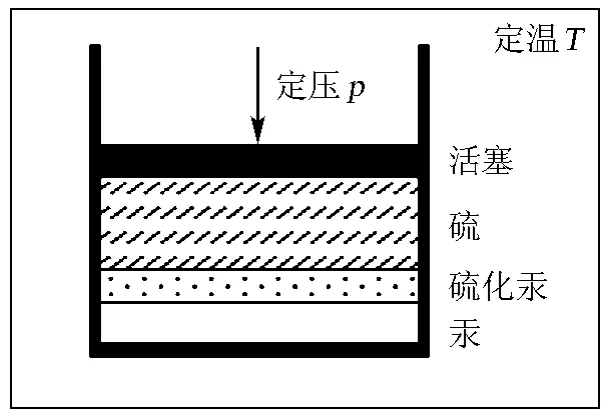
图2 定温定压下的化学反应
式中peq是平衡压力。显然,在温度T下,满足(5)式的peq是唯一的。这就是说,施加在系统上的压力p只有恰好等于peq时,化学平衡才能存在。在手册中[5]查得,在常温(298K)下,红色HgS(s)的Δf=-50.6kJ·mol-1,红色HgS(s)、Hg(l)和S8(s,a)的密度分别为8.17、13.534和2.08g·cm-3,由此可以算出在常温下反应的Δr=-4.048×105J·mol-1,Δr= -1.408×10-5m3·mol-1,取pθ=105Pa,求出peq大约为-2.875×1010Pa。压力为负值是不合理的,这意味着在常温下恒小于0,反应会持续进行,直至某种反应物消耗完全,不存在化学平衡。这就是在实验室中可以用硫粉处理洒落的汞滴的原因。
假如在某个温度和对应的压力下,反应8Hg(l)+S8(s,a)=8HgS(s)能够达到平衡,那么平衡常数又如何表示呢?从(5)式可以得出,达平衡时有:
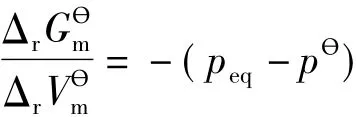
显然,在指定温度T下,(peq-pθ)是一个常数。对于纯凝聚相化学反应,理论上可以定义其平衡常数为:
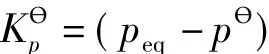
其单位为Pa。由于习惯上的原因,对这类反应,通常只说在温度T时的平衡压力peq,并不强调其平衡常数。
4 结论
对于不同类型的化学反应,导致化学平衡的热力学本质是不完全相同的,不能简单地都归因于物质的混合对系统Gibbs自由能的影响。
[1] 傅献彩,沈文霞,姚天扬,等.物理化学.第5版.北京:高等教育出版社,2005
[2] 印永嘉,奚正楷,李大珍.物理化学简明教程.第3版.北京:高等教育出版社,1992
[3] Atkins P,de Paula J.Atkins'Physical Chemistry.第7版.影印版.北京:高等教育出版社,2006
[4] Denbigh K G.化学平衡原理.第4版.戴冈夫,谭曾振,韩德刚译.北京:化学工业出版社,1985
[5] Dean JA,Lange's Handbook of Chemistry.第15版.影印版.北京:世界图书出版公司,1999
