储氢材料的新载体
——金属有机框架材料
2010-07-02赖文忠戈芳李星国
赖文忠戈芳李星国*
(1三明学院化学与生物工程系 福建三明365004;2北京大学化学与分子工程学院 北京100871)
今日化学
储氢材料的新载体
——金属有机框架材料
赖文忠1,2戈芳1,2李星国2,*
(1三明学院化学与生物工程系 福建三明365004;2北京大学化学与分子工程学院 北京100871)
氢的存储对于21世纪“氢经济”的发展至关重要。金属有机框架(MOFs,metal-organic frameworks)材料是一种新型多孔结晶材料,具有高孔性、比表面积大、合成方便、骨架大小可调、纯度高及结晶性好等优点。这类材料在气体存储尤其是氢的存储方面展示出广阔的应用前景,已成为研究储氢材料载体的热点。本文主要介绍MOFs材料的结构特点、合成方法、储氢性能及其影响因素,进一步对MOFs储氢材料的发展进行展望。
能源是社会存在与发展的物质基础,随着工业化的进程和人们生活水平的提高,对能源的需求与日俱增。现代工业依赖的化石燃料储量有限、不可再生,且在使用中存在环境污染等问题,因此寻找可再生的绿色能源迫在眉睫。氢能资源丰富,能量密度高且环境友好,已引起广泛关注[1]。世界各国都高度重视氢能的开发和利用,期望在21世纪中叶进入“氢经济”时代[2]。氢能的有效开发和利用需要解决的3个关键问题是氢的制取、存储和应用。作为其中的重要环节之一——氢的存储,要求储氢系统安全、容量大、成本低和使用方便。2010年,美国能源部(DOE)提出的实用化储氢系统的指标为:储氢质量百分数为6.5%,体积容量为62kg/m3,车用储氢系统的储氢能力大于3.1kg/m3[3]。我国也高度重视储氢技术的发展,在“863”高新技术发展规划和“973”计划中,储氢材料是重点研究的项目。储氢材料(系统)应满足以下要求:①环境温度下尽可能低的储放压强;②高的存储能力;③放氢速度快、能耗小、安全性高;④循环使用寿命长。
目前发展的储氢方式有:氢气液化或者通过金属/合金、配位金属化合物、有机液体、碳基多孔材料吸附氢气等。储氢材料按材料与氢的结合方式可分为两大类:化学储氢(如储氢合金、配位氢化物、氨基化合物、硼氢化合物、有机液体等)和物理储氢(如碳基材料等)[4]。传统的储氢材料由于储氢量较低、成本较高,难以满足氢能源工业的需求。因此,需继续探索新型的储氢材料。近年来,金属有机框架(metal-organic frameworks,简称MOFs)材料备受关注。这种材料由金属离子和有机配体形成,具有孔隙率高、比表面积大、结构丰富、骨架可调控以及纯度和结晶度高等优点,已成为储氢载体材料研究的热点。本文主要介绍MOFs材料的结构特点、合成方法、储氢性能及其影响因素,并对MOFs储氢材料的发展前景进行展望。
1 金属有机框架材料的结构特点
金属有机框架材料是一类由金属离子与含氧、氮等的多齿有机配体(大多数是芳香多酸)自组装形成的微孔网络结构的配位聚合物。按配体的不同,可分为羧酸类配合物、含氮杂环类配体聚合物、混合配体类配合物、有机膦配体构筑的配位聚合物等。MOFs材料的结构特点主要有:①多孔性与孔形状的多样性。MOFs的孔径范围一般在0.38~2.88nm。例如,MOF-177[5]孔径为1.09~1.18nm,是目前已知的储氢量最大的化合物;MIL-101[6]孔径为3.0~3.4nm;具有相互贯穿的微孔和介孔结构的[Cu(btc)2(H2O)3][7]最大孔径达31nm,是目前报道的孔洞最大的化合物。②比表面积大。设计和合成高比表面积的物质是多孔材料研究的挑战之一。已知的材料中,活性炭的最大比表面积为2030m2·g-1,沸石的最大比表面积为904m2·g-1,许多MOFs材料的比表面积可超过1000m2·g-1,而MOF-177的比表面积高达4500m2·g-1[5],迄今为止发现的比表面积最大的 MOFs材料(MIL-101)的比表面积达5900m2·g-1[6]。③结构的多样性。有机配体及配体与中心金属离子配位结合方式的多样性决定了MOFs材料结构的多样性;通过选择和调整有机配体的大小和形状,可以控制合成不同拓扑结构、不同孔径大小的MOFs。④金属配位的不饱和性。在MOFs材料的合成中,因空间位阻等原因,金属离子除了与大的有机配体配位外,还会结合一些小的溶剂分子(如水、乙醇、DMF等)以满足其配位数的要求。这类MOFs材料在高真空下加热一段时间,小分子会从骨架中排出,引起金属离子配位的不饱和,具有了结合其他分子的能力,也会导致骨架结构产生碱性位和酸性位。
2 金属有机框架材料的合成
要合成具有一定性质和结构的MOFs化合物,需要合理选择反应物并控制反应条件。主要影响因素包括:①中心金属离子。金属离子对配位聚合物的最终结构具有决定作用。选用不同的金属离子可对组装过程进行调控,不同配位构型的金属离子可得不同拓扑结构的分子网络结构。中心金属原子多选过渡金属离子,如Zn2+、Cu2+、Ni2+、Pd2+、Pt2+、Ru2+和Co2+等。②有机配体。有机配体对配位聚合物的合成也起决定作用。不同的配体既影响配合物的合成,又影响配体网络的空间结构,控制着金属-金属之间的距离和晶体结构维数。有机配体要求含有两个或两个以上给电子原子的多齿型官能团如CO2H、CS2H、NO2、SO3H、PO3H等的化合物。其中,羧酸根离子与金属离子之间的配位作用强,配位方式多样,在MOFs材料合成中的应用最为广泛。常见的羧酸配体有对苯二甲酸、均苯三甲酸、羧基取代的苯氧乙酸等芳香羧酸配体。③金属离子和配体的物质的量比。改变金属离子与配体的物质的量比,可引起金属离子配位数的改变。④溶剂和模板剂。金属盐和多数配体都是固体,需要溶剂溶解,同时配体应去质子化以促进其对中心离子的配位作用,目前使用较多的去质子化碱为有机胺类物质,如三乙胺,N,N-二甲基甲酰胺(DMF)、N,N-二乙基甲酰胺(DEF)等。为了使合成的金属有机框架具有理想孔隙,还需要选择适宜的模板试剂。有机胺离子(如乙胺、三乙胺、二甲胺等)、无机阴离子、中性客体分子(如联吡啶)都可以在配位化合物的形成过程中起模板效应,不同的模板剂会产生结构完全不同的框架,有关模板剂调节MOFs孔结构的机制还有待深入研究。溶剂分子与骨架间的弱相互作用,是稳定骨架的一种有效方法,溶剂分子不仅可作为客体分子填充在化合物的孔洞中,避免产生太大的空间,还可作为客体诱导形成具有不同结构和功能的化合物;去质子化溶剂的选择也会影响产物的框架结构。⑤温度和pH。温度不同会影响有机配体的配位能力,导致生成的框架结构不同;pH控制着体系的质子数,直接影响配体的结构和配位能力,反应溶液的pH不同,生成的框架结构也不同,pH增大会使MOFs材料的框架单元随之增大。⑥阴离子。体系中的阴离子既起平衡电荷作用,又影响配合物拓扑结构产生。阴离子的配位能力、阴离子的体积及阴离子的模板效应,在一定程度上决定了配合物最终结构的形成。
MOFs材料的合成多采用溶液法和溶剂热(水热)法,离子液体法、微波和超声波合成法等也有报道。在溶液法中,将金属盐、有机配体和溶剂按一定比例混合,放入一个小玻璃瓶中,将此小瓶置于加入去质子化溶剂的大瓶中,封住大瓶口,静置一定时间后即有晶体生成。该方法条件比较温和,易获得高质量单晶,但反应较耗时,且要求反应物在室温下能溶解于所选溶剂体系。溶剂热法是将反应物与有机胺、去离子水、乙醇和甲醇等溶剂混合,放入带有聚四氟乙烯衬里的不锈钢反应釜中,在一定温度(一般100~200℃)使反应发生。该方法解决了反应物在室温难溶的问题,具有反应时间短、晶体质量好等特点。离子液体法采用在室温或接近室温时能以液体存在、极性高的有机盐做溶剂,这类溶剂对某些体系溶解能力强,反应过程蒸气压低,热稳定性高。微波和超声波法合成MOFs,则具有产物结晶快、物相选择性好、产物粒径分布窄和物相形态易控的特点。
3 金属有机框架材料的储氢研究及影响储氢性能的因素
MOFs材料储氢原理基于物理吸附,其最大储氢量与比表面积有近似的线性关系,这意味着提高比表面积可提高其储氢量[4]。因此,大的比表面积是作为储氢的MOFs材料应具有的基本特性。在开展MOFs材料储氢性能的实验和理论研究中[8-15],MOF-5的研究开创了该领域的先河[16],2003年首次报道了其储氢性能的测试结果[17]。MOF-5的典型结构见图1,它在298K、2MPa的条件下吸氢量为1.0%(质量分数,下同),在77K、0.1MPa为4.5%。在室温下,MOFs的储氢量一般小于1.0%,在77K时饱和吸氢量一般为2.0% ~7.3%(5~8MPa)[18]。目前报导的储氢量最大的是MOF-177(图2[19]),它在77K、7MPa条件下的饱和储氢量达7.5%[5],这一结果已达到美国能源部(DOE)提出的2010年储氢目标。美国国家标准技术研究院(NIST)、马里兰大学和加州理工学院组成的一个研究组对金属有机骨架结构材料用作储氢材料的可能性评价指出,MOFs材料结合并释放氢具有明显的优势。MOF-74是一种多孔晶体粉末(图3[20]),其微观结构像紧密捆扎在一起的“麦秆”束,这种“麦秆”结构主要由碳原子构成,内壁附有锌离子。利用中子衍射和气体吸附技术,研究人员发现77K时,MOF-74可以比目前任何不加压结构材料吸附更多的氢(表面组装密度更大),而这些氢分子比冰冻成块的氢更加紧密。
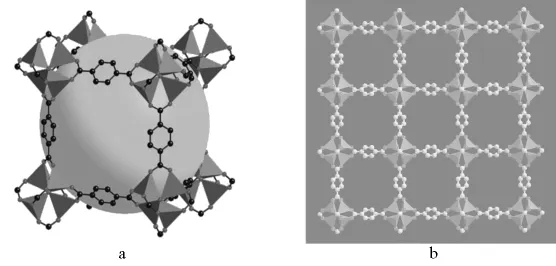
图1 MOF-5的典型结构图
为了进一步改善MOF-5的储氢性能,研究者通过改变MOF-5的有机联结体或者同时改变中心金属离子,以合成新的、结构类似的MOFs类材料IRMOFs(isoreticular metal-organic frameworks)和 MMOMs (microporousmetal-organic frameworks),已经实现了MOFs类储氢材料的储氢性能的明显改善。通过改变MOF-5中的有机联结体BDC[21-22],得到了一系列具有相同拓扑结构的多孔聚合物(IRMOF-n(n=1~16)),在相同条件下的储氢性能大多比MOF-5好,其中IRMOF-13的储氢量最高,达到10个氢气分子,其吸放氢容量为MOF-5(只有5个氢分子)的两倍。
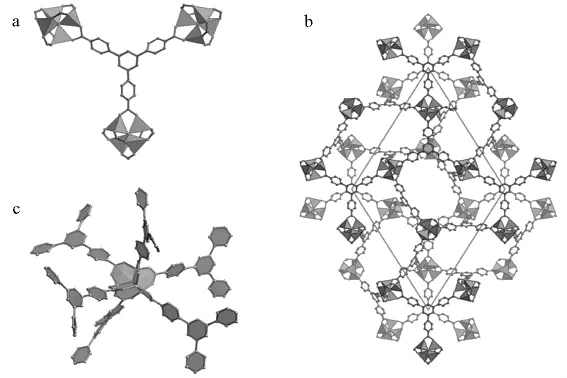
图2 MOF-177的结构

图3 MOF-74结构图
MMOMs系列配合物也具有和MOF-5相似的结构。其中,MIL-101在77K、8MPa条件下储氢量可达6.1%[6]。我国研究者在这一领域也作出了一系列的工作[23-31]。北京大学研究组合成了MMOMs材料M(HBTC)(4,4-bipy)·3DMF(M=Co,Ni)并研究了这类材料的储氢性能[23-25]。研究发现,活化温度太高会造成材料结构的坍塌和改变,活化温度太低则溶剂分子不能被完全除去而占据材料的孔道,影响材料的储氢能力。453K活化的Ni(HBTC)(4,4-bipy)·3DMF和433K活化的Co(HBTC)(4,4-bipy)·3DMF具有最高的比表面积,分别达到1590m2·g-1和887m2·g-1。Ni(HBTC)(4,4-bipy)·3DMF在77K和298K下的吸氢量分别达3.42%和1.20%,而Co(HBTC)(4,4-bipy)·3DMF在77K和298K下的吸氢量分别达2.05%和0.96%。南开大学[26]应用放射性稀土元素Sm与Co、Zn分别混杂制备了两种多孔性的MMOMs材料{[Sm2(L)6Co2][Co(H2O)]6·3H2O}n(Sm-Co)和{[Sm2(L)6Zn3(H2O)]6·1.5H2O}n(Sm-Zn)(H2L=oxydiacetic acid,乙二醇酸),其中Sm-Zn材料具有大的孔道结构,吸氢量在77K和298K时分别达到1.19%和0.54%。吉林大学课题组经过对有机配体和中心金属离子的改变,报道了多种MMOMs材料的合成[27-28],其中以Cd(Ⅱ)为中心金属离子、H2bpdc(2,2-联吡啶-3,3-二羧酸)为有机联结体的MMOMs材料JUC-48在77K、4MPa条件下的储氢量达到2.8%,相当于每克JUC-48吸附311.1mL氢气或每个JUC-48分子吸附12个氢气分子;以正方形叶轮型的Cu2(CO2)4(H2O)2为二级结构单元的具有NbO型网络拓扑的Cu2(ABTC)(H2O)2·(DMF)(H2O)(JUC-62)在77K、4MPa条件下的吸氢量达到4.71%。
影响MOFs材料储氢性能的主要因素有:①孔径大小和孔隙率。一般说来,孔径大小与所吸收气体分子的范德华半径相近时,它们的作用力最大。可通过调整孔径的大小调整MOFs的储氢量。减小孔径,可以提高氢分子与孔壁之间的作用力,但减小孔径常常会引起比表面积的减小,因此需要合成孔径大小合适、表面积较大的MOFs。MOFs孔径的大小调整可通过在大孔中插入一个客体分子实现。例如,在液相中向MOF-177的大孔(见图4所示[5])中引入C60和赖卡特染料等大分子[19],既可减小大孔的体积,又可引入新的吸附位,但引入的客体分子会增加基体密度,计算吸氢量需要考虑补偿。因此,引入客体分子时一般选用轻质、活泼、细长的分子化合物,防止引入的客体在吸收位引起堵塞和随氢气的释放而流失。也可通过互穿结构调控孔的尺寸,可以在不增加基体密度的前提下减小孔径的大小,且不会引起吸收位的堵塞。具有互穿结构的MOFs比没有互穿的MOFs的储氢量大。②比表面积。通常MOFs的比表面积越大,则饱和吸氢量越大,所以要增加吸氢量可以从增加比表面积入手。MOFs的孔壁越薄、暴露在外的边和面越多,比表面积越大,MOFs的网状结构也会增大比表面积。③等量吸附热。等量吸附热(Qst)是基于Clausius-Clapeyron方程的一个微分量,它与氢分子的吸收热有关,是评价多孔材料中吸附质与吸附剂之间作用力的一种方法。对于每个MOFs来说,达到饱和吸氢量时的压力不同,这与吸收热有关。研究表明,要增加MOFs的储氢量,可以提高Qst,即提高氢分子与MOFs之间的作用力,从而提高MOFs的室温储氢量。④有机配体。非弹性中子衍射(INS)实验表明,在MOFs中至少存在两种吸氢位,一种是伴随着无机簇的强吸收位,另一种是有机配体吸氢位。在有机配体周围吸引氢分子在高吸氢量时表现显著,有机配体尺寸越大,吸氢位越多[32]。有机配体的官能团还可剪裁孔径的尺寸和改变孔洞周围的环境[33]。有机配体的长度增加(如加入一个苯环),Qst一般会提高[34]。有机配体的选择和修饰会影响MOFs的吸氢量。⑤金属离子。MOFs金属离子组分也会影响其储氢量,金属离子越重,重量储氢量小,因此可以采用轻质金属离子为中心制备MOFs材料。
4 金属有机框架储氢材料展望

图4 MOF-177结构图
MOFs材料具有丰富的结构和较高的储氢容量,已成为储氢材料研究的热点。经过近10年的努力,MOFs材料在储氢领域的研究已经取得很大进展,如互穿结构的研究、氢气吸附位的确定等,不仅储氢性能有了大幅度提高,而且用于预测MOFs材料储氢的理论模型和理论计算也在不断发展、逐步完善。MOFs作为一类可望获得应用的新型储氢多孔材料,已显示出值得期待的应用前景。不过,目前仍有许多基本的理论和应用问题需要解决。例如MOFs材料的储氢机理、MOFs材料结构与其储氢性能的关系、MOFs中有机配体的官能团影响吸氢量的机理等。另外,等量吸附热(Qst)大的MOFs的比表面积往往较小,其吸氢量仍偏少,无法满足室温使用的要求;MOFs材料在77K时的吸氢量较大,但在常温常压下的储氢性能尚待提高,距车载储氢系统的要求还有很大差距。这些问题的解决将对提高MOFs材料的储氢性能并使之实用化起到重要的作用。
[1] 毛宗强.氢能——21世纪的绿色能源.北京:化学工业出版社,2005
[2] Rowsell JL C,Yaghi O M.MicroporousMesoporousMaterial,2004,73:3
[3] Chae H K,Siberio-Prez D Y,Yaghi O M,et al.Nature,2004,427:523
[4] 李星国.无机材料学报,2008,23(5):1000
[5] Furukawa H,Miller M A,Yaghi O M.JMater Chem,2007,17:3197
[6] Latroche M,Surble S,Serre C,et al.Angew Chem Int Ed,2006,45:8227
[7] Qiu L G,Xu T,Li Z Q,et al.Angew Chem Int Ed,2008,47:9487
[8] Panella B,Hirscher M,Müller U,et al.Adv Funct Mater,2006,16:520
[9] Zhou W,Wu H,Yildirim T.JAm Chem Soc,2008,130:15268
[10] Dybtsev D N,Kim D,Kim K,et al.JAm Chem Soc,2004,126:32
[11] Choi H J,Dinca M,Long JR.JAm Chem Soc,2008,130:7848
[12] Li YW,Yang R T.AICHE Journal,2008,54:269
[13] Mulfort K L,Hupp JT.Inorg Chem,2008,47:7936
[14] Han SS,Goddard W A.JPhys Chem C,2008,112:13431
[15] Bhakta R K,Herberg JL,Jacobs B,et al.JAm Chem Soc,2009,131:13198
[16] Li H L,Eddaoudi M,O'Keeffe M,et al.Nature,1999,6759:276
[17] Rosi N L,Eckert J,EddaoudiM,et al.Science,2003,5622:1127
[18] Wong-Foy A G,Matzger A J,Yaghi O M.JACSCommun,2006,128:3494
[19] Chae H K,Siberio-Psrez D Y,Kim J,et al.Nature,2004,427:523
[20] Liu Y,Kabbour H,Brown CM,et al.Langmuir,2008,24:4772
[21] Rowsell JL C,Millward A R,Yaghi O M,et al.JAm Chem Soc,2004,126:5666
[22] Rowsell JL C,YaghiO M.JAm Chem Soc,2006,128:1304
[23] Li Y,Liu Y,Wang Y T,et al.International Journal of Hydrogen Energy,2007,32:3411
[24] Li Y Q,Xie L,Li X G,et al.Inorg Chem,2008,47:10372
[25] Li Y Q,Xie L,Li Y,et al.Chem Eur J,2009,15:8951
[26] Wang Y,Cheng P,Yan SP.Inorg Chem,2007,46:4530
[27] Fang Q R,Zhu G S,Jin Z,et al.Angew Chem Int Ed,2007,46:6638
[28] Xue M,Zhu G S,Li Y Y,et al.Crystal Growth&Design,2008,8:2478
[29] Guo Z Y,LiG H,Zhou L,et al.Inorg Chem,2009,48:8069
[30] Liu Y Y,Zeng JL,Sun L X,et al.International Journal of Hydrogen Energy,2007,32:4005
[31] Yang Q Y,Zhong C L.JPhys Chem B,2005,109:11862
[32] Hirscher M,Panella B.Scr Mater,2007,56:809
[33] Pawsey S,Moudrakovski I,Ripmeester J,et al.JPhys Chem C,2007,111:6060
[34] Sagara T,Klassen J,Ortony J,et al.JChem Phys,2005,123:014701
* 通讯联系人,E-mail:xgli@pku.edu.cn
