类风湿性关节炎患者血脂分析
2010-06-30杨静董建玲田岚邹晋梅张羽
杨静 董建玲 田岚 邹晋梅 张羽
类风湿性关节炎(rheumatoid arthritis,RA)是一种以关节 滑膜为主要病变的全身性自身免疫性疾病,免疫介导使自身抗体或炎性因子表达升高,从而引起体内营养物质代谢的变化,特别是蛋白质、脂质代谢的变化。本实验旨在通过对RA患者血脂的测定,揭示RA与脂类代谢的关系。
1 对象与方法
1.1 对象 实验组为2009年4~7月来我院住院的初诊RA患者62例,所有患者未服用糖皮质激素或改善疾病的抗风湿药物,同时符合1987年修订的美国风湿病学会(ACR)制定的RA分类标准。年龄20~65岁,平均(45.5±16.5)岁;其中男20例,女42例。正常对照组为我院门诊体检人群,年龄28~60岁,平均(51.9±10.5)岁;男12例,女18例。排除标准:由于RA中存在本身血脂代谢障碍的个体,为了避免给结果带来的干扰,凡测定个体结果TC、TG同时大于5.18、2.26mmol/L不列入统计之列。以上病例均排除严重高血压和糖尿病及其他代谢类疾病和其他炎症性反应。
1.2 患者的一般情况包括年龄、性别、病程及RA发病时的DAS28评分、实验室检查包括TC、TG、HDL-C、LDL-C、Apo-A1、Apo-B、LP(a)、RF、ESR、CRP、ACCP。
1.3 血脂及载脂蛋白的测定 TC、TG用酶偶联比色法测定,TC用东欧津玛公司试剂,TG用上海蓝怡有限科技公司试剂。HDL-C、LDL-C用直接法测定,ApoA1、ApoB与LP(a)用免疫透射比浊法测定。
1.4 ESR、CRP、ACCP及RF的测定 CRP、RF用免疫透射比浊法测定,用北京利德曼生物有限公司试剂。ESR用魏氏法测定,用广州杰安生物公司试剂。使用欧蒙(德国)医学实验诊断有限公司提供的ACCP试剂盒采用酶联免疫吸附试验(ELISA)法检测ACCP。
1.5 疾病活动性评定 采用DAS28活动性评分(范围2~10)=0.56×√T28+0.28×√SW28+0.70×Ln(ESR)十0.014×VAS。T28,SW28:肩、肘、腕、膝、掌指关节MCP1-5、近端指间关节PIP1-5,共28关节中压痛、肿胀关节数,Ln:自然对数,ESR:红细胞沉降率(mm/h),VAS:观察者对患者健康状况可视尺类比评分(0~100mm)。DAS28>2.4为RA疾病活动。
1.6 统计学方法 所有数据理采用SPSS11.5统计软件,计量资料以(±s)表示,采用t检验。计数资料采用x2检验,相关分析采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 实验组与正常对照组血脂结果 见表1。RA患者TG、LP(a)高于正常对照组(P<0.01);而HDL-C、APO-A1低于正常对照组。
2.2 血脂分析各项指标与临床指标的关系 对RA患者血脂各项指标与RA血清学指标及DAS28评分之间进行相关性分析。经Pearson相关分析显示,LP(a)与ESR、CRP、DAS28评分呈正相关(r分别为0.31、0.43、0.22)。见表2。
3 讨论
近年来研究报道RA的死亡率高于普通人群,死因主要是心血管疾病,尤其是冠状动脉粥样硬化;RA患者的心血管死亡率是普通人的2倍[1]。目前国外研究提示,RA患者存在脂质谱改变,可以表现TC增高、HDL-C降低,或是LDL-C与HDL-C比例的上升,以及LP(a)或者抗氧化低密度脂蛋白抗体增高[2]。本研究结果表明,RA患者TG、LP(a)高于正常对照组(P<0.01),而HDL-C、APO-A1低于正常对照组。这与Rantap-Dahlqvist[3]报道确诊RA进行血脂质分析发现,HDL-C水平降低了9%,TG水平提高了17%,而APO-B提高了6%有相似之处。RA患者血脂异常其机制与细胞因子如TNF-α[4]、IL-1[5]、IL-6[6]等很可能干扰了RA患者的脂质代谢。一方面,它们增加肝脏脂肪酸和TC合成,促进脂肪组织的分解,增加了血液中的TC和LDL-C。另一方面,TNF-α、IL-1上调内皮脂肪酶的表达,并刺激其活性,加速了HDL-C的分解。HDL-C可以保护LDL-C不受氧化,内皮脂肪酶介导的HDL-C分解减弱了这种保护作用。临床研究也提示炎症对脂质代谢有干扰作用。最近的一项研究发现,RA患者经过2周的抗TNF治疗,他们的HDL-C水平明显上升,LDL-C和TG没有变化[7]。另一项在RA患者中进行的前瞻性研究表明,经过1年的抗风湿治疗,给予病情改变药物和小剂量(低于10mg)激素,患者的HDL-C增加了21%(P<0.01),值得注意的是,这项研究提示了激素的抗炎作用所带来的益处大于其脂代谢干扰作用[8]。与那些没有罹患RA相比,研究人员发现持续发生RA患者的血液脂循环中存在更多的不正常平衡状态。LP(a)是一种特殊独立的血浆脂蛋白,是1963年挪威遗传学家Berg在研究LDL-C的遗传变异时发现的。20世纪80年代末,人们发现LP(a)与动脉粥样硬化有关,1991年国外研究发现,血清LP(a)水平在血清阳性RA患者中明显升高,并发现其与ESR、血小板计数相关。发现RA具有较高水平LP(a)[9],本研究发现RA患者LP(a)水平明显高于正常对照组,并与DAS28评分、CRP、ESR具有一定相关性,可见RA患者血清LP(a)水平与疾病活动性相关。可见,脂蛋白(a)升高有助于解释RA患者罹患心血管疾病风险性高的原因。
表1 两组患者血脂比较(±s)

表1 两组患者血脂比较(±s)
注:*P<0.05
?
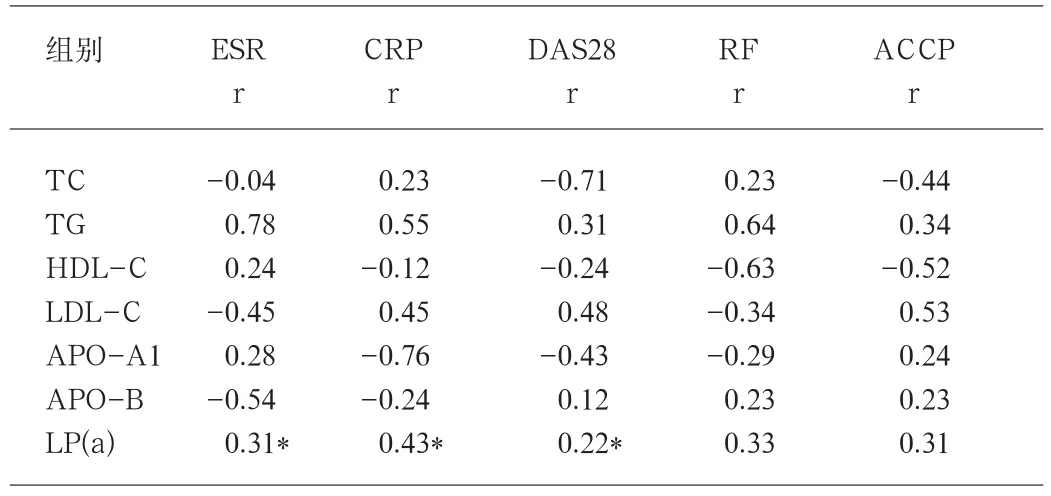
表2 血脂各项指标与临床指标的关系
综上所述,RA患者存在与疾病活动相关的脂质谱异常,应重视RA患者血脂的监测与管理,以减少心血管疾病的发生。
[1]Michael T.Cardiovascular risk in rheumatoid arthritis[J].Autoimmunity Reviews,2009,8(8):639-716.
[2]García-Gómez C, Nolla JM, Valverde J,et al. Conventional lipid profile and lipoprotein(a)concentrations in treated patients with rheumatoid arthritis [J].J Rheumatol,2009,36(7):1365-1370.
[3]Rantap-Dahlqvist S, W llberg-Jonsson S, and Dahlén G.Lipoprotein(a),lipids, and lipoproteins in patients with Ann Rheum Dis,1991,50(6):366-368.
[4]Garcês S P, Parreira Santos M J, Vinagre F M R, et al.Antitumour necrosis factor agents and lipid profile:a class effect [J].Ann Rhuem Dis,2008,67(6):895-896.
[5]LjungL,Olsson,TEngstrand,S et al.Interleukin-1 receptor antagonist is associated with both lipid metabolism and inflammation in rheumatoid arthritis[J].Clinical and experimental rheumatology,2007,25(4):617-620.
[6]Hashizume M, Yoshida H, Koike N,et al. Over-produced IL-6 decreases blood lipid levels via up-regulation of VLDLR[J].Ann Rheum Dis,2010,69(4):741-746.
[7]Popa C, Netea MG, Radstake T, et al. Influence of anti-TNF therapy on the cardiovascular risk factors in patients with activerheumatoid arthritis[J].Ann Rheum Dis,2005,64(8):303-305.
[8]Park YB, Choi HK, Kim MY, et al. Effects of antirheumatic therspy on serum lipid levels in patients with rheumatoid arthritis: a prospective study[J]. Am J Med,2002,113(3):188-193.
[9]Angelo M.Lp(a)as a cardiovascular risk factor[J].Journal of Molecular and Cellular Cardiology,1991,23:35.
