肾脏损伤早期肿瘤坏死因子-α表达的实验研究
2010-06-29韩晓鹏李新源魏登文苗鹏程孙少华
韩晓鹏,李新源,魏登文,苗鹏程,孙少华
(1.兰州军区兰州总医院普外科,甘肃730050;2.兰州大学医学院第一附属医院病理科,甘肃730000)
随着创伤的日益增加,肾脏损伤的发生率亦有明显增加趋势。肾脏损伤在泌尿系统损伤中仅次于尿道损伤而居第2位。有关创伤免疫的研究日益受到国内外学者的极大关注。本文对外源性肾上腺髓质素(ADM)对肾脏机械性损伤肿瘤坏死因子-α(TNF-α)表达的影响进行研究,进一步探讨外源性ADM是否具有调节肾脏损伤后免疫失衡的作用。
1 材料与方法
1.1实验动物 健康清洁级Wistar大鼠由兰州大学动物实验中心提供(动物合格号:医动字14-006),雌雄各半,体质量(210±30)g,鼠龄3个月,分笼饲养。
1.2实验药品及试剂 (1)固体石蜡、10%福尔马林、苏木素复染液、梯度乙醇、二甲苯、40mg/L水合氯醛、蒸馏水、去离子水等由兰州大学法医学教研室提供;(2)肾上腺髓质素(ad-renomedullin Rat1-50,ADM)购自美国 CALBIOCHEM 公司,货号121703。TNF-α、TNF-β、TNFR一抗及SABC免疫组化试剂盒均购自武汉博士德生物工程有限公司。
1.3主要仪器 (1)生物撞击仪:自行研制[1];(2)光学显微镜及显微照相系统:日本Olympus公司;(3)计算机 Mias图像分析系统:四川大学图像图形研究所;(4)切片机:德国AQ820;(5)电子分析天平:上海天平仪器厂;(6)微量加样器(20~200 μL、0~10μL):Labsystem 公司;(7)冰箱、恒温电烤箱、微波炉、湿盒等。
1.4实验动物分组 将104只Wistar大鼠随机分为4组,即对照组(8只)、创伤组(32只)、伤前给药组(32只)、伤后给药组(32只)。后3组分别在打击后1、6、12、24h各处死8只。
1.5ADM的配制与使用 ADM使用前先用0.9%生理盐水稀释成50nmol/L母液,置于-20℃保存。实验时按照0.1 nmol/kg计算每只动物所需的量,再以0.9%生理盐水稀释为0.5mL终体积腹部注射即可。
1.6实验动物肾脏损伤模型的制作 建立肾脏Ⅰ级损伤动物模型及采集标本,动物不经任何麻醉处理,采用卧位将其四肢固定于打击台上,自45cm高度处释放160g铁质打击锤以自由落体下降直接打击脊肋区,分别间接打击双侧肾脏造成肾脏Ⅰ级损伤(根据美国创伤外科学会器官损伤标准委员会制定的肾脏损伤标准[2])。伤前给药组于打击前10min及伤后给药组于打击后10min均腹部注射 ADM 0.1nmol/kg,各组动物均于8∶00采用快速心脏采血法处死。处死前仰卧固定,用水合氯醛(3mg/kg)深度麻醉,剪去胸腹部毛发,消毒,开胸、腹直视抽取心脏血致死。将采集到的血液迅速移入抗凝管中并轻轻摇匀备用,解剖及采血过程控制在2h以内。各组肾脏经HE染色病理组织切片观察后符合肾脏Ⅰ级损伤标准。根据美国创伤外科学会器官损伤标准委员会指定的肾脏标准选择打击强度。本实验选择Ⅰ级损伤标准的致伤强度建立动物模型,镜下观察选择标准是组织中不出现出血灶,但有红细胞管型。
1.7组织的处理 迅速解剖动物取下肾脏标本,10%甲醛固定,经脱水、透明、石蜡包埋后,常规切片(4μm),HE染色和免疫组化染色观察。
1.8免疫组化过程 (1)采用SABC法,将防脱片处理过的组织捞片;(2)切片于62℃烤片12h,二甲苯及梯度乙醇脱蜡至水;(3)热修复抗原,将切片放入有枸橼酸盐缓冲液(pH 6.0)的容器中,置微波炉中加热,中低火持续2min,取出容器冷却至室温;(4)用蒸馏水对切片清冼1~2次;(5)PBS洗3次,每次2min;(6)H2O2消化5~20min;(7)在室温下用山羊血清封闭20min;(8)一抗(兔抗大鼠 TNF)4 ℃过夜;(9)0.01 mmol/L PBC漂洗3次,每次2min;(10)室温下(20~30℃)生物素化羊抗兔IgG(二抗)20min;(11)0.01mmol/L PBC漂洗3次,每次2min;(12)室温下(20~30℃)SABC 20min;(13)0.01mmol/L PBC 漂洗3次,每次2min;(14)DAB显色12 min;(15)苏木素复染;(16)脱水(同 HE染色中的相应处理);(17)透明(同HE染色中的相应处理);(18)封片(阴性对照用PBS代替一抗,阳性对照采用预实验中表达较好的组织)。
1.9阳性标准 在高倍视野下出现棕黄色颗粒,特异性分布于细胞胞浆、胞核或胞膜。
1.10图像采集分析方法 根据Kraan等标准略做修改,采用计算机图像分析系统分别对免疫组化染色切片SAB中免疫组化染色进行计量分析。在开机20min后,用计算机图像分析系统在10倍物镜下采集图像,从每张切片中随机选取带有1~2个近皮质肾小球的区域,作为采集图像标准。在该视野中选取5个显色较好且非特异性背景染色控制良好的面积近似的肾小管区域进行平均黑度值测量。数据导出为Excel格式。
1.11统计学方法 采用SPSS11.0统计软件分析及处理数据,以s表示,组间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
伤前给药组于伤后1、12h处于高表达水平,伤后6h低表达,且较该时间点创伤组明显降低(P<0.05),伤后24h接近对照组水平,其余各时间点比较均无统计学意义。伤后给药组于伤后1h明显低于该时间点创伤组和伤前给药组(P<0.01,P<0.01),伤后24h其表达明显高于伤后1h(P<0.01),其余时间点之间比较均无统计学意义。创伤组各时间点与对照组比较及各时间点之间比较均无统计学意义(表1、插页Ⅱ图1)。

图1 各组大鼠肾组织TNF-α的表达(SABC染色×200)
表1 各组大鼠肾组织TNF-α阳性表达(s)
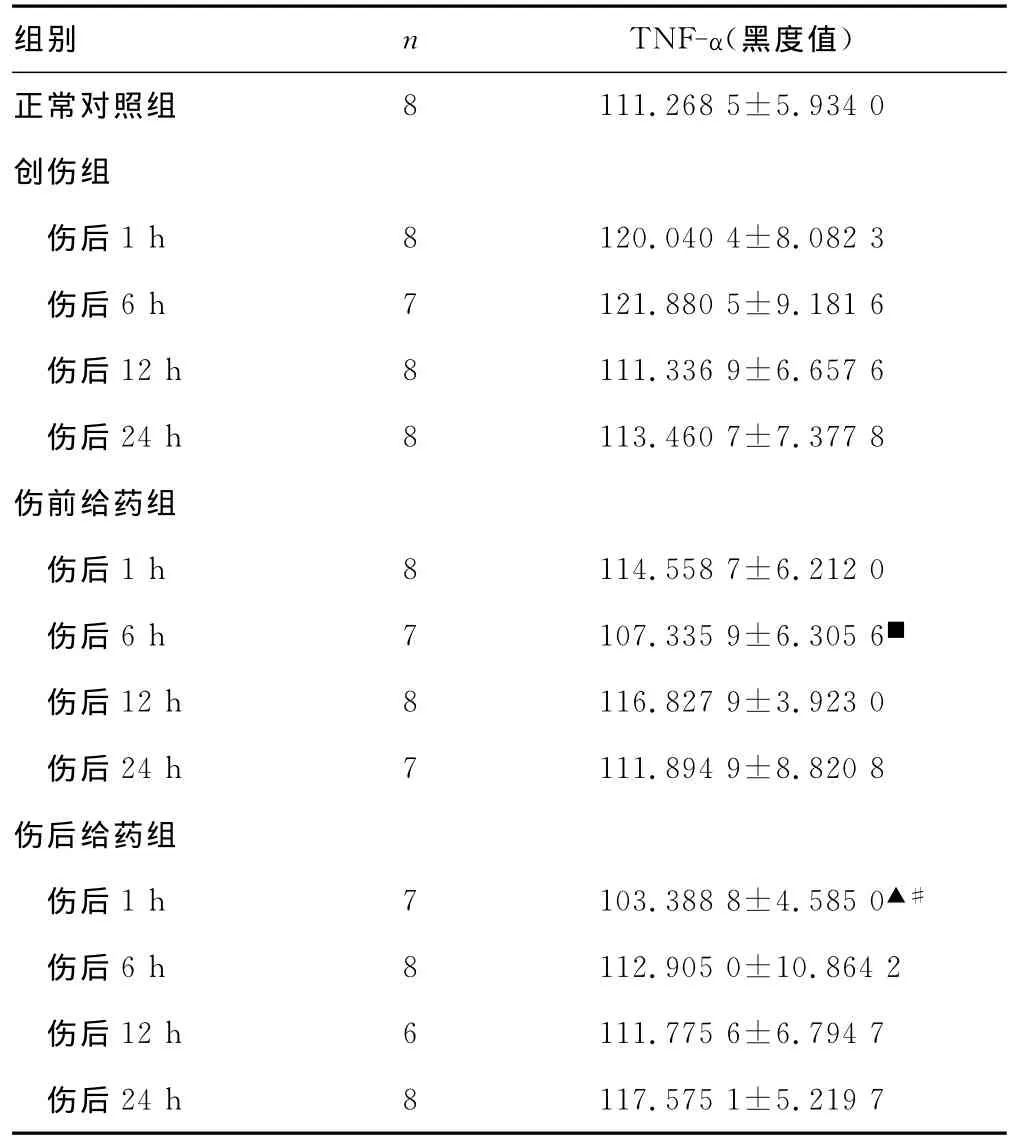
表1 各组大鼠肾组织TNF-α阳性表达(s)
▲:与创伤组伤后1h比较,F=9.690,P<0.05;■:与创伤组伤后6h比较,F=4.365,P<0.05;#:与伤前给药组同时间点比较,F=12.236,P<0.05。
组别 n TNF-α(黑度值)正常对照组伤后1h 8 120.040 4±8.082 3伤后6h 7 121.880 5±9.181 6伤后12h 8 111.336 9±6.657 6伤后24h 8 113.460 7±7.377 8伤前给药组伤后1h 8 114.558 7±6.212 0伤后6h 7 107.335 9±6.305 6■伤后12h 8 116.827 9±3.923 0伤后24h 7 111.894 9±8.820 8伤后给药组伤后1h 7 103.388 8±4.585 0▲#伤后6h 8 112.905 0±10.864 2伤后12h 6 111.775 6±6.794 7伤后24h 8 117.575 1±5.219 7
3 讨 论
ADM是于1993年从人嗜铬细胞瘤中发现一种由52个氨基酸残基组成的活性肽[3-5],其具有广泛的生物学作用:(1)可抑制致炎因子释放;(2)有细菌脂多糖存在时能降低肺泡巨噬细胞白细胞趋化物分泌水平;(3)可提高IL-6而降低TNF-α的分泌;(4)降低炎性渗出;(5)扩张血管,增加管壁通透性,增强IL-6诱导的中性粒细胞聚集;(6)对炎症血管反应具有抑制作用。有研究显示,创伤性炎症诱导T细胞产生免疫源性降钙素基因相关肽(CGRP),可负性调节免疫细胞的功能;ADM属于CGRP家族,具有炎症调节作用,而致炎因子又可促使ADM自分泌而发挥作用。
近年来国内外许多学者研究发现,TNF-α与缺血再灌注损伤密切相关。TNF-α主要是由激活的单核细胞、巨噬细胞、内皮细胞产生的细胞因子。TNF-α是细胞因子家族中最强效的炎症介质,通过与2种特定的膜结合受体——TNF受体1和TNF受体2结合而发挥生物学作用。TNF-α大量表达后可通过直接的细胞毒作用,收缩血管以降低肾脏血流及聚集中性粒细胞和单核细胞等,导致肾脏细胞凋亡、肾小球纤维蛋白沉积、清蛋白滤过增加、滤过率下降、中性粒细胞浸润等,而这些因素可进一步加重肾脏损伤。TNF-α还可能进一步导致缺血再灌注损伤后出现肾脏失去功能和细胞死亡。本实验结果表明,创伤后1、6hTNF-α表达均高于对照组,并于6h达到峰值,12、24hTNF-α表达降低并接近对照组。说明TNF-α在创伤早期即参与了肾组织炎症的急性期反应并加重损伤。TNF-α可促进内皮细胞表达黏附因子,增强白细胞与之黏着,促进中性粒细胞聚集和激活间质释放蛋白水解酶诱发炎症反应[5]。TNF-α可以刺激单核巨噬细胞和其他类型的细胞分泌IL-1、IL-6、TNF-α、IL-2等炎性细胞因子以放大或间接增强其本身的效应,这些效应加重了创伤局部的炎症反应。另一方面渗出的炎性细胞及其释放的蛋白水解酶促进了创伤坏死组织的吞噬和分解,有利于坏死组织的清除和创伤的修复,减少TNF-α的释放,故表现在本实验创伤组中12、24hTNF-α表达降低并接近对照组。创伤组各时间点与对照组比较及各时间点之间比较差异均无统计学意义,提示TNF-α参与炎症的过程既有放大本身的效应,又可间接地减少自身的释放。
伤前给药组TNF-α表达于伤后1、12h处于高表达水平。伤后6h低表达,且较该时间点创伤组明显降低(P<0.05),伤后24h接近对照组水平,其余各时间点比较差异均无统计学意义。血循环中ADM以20min的半衰期 迅速代谢[6]。伤前10min注射,外源性ADM刚好处于半衰期内,与机体遭受创伤时产生的内源性ADM一起对创伤器官发挥了良好的保护作用。伤前给药组TNF-α在1、6h的表达低于创伤组同时间点的表达,并与6h比较差异有统计学意义。证实了ADM能降低巨噬细胞白细胞趋化物分泌水平,降低TNF-α分泌。此效应及时地下调了急性创伤后TNF-α的级联放大作用,避免创伤对肾脏组织的过度损害。
伤后给药组TNF-α的表达于伤后1h明显低于该时间点创伤组和伤前给药组(P<0.01)。说明创伤后注射ADM可明显抑制TNF-α在伤后1h的表达,且其效果优于创伤前给药。伤后24hTNF-α表达明显高于伤后1h(P<0.01)。分析其原因可能是伤后24h外源性ADM基本已完全代谢,仅有内源性ADM发挥效应。
血浆中ADM主要来源于血管内皮细胞(VEC)和血管平滑肌细胞(VSMC),正常人血浆ADM浓度较低,大多为具有免疫反应性的ADM-gly,它是ADM的一种中间形式,这也反映了 ADM 在组织中的产生过程[7]。IL-1β、TNF-α、脂 多糖(LPS)、内皮素-1(ET-1)、血管紧张素-Ⅱ均可刺激 VSMC分泌ADM,而ADM能降低TNF-α的分泌,抑制TNF-α的级联放大作用,本实验结果与多数学者观点相吻合。
TNF-α是一种具有多种生物学功能的炎性细胞因子,参与了肾脏损伤的炎症发展过程,随着对TNF-α研究的深入,可能为揭示肾脏损伤的发病机制提供新的理论依据,并为治疗肾脏损伤性疾病提供新的手段,如采用控制TNF-α产生量、中和TNF-α触发的细胞反应来防止TNF-α所引起的组织损伤,利用转基因技术直接在炎症部位使TNF-α等炎症介质失去生物学活性等。
[1]蒙伶俐,孙少华,张军荣,等.经体表创伤后肾脏组织中缺氧诱导因子-1α表达的调控[J].第四军医大学学报,2005,26(14):1311.
[2]Moore EE,Shackford SR,Pachter HL,et al.Organ injury scaling:spleen,liver,and kidney[J].J Trauma,1989,29:1664.
[3]Liu J,Chen M,Wang X.Calcitonin gene-related peptide inhibits lipopolysaccharide-induced interleukin 12release from mouse peritoneal macrophages,mediated by the cAMP pathway[J].Immunology,2000,101(1):61.
[4]蔡大勇,唐朝枢.肾上腺髓质素的抗感染和炎症调节作用[J].中国病理生理杂志,2005,21(3):614.
[5]Noiri E,Nakao A.Oxidative and nitrosative stress in acute renal ischemia[J].Am J Physiol Renal Physiol,2001,281:948.
[6]Betowski J,Jamroz A.Adrenomedullin-what do we know 10years since its discovery[J].Pol J Pharmacol,2004,56(1):27.
[7]Kitamura K,Kato J,Kawamoto M,et al.The intermediate form of glycine-extended adrenomedullin is the major circulating molecular form in human plasma[J].Biochem Biophys Res Commun,1998,244(2):551.
