抑制补体对内毒素致急性肺损伤的保护作用*
2010-06-29张湘燕
李 敏,张 程,张湘燕
(贵州省人民医院呼吸内科,贵阳550002)
急性肺损伤(acute lung injury,ALI)是机体在遭受严重感染、创伤、休克等打击后出现的一种以肺泡毛细血管损伤导致肺水肿和微肺不张为病理特征的肺部炎症与通透性增加综合征,是临床常见危重症[1-2]。目前临床上还缺乏治疗ALI的有效手段。有研究表明,补体与ALI密切相关,补体激活产物C5a在ALI病程发展中具有启动、放大的重要作用[3-5]。抑制补体能有效减轻肺损伤[6]。但近年来有研究表明,在脂多糖(LPS)导致的ALI中补体与病程发展无关[7]。由于LPS是ALI发病的常见诱因,而国内在这一方面几乎没有研究报道。因此探讨补体与LPS型ALI的关系,对于相关科学问题的阐明、临床治疗策略的确定以及药物研发都具有重要意义。
1 材料与方法
1.1试剂与仪器 LPS、抗绵羊红细胞抗体购自Sigma公司,高纯度眼镜蛇毒因子(cobra venom factor,CVF)由贵州省中国科学院天然产物化学重点实验室孙黔云研究员赠送(其制备和活性测定方法分别参见参考文献[8-9]),TNF-α、IL-8、ICAM-1检测试剂盒为美国ADL公司产品,BCA蛋白定量试剂盒购自江苏碧云天生物技术研究所,绵羊红细胞购自贵阳医学院实验动物中心,Bio-Rad 550型酶标仪购自美国 Bio-Rad公司,5810R冷冻离心机购自德国eppendorf公司,Revco超低温冰箱购自美国Thermo公司。
1.2实验动物与分组 健康雄性SD大鼠,体质量180~230g,鼠龄10周,由第三军医大学附属医院实验动物中心提供,合格证号为SCXK(渝)2007-0005。将大鼠随机分为生理盐水对照组(对照组,n=8)、脂多糖(lipopolysacharide,LPS)损伤组(LPS组,n=8)、CVF干预组(CVF组,分为3个时间组,每组n=8)。大鼠经10%水合氯醛腹腔注射麻醉。对照组:尾静脉注射生理盐水,2h后采集标本。LPS组:尾静脉注射LPS 5mg/kg,于2h后采集标本。CVF组:尾静脉注射50 u/kg CVF去除补体,24h后尾静脉注射5mg/kg LPS,然后分别于0.5、2、4h采集标本。
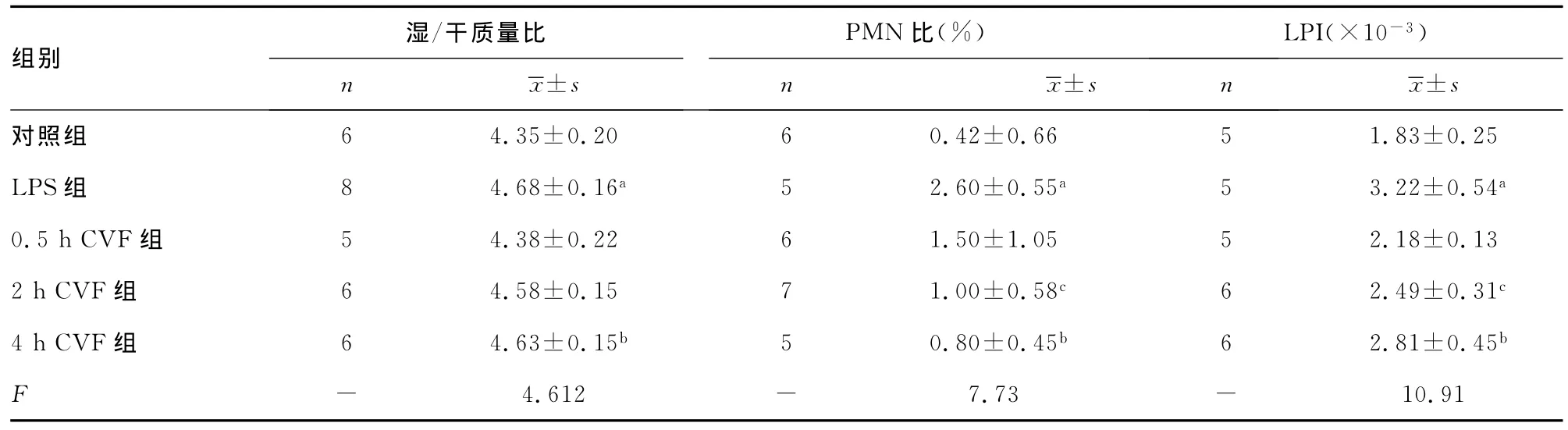
表1 各组肺湿/干质量比和PALF中PMN比、LPI变化
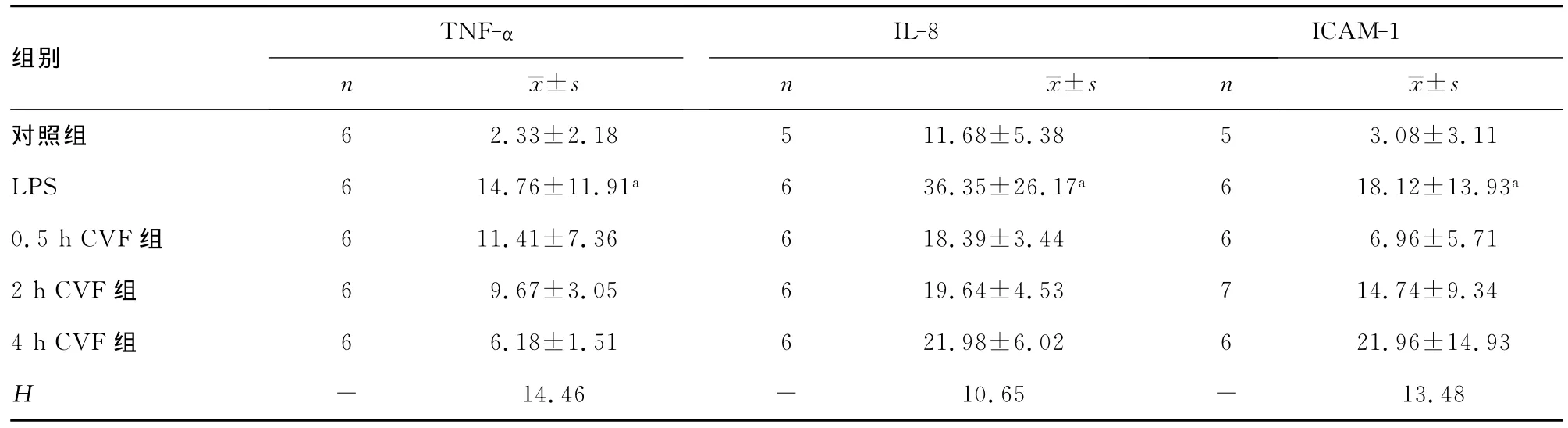
表2 BALF TNF-α、IL-8、ICAM-1浓度变化(pg/mL)
1.3标本收集与指标测定 大鼠麻醉后打开腹腔,从下腔静脉抽取5mL血,室温下静置1h,4℃放置2h,然后4℃、2 000 r/min(离心半径18cm)离心10min,吸取血清,分装后置于-80℃保存,用于测定补体活性和蛋白含量。打开胸腔,切开气管,经气管插入12号针头行右肺肺泡灌洗,每次2mL,共3次,总回收量约为3.6mL。计数肺泡灌洗液(broncho alveolar lavage fluid,BALF)中PMN百分比。BALF离心后,取上清液分装,保存于-80℃,用于蛋白含量、TNF-α、IL-8、ICAM-1测定。计算肺通透指数(lung alveolar permeability index,LPI),即BALF蛋白/血浆蛋白。取左上肺,称取湿重后,置于80℃烤箱中烤至恒重,称干重,计算湿/干重比。取左下肺,经10%中性福尔马林固定,石蜡包埋切片,HE染色,进行病理学检查。
1.4血清补体溶血活性测定 取-80℃冻存大鼠血清于室温水浴快速化冻,以GGVB缓冲液1∶20稀释,取100μL稀释血清与100μL致敏绵羊红细胞(5×108/mL)混匀,于37℃水浴孵育,不时轻轻振摇,30min后加入1mL冷生理盐水中止反应,2 000r/min(离心半径18cm)离心10min,取上清液,405nm测定OD值,计算血清补体溶血活性。
1.5统计学方法 计量资料以s表示。采用方差分析或秩和检验(Kruskal-Wallis法,方差不齐时用秩和检验);多个样本间两两比较采用q检验(Newman-Keuls法)或秩和检验(Nemenyi法)。以P<0.05为差异有统计学意义。
2 结 果
2.1肺组织病理学检查 对照组:肺组织形态基本正常,肺间质有轻度炎性细胞浸润(插页Ⅰ图1A);LPS组:肺间质水肿,可见大量炎性细胞浸润,弥漫性出血,血管内有血栓形成(插页Ⅰ图1B、C)。CVF组:肺组织各种渗出明显减少,炎性细胞渗出减少,但随着时间进程,炎症有加重趋势(插页Ⅰ图1D、E、F)。
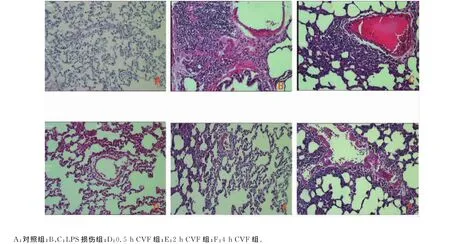
图1 大鼠肺组织病理学检查结果(HE染色)。
2.2肺湿/干质量比和PALF中PMN比、LPI变化 LPS组肺湿/干质量比、PALF中PMN比、LPI均明显高于对照组;0.5hCVF组肺湿/干质量比、PALF中PMN比、LPI明显低于LPS组;2hCVF组PALF中PMN比、LPI明显低于LPS组;4hCVF组肺湿/干质量比、PALF中PMN比、LPI明显高于0.5hCVF组(表1)。
2.3BALF TNF-α、IL-8、ICAM-1浓度变化 LPS组 BALF TNF-α、IL-8、ICAM-1浓度明显高于对照组,各 CVF组普遍低于LPS组,但差异无统计学意义(表2)。
2.4血清补体溶血活性变化 对照组补体溶血度为(0.53±0.12 )%(n=5),而 LPS组血清补体溶血度只有(0.30±0.21)%(n=8),LPS组补体明显下降。各CVF组大鼠体内补体被耗竭,基本上检测不出补体溶血活性(数据未列出)。
3 讨 论
近年来研究发现,在ALI发病早期,补体系统首先被激活,总补体活性明显降低,中性粒细胞聚集活性升高,引起多形核白细胞(PMN)在肺血管内聚集[10]。PMN聚集是ALI的重要发病因素。因此抑制补体激活能改善或减轻急性肺损伤的症状。
本实验采用CVF去除大鼠体内补体。CVF可激活和消耗补体替代途径成分[9],常被用于补体相关疾病研究动物模型中去除补体。在本实验中所采用的CVF剂量可使大鼠在实验期间处于完全的补体消除状态[8]。
本研究表明,在注射LPS后大鼠血清补体活性显著下降,大鼠出现较典型的ALI症状,提示在LPS所致急性肺损伤的发病过程中有补体的激活和消耗。而预先用CVF去除补体后大鼠BALF中蛋白和细胞渗出减少,肺水肿程度和病理改变减轻,说明抑制补体确实可减轻LPS所致ALI的症状。但BALF TNF-α、IL-8、ICAM-1浓度没有明显降低。在本实验中可以看到,抑制补体在ALI早期可以明显减轻炎性细胞浸润,但随着时间进程,炎性细胞浸润程度加重,提示在LPS导致的ALI中,早期的炎性细胞浸润与补体有密切关系,而其后的炎性细胞浸润程度加重则可能与核因子-κB的激活调控有关[11]。Rittirsch等[7]2008年曾报道在LPS导致的ALI中,补体与病程发展无关。而本实验结果则明确表明,补体参与了LPS所致ALI的早期病程发展。该文献采用气管内给予LPS造模,而作者采用尾静脉注射LPS造模。实验结论的不同很可能是这两种不同的造模途径在体内引起的LPS清除反应有差异所致。而静脉注射LPS造模无疑与临床情况更为接近。LPS造模在本实验中还观察到对照组在注射生理盐水后肺组织有轻度的炎性细胞浸润,近年来也有文献报道了这一现象[12]。
本研究表明,在内毒素(LPS)引起的ALI发病早期采用抗补体治疗策略能有效减轻早期病理症状,对ALI的治疗具有积极的意义和价值,但对ALI总体病程的影响尚需系统深入的研究与评价。
[1]Ware LB,Matthay MA.The acute respiratory distress syndrome[J].N Engl J Med,2000,342(18):1334.
[2]Brower RG,Ware LB,Berthiaume Y,et al.Treatment of ARDS[J].Chest,2001,120(4):1347.
[3]Hammerschmidt DE,Weaver LJ,Hudson LD,et al.Association of complement activation and elevated plasma-C5a with adult respiratory distress syndrome.Pathophysiological relevance and possible prognostic value[J].Lancet,1980,1(8175):947.
[4]Solomkin JS,Cotta LA,Satoh PS,et al.Complement activation and clearance in acute illness and injury:evidence for C5aas a cell-directed mediator of the adult respiratory distress syndrome in man[J].Surgery,1985,97(6):668.
[5]Mulligan MS,Schmid E,Beck-Schimmer B,et al.Requirement and role of C5ain acute lung inflammatory injury in rats[J].J Clin Invest,1996,98(2):503.
[6]Proctor LM,Strachan AJ,Woodruff TM,et al.Complement inhibitors selectively attenuate injury following administration of cobra venom factor to rats[J].Int Immunopharmacol,2006,6(8):1224.
[7]Rittirsch D,Flierl MA,Day DE,et al.Acute lung injury induced by lipopolysaccharide is independent of complement activation[J].J Immunol,2008,180(11):7664.
[8]Sun QY,Chen G,Guo H,et al.Prolonged cardiac xenograft survival in guinea pig-to-rat model by a highly active cobra venom factor[J].Toxicon,2003,42(3):257.
[9]Vogel CW,Muller-Eberhard HJ.Cobra venom factor:improved method for purification and biochemical characterization[J].J Immunol Methods,1984,73(1):203.
[10]朱元珏,陈文彬.呼吸病学[M].北京:人民卫生出版社,2003:1396.
[11]罗真春,黄燕,秦开秀,等.核因子-κB在急性肺损伤小鼠中的动态表达[J].重庆医学,2009,38(16):2005.
[12]林琴,王广发,汤秀英,等.地塞米松对内毒素致急性肺损伤大鼠肺的保护作用[J].北京大学学报:医学版,2006,38(4):393.
