黄曲霉毒素直接竞争法ELISA试剂盒的研制及其在花生和花生制品中的应用
2010-06-29北京中检维康技术有限公司王艳斐陈冰君
北京中检维康技术有限公司 王 雄 王艳斐 果 旗 荣 钊 陈冰君
长江大学生命科学学院 王 丽
中国原子能科学研究院 吴继宗
目前,黄曲霉毒素(AFT)的检测方法主要有薄层层析法、色谱法和微管柱筛选法等 (张艺兵等,2006)。这些方法因精确度低、敏感性差;样品前处理过程复杂费时;或需要价格昂贵的仪器,检测成本高,难以推广应用,影响了饲料中黄曲霉毒素的有效监测。酶联免疫吸附法(ELISA)是在免疫学和细胞工程学基础上发展的一种微量检测技术,特别适合对黄曲霉毒素污染监控中大量样本的筛检(路戈和计融,1996)。本研究以B细胞杂交瘤技术,以能分泌抗黄曲霉毒素单克隆抗体的杂交瘤细胞株为基础,建立了一种高效、准确、简便、适用于大批量样品筛选的定性、定量的用于检测饲料中黄曲霉毒素的ELISA检测方法。
1 基本原理
酶联免疫法是以抗体和抗原的特异性结合为基础的,以酶或者辅酶作为标记物,标记抗原,用酶促反应的放大作用来显示初级免疫学反应。本实验最大的特点就是利用聚苯乙烯微量反应板,吸附抗抗体,使之固相化,加样品提取液和酶标AFT抗原 (AFT与辣根过氧化物酶的结合物),在酶标板内进行酶促反应。加底物(TMB)显色,颜色的深浅取决于抗体和酶标抗原的结合量。样品中黄曲霉毒素多,则被抗体结合的酶标抗原就少。在辣根过氧化物酶存在下,底物与其反应,显蓝色,硫酸终止后显黄色。用酶标仪读数,用专用软件分析,即可得出黄曲霉毒素的含量。
2 材料与方法
2.1 仪器和试剂
2.1.1 主要仪器 酶标分析仪 (Thermo Labsystems),高速离心机(北京时代北利离心机有限公司),电子分析天平(Mettler Toledo),电热恒温培养箱 (天津市中环实验电炉有限公司);CO2培养箱(Thermo公司);洁净台(天津科学仪器厂);生物倒置显微镜(日本欧林巴斯光学株式会社)等。
2.1.2 试剂 抗黄曲霉毒素B1杂交瘤细胞株(北京中检维康技术有限公司研制);HRP标记黄曲霉毒素(北京中检维康技术有限公司研制);黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2、T-2毒素、赭曲霉毒素A、呕吐毒素、玉米赤霉烯酮、牛血清白蛋白(BSA)、伏马菌素B1等(均购自Sigma公司)。
2.2 单克隆抗体制备 将抗黄曲霉毒素B1杂交瘤细胞注入BALB/c小鼠腹腔,获得含抗黄曲霉毒素B1单克隆抗体的腹水,并将所得腹水采用饱和硫酸铵盐析法进行纯化(路戈和计融,1996)。
2.3 抗体特性鉴定
2.3.1 单克隆抗体效价的测定 应用间接ELISA法测定纯化后的单克隆抗体的效价。判定标准:以腹水OD值除以SP2/0腹水OD值大于或等于2的最高稀释倍数为腹水效价。
2.3.2 单克隆抗体特异性的测定 选择呕吐毒素、赭曲霉毒素A、伏马菌素B1、玉米赤霉烯酮、T-2毒素、牛血清白蛋白(BSA),将不同浓度上述毒素替代黄曲霉毒素标准品溶液,应用直接ELISA法测定其标准曲线,计算出50%抑制浓度(IC50),并计算交叉反应率。计算公式如下:

2.4 试剂盒各项技术参数研究
2.4.1 抗抗体与单抗、酶标抗原最适工作浓度的确定 采用方阵法确定抗抗体、单抗及酶标抗原的最适工作浓度,每板同时设阴性对照。判断标准:选择OD值在1.5左右时,包被抗抗体浓度、单抗以及酶标抗原浓度为最适工作浓度。
2.4.2 标准曲线的建立 采用直接竞争ELISA方法建立标准曲线,选择合适的标准品浓度,以无黄曲霉毒素抑制时的OD值为B0值相应浓度黄曲霉毒素抑制时的OD值为B值,百分吸光度值(B/B0)为纵坐标,以标准品的浓度为横坐标,绘制标准曲线。
2.5 实验方法
2.5.1 样品前处理
2.5.1.1 称取5 g样品,加入25 mL样品提取液(70%甲醇水),剧烈振荡3 min(用手或振荡器)。2.5.1.2 将提取液用普通滤纸过滤,取3 mL稀释液加入3 mL正己烷,振荡1 min,3000 r/min离心2 min去上层,取下层以稀释缓冲液按1∶1的比例稀释(吸取 500 μL 滤液,加入 500 μL 稀释液缓冲液),该液为待测液。样本稀释倍数为10倍。
2.5.2 测定步骤
2.5.2.1 酶标板的制备:以pH 7.2的磷酸钠盐缓冲溶液作为包被缓冲液,将抗体稀释到最佳工作浓度,每孔加入200 μL,37℃温育2 h或4℃过夜,倾去包被液,用洗涤液洗涤4次,每次30 s,拍干,然后在每孔中加入200~250 μL 0.7%的明胶封闭液,37℃温育1~2 h,倾去孔内液体拍干,干燥后用铝箔袋真空密封保存。
2.5.2.2 将足够标准品和样品所用数量的孔条插入酶标板架,标准品和样品做2个平行实验,记录下标准品和样品的位置。未使用的酶标板用铝箔袋封好置2~8℃冷藏保存。
2.5.2.3 分别将标准品和样品加至相应的微孔(双孔)中,然后再各加入稀释后的酶标抗原,最后加入稀释后的抗体,加盖,在37℃温育10 min(每个标准和样品必须使用新的吸头)。
2.5.2.4 倒出孔中的液体,然后每孔加入洗涤液洗涤,重复操作4次,洗完后用力在吸水纸上拍干。
2.5.2.5 加入显色液,37℃避光温育15 min。
2.5.2.6 加入硫酸终止液,终止反应。
2.5.3 结果判定 结果的判定方法:所获得的每个浓度标准溶液和样本吸光度值的平均值(B)除以第一个标准(0标准)的吸光度值(B0)再乘以100%,即百分吸光度值。
以黄曲霉标准品浓度值(μg/kg)为X轴,百分吸光度值为Y轴,绘制标准曲线图。相对应每一个样品的浓度可以从标准曲线上读出。也可以用回归方程法,计算出样本溶液浓度。利用计算机专业软件,更便于大量样品的快速分析。
样品的实际浓度为读数结果乘以稀释倍数。
2.5.4 回收率实验 根据试剂盒的检测范围确定加标浓度,在不含黄曲霉毒素的三样品中分别进行 5、10、20 μg/kg 三个浓度的加标回收实验,每个加标水平做4个重复的平行样。样品按照2.5.1提取方法进行提取,待测液用ELISA进行检测。
2.6 试剂盒稳定性实验 对试剂盒稳定性采用37℃加速破坏实验进行研究,将试剂盒分别放置于4℃和37℃,每隔24 h进行ELISA测定,测定阴性对照(不加毒素B0)和阳性(即50%的抑制毒素浓度B)的吸光度(A)值,计算两者的比值(B/B0)。 当 B0<0.6 个吸光度(A)值,或 B/B0<0.7A时,即可判定ELISA试剂盒已失效。在37℃放置24 h相当于在4℃放置45 d。从试剂盒的生产日期到失效日期的时间可确定为ELISA试剂盒的稳定周期,即保质期。
3 结果分析
3.1 单克隆抗体特性鉴定 杂交瘤细胞株产生的腹水抗体经纯化后,抗体效价约为1∶30000,抗体的工作浓度为1∶20000。抗体与T-2毒素、赭曲霉毒素A、呕吐毒素、玉米赤霉烯酮、伏马菌素B1等其他真菌毒素和牛血清白蛋白的交叉反应均小于0.1%。
3.2 试剂盒技术参数 根据方阵法确定,抗体的最适工作浓度为1∶20000,黄曲霉羊抗鼠抗体的最适包被浓度为 1∶5000,酶标抗体浓度为 1∶7000。标准曲线中黄曲霉毒素的浓度分别为 0、0.5、1.0、2.0、5.0、10.0 ng/mL, 最低检出浓度是 0.5 ng/mL,标准曲线方程为y=-7.5x+88.6,R=0.995,线性范围为0.5~10.0 ng/mL,50%的抑制浓度为1.5 ng/mL左右。
3.3 回收率测定 对花生及制品做黄曲霉毒素的回收率实验,加标浓度分别为 5、10、20 μg/kg。其加标回收率的范围为70%~110%,具体见表1。
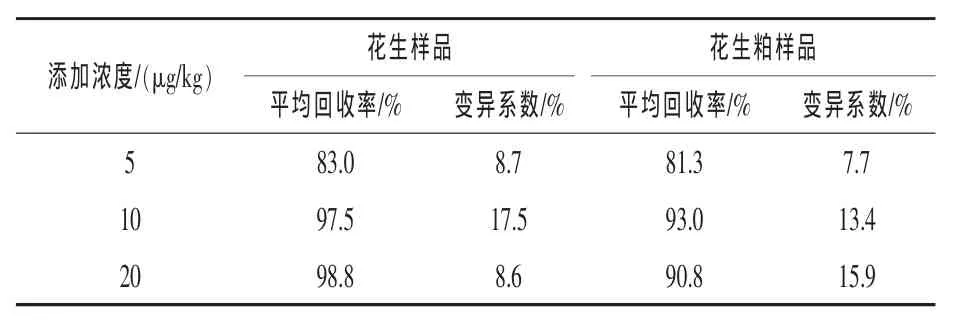
表1 花生样品中回收率实验结果
3.4 试剂盒稳定性试验 经37℃稳定实验,试剂盒能在37℃下存放150 h后,阴性对照吸光度值为0.75,仍然大于0.6。所以该试剂盒有效期能达到6个月。
4 讨论
因为ELISA是利用抗体的选择性和标记酶的化学放大的灵敏性建立起来的,故应考虑的因素主要有以下几方面(Richard 等,1994):(1)抗体包被:将抗抗体固定在聚苯乙烯微量反应板中称为包被,包被的质量是影响抗原、抗体反应的重要因素。(2)非特异性反应:ELISA中会发生许多非特异性反应,严重干扰分析结果,选择适合的抗原、抗体组合,可以明显的减少这种反应的发生。(3)酶和抗原的偶联:酶和抗原偶联的好坏,直接影响试剂灵敏度。本实验操作时采用的是辣根过氧化物酶与抗原偶联CMO的方法。(4)底物:当酶标记抗原-抗体复合物与底物相遇时,复合物中的酶水解底物,是无色的底物溶液生成有色的反应产物。因此,应注意底物溶液的避光性。(5)洗涤:酶促反应,每次反应后都需反复洗涤,这既保证了反应定量关系,也除去了血清中与反应无关的其他成分及游离的复合物等。洗涤效果与检测结果密切相关。如果洗涤不充分,常引起结果的紊乱,最好做到洗涤的步骤标准化。
5 小结
本研究在制备出针对黄曲霉毒素有较好的灵敏度,在特异性抗体和酶标抗原基础上,研制出对饲料中黄曲霉毒素的ELISA快速检测试剂盒。该试剂盒最低检出浓度为0.5 μg/kg,对样品的检测范围为5.0~100 μg/kg,试剂盒所用单克隆抗体与其他真菌毒素均无交叉反应,具有较高的特异性。对花生及花生粕做添加回收率实验结果为70%~110%,重复性和再现性良好,在2~8℃条件下可以保存6个月。以上技术参数均达到试剂盒的技术要求,而且具有简单、快速、灵敏、准确、特异性好,并可同时检测大量样品等优点,值得推广应用。
[1]路戈,计融.食品中黄曲霉毒素B1单克隆抗体酶联免疫测定方法的建立及初步应用[J].卫生研究,1996,5(3):162 ~ 165.
[2]张艺兵,鲍蕾,禇庆华,等.农产品中真菌毒素的检测分析[M].北京:化学工业出版社,2006.1~6.
[3]Richard J Cole,Joe W.Dorner.Extraction of aflatoxin from Naturally contaminated peanuts and solvent peanut rations[J].J AOAC,1994,77(6):1509 ~1511.
