PAI-1mRNA在糖尿病大鼠肾脏的表达与通心络胶囊的干预作用研究1)
2010-06-29朱雄超余国友郑旭宁
朱雄超,范 慧,余国友,郑旭宁
糖尿病作为一个在当今社会发病率剧增的代谢性疾病已引起人们日益增加的关注,糖尿病的大血管及微血管病变包括糖尿病心血管并发症,糖尿病肾病(DN),糖尿病神经病变、视网膜病变等是造成糖尿病病人病痛、生活质量下降甚至致残、死亡的原因,DN病人由于肾功能损害而必须透析治疗者占透析病人的比例也明显增高。纤溶酶原激活物抑制物-1(PAI-1)是纤溶酶原激活物的专一性、快速性有效生理抑制剂,在体内纤溶与抗纤溶系统的平衡调节中起重要作用,也因此与许多血栓性疾病包括糖尿病慢性大血管、微血管并发症密切相关。但PAI-1与糖尿病的大血管病变方面的研究较多,其与DN的相关性研究开展不多。DN的发病机制未完全明确,已明确许多细胞因子如血管紧张素Ⅱ、转化生长因子-β(TGF-β)、内皮素、血小板源生长因子等与DN密切相关[1]。近年国内外有研究发现PAI-1与DN密切相关[2]。本研究旨在了解PAI-1与DN的发生发展是否相关,同时研究中药通心络对肾组织PAI-1的合成分泌是否有影响及从而是否对DN的发牛具有干预作用。
1 材料与方法
1.1 动物 SD大鼠 50只,清洁级动物,雌雄各半,体重201 g~237g(218.0g±10.32g),由浙江大学医学院实验动物中心提供实验动物和标准实验室。
1.2 方法
1.2.1 糖尿病模型建立 用天平称取链尿佐菌素450 mg,加入由柠檬酸、柠檬酸钠配成pH值为4.2缓冲液37.5 mL,摇匀放置冰浴中。随机抽取SD大鼠30只(雌雄各半),按60 mg/kg即0.5 mL/100 g在大鼠腹腔注射链尿佐菌素,在45 min内注射完毕。链尿佐菌素注射后10 h内喂水采用10%葡萄糖,以防止低血糖。24 h~72 h分别每天监测一次血糖,连续两次血糖>25mg/L视为糖尿病模型造模成功。以后根据血糖情况隔天腹部皮下注射中效胰岛素诺和灵N 2 U~4 U,使血糖保持在250 mg左右。结果造模成功25只,饲养中于第3周、第5周共死亡2只,最后入组存活23只,其中雌鼠12只、雄鼠11只。随机弃用雌鼠1只,以保持性别平衡。余20只大鼠同批给予腹腔注射由柠檬酸、柠檬酸钠配成的pH值为4.2的缓冲液,72 h后测定血糖均在正常范围。
1.2.2 分组 将SD大鼠随机分为两组,一组经链尿佐菌素诱发的糖尿病模型组(DM组),另一组为血糖正常对照组(C组),两组再随机分为4组,即糖尿病(DM1)组:随机抽取糖尿病模型鼠12只(雌雄各半),生理盐水灌胃1次/天,共5周;糖尿病通心络(DM2)组:剩余糖尿病模型鼠 10只(雌雄各半),通心络胶囊(由石家庄以岭药业有限公司提供)灌胃1次/天,1粒/次,共5周;正常血糖组(C1组):随机抽取未造模 SD大鼠10只(雌雄各半),生理盐水灌胃 1次/天,共 5周;正常血糖通心络组(C2组):剩余未造模SD大鼠10只(雌雄各半),通心络胶囊灌胃同DM2组。实验始分别测定四组SD大鼠的体重、血糖,4组SD大鼠体重差异无统计学意义(P>0.05)。血糖测定用Surestep血糖仪测定,由强生有限公司生产。
1.2.3 肾重/体重值、肾皮质PAI-1 mRNA表达 喂养第5周末所有大鼠测血糖、称体重,乌拉坦腹腔注射麻醉后取所有大鼠右肾,立即秤重,计算肾重/体重值,而后取部分肾皮质,分装于冻存管内立即投入液氮内保存。将大鼠肾皮质利用Trizol液提取总RNA,用紫外分光光度仪分别测定其A 260/280值为1.8~2.0,符合 RNA样本纯度要求,同时测定样本 RNA浓度。取4 g RNA加入随机引物,以总RNA为模板通过逆转录酶逆转录为cDNA。PCR法同管扩增PAI-1及内参照物GAPDH的cDNA。PCR反应条件为:94℃变性50 s,57℃退火50 s,72℃延伸50 s,共29个循环,结束前72℃延伸10 min。
PAI-1引物设计通过GeneBank查出PAI-1的基因序列,用Primers软件设计引物。PAI-1上游引物:AGC GCC TGT TCC ACA AGT CT;下游引物:GCT CTC GT TCAC CTC GAT CT,扩增产物长度436bp。
RT-PCR试剂盒提供及PAI-1引物合成均来自上海生物工程技术服务有限公司。GAPDH引物由本院外科实验室馈赠。
1.2.4 PCR产物的鉴定和半定量检测 取各样本PCR产物5 μ L,加样于l.8%的琼脂糖凝胶电泳50 min后以IS-1000多功能凝胶成像仪定量扫描条带灰度,PAI-1条带与相应GAPDH条带进行灰度对比,以PAI-1产物电泳条带灰度/GAPDH产物电泳条带灰度比值(PAI-1/GAPDH)来半定量分析PAI-1mRNA的表达量。
2 结 果
DM 组(DMl+DM2)大鼠血糖、肾重/体重值、肾皮质 PAI-1 mRNA表达量较对照组(C1+C2)显著增高(P<0.01)。DM 2组肾皮质PAI-1mRNA表达量较DM l组明显减少(P<0.05);DM2组与Cl组比较 PAI-1mRNA表达明显升高(P<0.01),以上各参数在C2组与Cl组之间比较差异无统计学意义(P>0.05)。详见表1、表2。
表1 糖尿病组、对照组PAI-1mRNA表达量(±s)

表1 糖尿病组、对照组PAI-1mRNA表达量(±s)
组别 n 治疗前血糖mg/L治疗后血糖mg/L体重g肾重g肾重/体重g/kg PAI-1/GAPDH DM 组 22 32.34±5.27 27.33±3.38 215.70±23.25 1.13±0.15 5.26±0.66 0.77±0.09 C组 20 7.26±0.71 7.54±0.90 314.60±45.12 1.15±0.14 3.70±0.52 0.47±0.08 F值 20.8 16.3 18.2 0.473 1.99 0.248 P 0.01 0.01 0.01 0.619 0.01 0.01
表2 各组PAI-1mRNA表达量(±s)
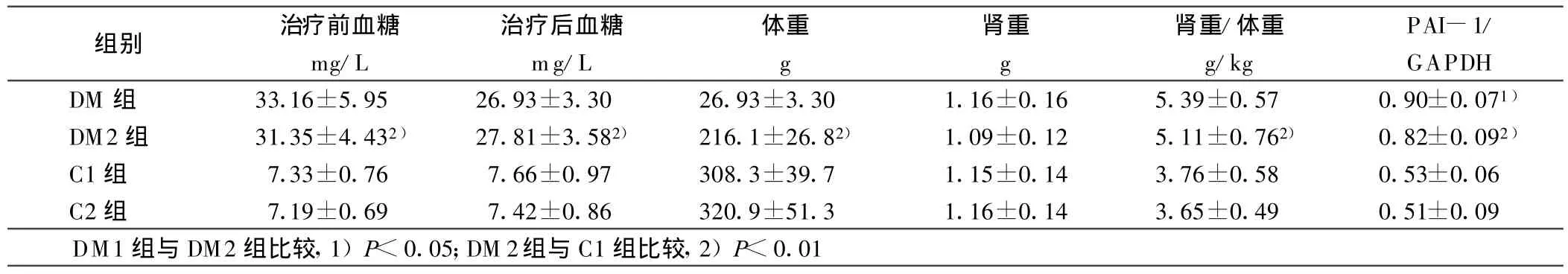
表2 各组PAI-1mRNA表达量(±s)
组别 治疗前血糖mg/L治疗后血糖mg/L体重g肾重g肾重/体重g/kg PAI-1/GAPDH DM 组 33.16±5.95 26.93±3.30 26.93±3.30 1.16±0.16 5.39±0.57 0.90±0.071)DM2组 31.35±4.432) 27.81±3.582) 216.1±26.82) 1.09±0.12 5.11±0.762) 0.82±0.092)C1组 7.33±0.76 7.66±0.97 308.3±39.7 1.15±0.14 3.76±0.58 0.53±0.06 C2组 7.19±0.69 7.42±0.86 320.9±51.3 1.16±0.14 3.65±0.49 0.51±0.09 DM1组与DM2组比较,1)P<0.05;DM 2组与C1组比较,2)P<0.01
3 讨 论
PAI-1属于丝氨酸抑制剂家族的一员,它是一分子量52 kD的单链糖蛋白,PAT-1活性中心的氨基酸Arg346-Met347可与组织型纤溶酶原激活物(t-PA)或尿激酶型纤溶酶原激活物(u-PA)活性中心的丝氨酸发生不可逆的共价结合,
形成1∶1复合物,导致t-PA或u-PA的失活。因此它是t-PA、u-PA的专一性、快速性有效生理抑制剂,在体内纤溶与抗纤溶系统的平衡调节中起重要作用,也因此与许多血栓性疾病包括糖尿病慢性大血管、微血管并发症密切相关。PAI-1主要存在于血浆,在肾脏包括肾小球上皮细胞、肾小管上皮细胞、系膜细胞和内皮细胞都有表达合成[3]。研究发现PAI-1能有效地抑制纤溶酶和基质金属蛋白酶的活性,而后者负责降解肾小球细胞外基质,PAI-1在肾组织内水平或活性的升高促使纤维蛋白水解和肾小球细胞外基质(extracullar mattix,ECM)降解作用的下调,从而肾组织纤维蛋白沉积,ECM积聚,并导致或促进肾小球发生纤维化及硬化[4]。而糖尿病肾病的病理改变则主要为肾脏肥大,基底膜增厚和肾小球、肾小管ECM的进行性积聚,故PAI-1作为纤溶系统和ECM更新调控系统的一个关键性的调节剂,它在肾组织的表达增高在肾小球疾病尤其DN的发生发展中占有重要位置。
本实验通过比较糖尿病模型组大鼠和正常对照组大鼠的肾脏肥大指数(肾重/体重)及对其肾组织PAI-1mRNA表达量进行半定量比较分析,发现DM组的肾组织PAI-1mRNA表达量比正常血糖组明显增高,DM组大鼠的肾脏肥大指数明显高于正常血糖组肾脏肥大指数且与肾组织PAI-1mRNA表达量增高一致。由于PAI-1蛋白水平的调节主要是转录水平的调节,故推测PAI-1蛋白在糖尿病时肾组织的合成分泌增多与肾脏肥大,DN密切相关。DM时PAI-1mRNA的升高可能与高糖、高三酰甘油血症、低密度脂蛋白(LDL)升高密切相关,DM时高糖本身或非酶糖化的LDL等可通过激活PAI-1启动子(promoter)而导致内皮细胞等表达PAI-1mRNA增强[5-7]。而且已明确DM时肾组织合成及分泌TGF-β明显增高,而TGF-β1可激活一种蛋白,后者可作为PAI-1基因表达调控区的反式作用因子与之结合诱导PAI-1的表达增加[1]。本实验未进行肾脏病理学对照研究,拟在进一步实验时,进行血生化及肾脏病理学研究。
本实验的另一目的是研究中药通心络胶囊对PAI-1的干预作用,发现通心络胶囊灌服的糖尿病大鼠,即DM+通心络组(DM2)的肾组织PAI-1mRNA表达较糖尿病但不用通心络组(DM l)的减少,但两组间肾脏肥大指数差异无统计学意义,可能由于PAI-1mRNA的变化早于肾脏形态和病理学变化,而本实验研究时间较短有关。正常对照中通心络灌服组与生理盐水灌服组之间肾皮质PAI-1mRNA表达无统计学意义,说明通心络对健康大鼠的PAI-1表达没有影响。但DM+通心络组的肾脏肥大指数和肾组织PAI-1mRNA表达量高于正常血糖组的表达量,有统计学意义。以上结果表明通心络对DM时过度亢进的纤溶抑制及糖尿病时的肾脏肥大有明显的下调作用,但还未能使之达到正常表达水平,可能与高血糖、高 LDL、TGF-β等因素未能控制有关。
[1] Wolf G,Ziyadeh FN.M olecular mechanisms of diabetic renal hypenrophy[J].Kidney Int,1999,56(2):393-405.
[2] 刘亚军,严钟德.TGF-β1、PAI-1与糖尿病肾病[J].国外医学:泌尿系统分册,2000,20(3):107-109.
[3] Ay a N,Yoshioka K.Tissue-type plasminogen activator and its inhibitor in human Glomerulonephritis[J].J Pathol,1992,166(1):289-295.
[4] Nicholas SB,Kawano Y,Wakino S,et al.Expression and function of peroxisomeproliferator-activated receptor-gamma in mesangial cells[J].Hypertension,2001,37(2):722-727.
[5] Ren S,Lee H,Hu L,et al.Impact of diabetes-associated lipoproteins on generatlon of fibrinolytic regulators from vascular endothelial cells[J].J Clin Endocrinol Metab,2002,87(1):286-291.
[6] Silveira A.Postprandial triglycerides and blood coagulation[J].Exp Clin Endocrinol Diabetes,2001,109(4):527-532.
[7] Pandolfi A,Cetrollo D,Polishuck R,et al.Plasminogen activato r inhibitor typeⅠis increased in the arterial wall of typeⅡdiabetic subjects[J].Arterioscler T hromb Vasc Biol,2001,21(8):1378-1382.
