EB病毒抗体检测在儿童传染性单核细胞增多症诊断中的应用
2010-06-25袁利群叶剑荣
袁利群,叶剑荣
(湖南师范大学第一附属医院,湖南省人民医院检验科,湖南长沙410002)
1968年首次发现EB病毒是引起传染性单核细胞增多症(IM)的病原,后经血清流行病学等研究得到证实,EB病毒是一种嗜B淋巴细胞的人疱疹病毒,病毒颗粒核心为双链线状DNA,长约173KB,有多个DNA重复序列,衣壳由162个壳粒排列成二十面休构成,直径约100~110 nm,有包膜,在衣壳与包膜之间有被膜。人群中流行的EB病毒可分为两个亚型,两亚型间的区别在于个别基因的不同,存在亚型特异性基因,因此导致了两个不同亚型病毒在遗传特性上有差异[1]。目前尚不能用常规方法培养,一般用人脐血淋巴细胞或是用含EBV基因组的类cycler原淋巴细胞培养EBV[2]。
传染性单核细胞增多症是一种急性的全身淋巴细胞增生性疾病,亦是急性单核-巨噬细胞系统增生性疾病。潜伏期约为40天,发病后典型的临床表现为发热、咽炎、颈淋巴腺炎、脾肿大、肝功能紊乱和以异形淋巴细胞为特征的单核细胞明显增多,合并症有肝损害、支气管肺炎、脑炎、血小板减少性紫癜等,最常见的并发症为消化系统并发症,表现为肝功能的改变。总胆红素、间接胆红素、直接胆红素、总蛋白和白蛋白无明显变化。主要表现为酶学改变,其中以ALT、AST、LDH升高最常见。肝酶升高的程度以轻中度为主,且具有恢复快、预后良好的特点;呼吸系统的症状表现为支气管炎和支气管肺炎,尤其部分无咳嗽或咳嗽已明显改善的患儿,胸片仍可显示炎症渗出。因此,对发热时间长、抗生素治疗无效的支气管肺炎,应警惕EBV感染的可能。传染性单核细胞增多证感染偶可并发眼睑水肿,但一般认为IM眼睑水肿系颈部肿大淋巴结压迫,使静脉淋巴回流障碍所致,而非真正的肾脏损害[3]。
IM患儿继发淋巴细胞白血病和恶性组织增生症明显增加,应对其长期追踪病情变化[4]。EB病毒感染伴有严重免疫缺陷的儿童、AIDS患者、器官移植接受者病死率较高,多死于重要器官的损伤[5]。
临床实验诊断IM的方法较多。如嗜异性凝集试验,本试验用于检测受检者血清中绵羊红细胞凝集滴定度,正常人为1:100,本病诊断标准为≥1:224,但儿童IM患者阳性率较低,且其阳性结果不仅见于IM,淋巴瘤、单核细胞性白血病等也可呈阳性反应,目前PCR检测EBV-DNA有较高的特异性[6],但需要特殊设备、费用昂贵,不易于基层医院推广。目前虽有直接找EB病毒包涵体的方法,它的结果可靠性、特异性强,但因受主观判断的影响及时间限制,对急性期IM诊断沿待完善,因此目前代之以快速简便的抗体测定方法。感染EB病毒后,B细胞激活并转化为浆细胞产生各种病毒抗体,主要包括VCA-IgM、抗早期抗原抗体、抗核心抗原抗体。研究发现EB病毒特异性抗体是诊断IM的可靠依据,对血清嗜异凝集反应阴性者意义更大。其中抗衣壳抗原IgM抗体出现在本病的急性期,文献报告[7],IM急性期时就出现较高的EBV-VCA-IgM抗体,如测定时间得当,所有IM都有VCA-IgM,此时检测结果表明IM组阳性率高,是临床诊断IM敏感而又特异的指标。
本文采用ELISA方法检测50例IM患儿血清标本及同期50例健康儿童血清标本中的VCAIgM、VCA-IgA、VCA-IgG抗体,并将所得结果进行回顾性分析及比较,得出结论。
1 材料与方法
1.1 标本来源
2008年4月~009年6月在湖南省人民医院临床诊断为IM患儿的血清标本50例(男:25例;女:25例),年龄:2个月~13岁;同期收集本院体检同龄阶段健康儿童血清标本约50例 (男:35例;女:15例)为观察对照组。
1.2 试剂
各抗体检测采用深圳市赛尔生物技术有限公司提供的EB病毒VCA抗体诊断试剂盒。
1.3 方法
1.3.1 测定方法 严格按操作说明书进行。结果判断:①P/N=标本OD值/阴性对照OD值,P/N≥2.1为阳性,②1.5≤P/N<2.1为可疑标本;P/N<1.5为阴性,③阴性对照(NC)小于0.10时以0.10计,大于0.1小于0.21时以实际OD值计算;若大于0.21时,实验可能出现了较大误差,需重复实验。④阳性对照(PC)值通常≥0.4,实验成立,否则重做。
1.3.2 检测评价指标计算
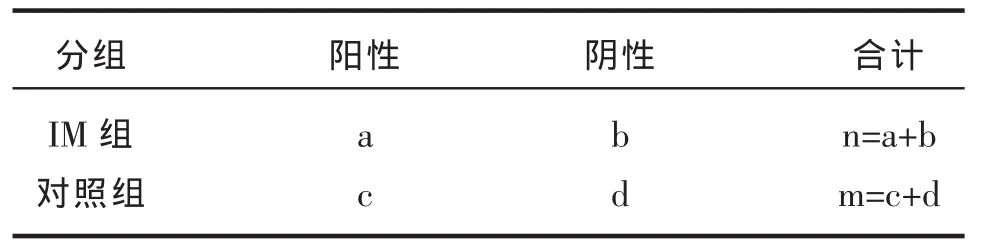
表1 计算模版表
敏感度:a/(a+b),真阳性率,即真正有病的人且按此此方法被正确诊断为有病的概率。
特异度:d/(d+C),真阴性率,即真正无病的人且按此方法被正确判断为无病的概率。
阳性预测值:a/(a+c)即检测出阳性人数中真正有病的人所占比例。
阴性预测值:d/(d+b)即检测出阴性人数中真正无病的人所占比例。
1.3.3 传染性单核细胞增多症诊断标准
⑴临床可有发热,咽峡炎,淋巴结肿大,肝脾肿大等临床表现;
⑵血象:白细胞总数变化不定,淋巴细胞比例增高,异形淋巴细胞超过10%;
⑶嗜异性凝集试验:阳性(P-B试验≥1:224)。
1.4 统计方法
VCA-IgM、VCA-IgA、VCA-IgG 抗体检测结果的比较采用χ2检验。
2 结果
2.1 EBV-VCA-IgM抗体检测结果
比较IM组与对照组中EBV-VCA-IgM阳性检出率:50例IM患儿中46例患者的VCA-IgM阳性(92%),50例对照组中2例阳性 (4%)。结果表明:VCA-IgM在IM患儿标本中的检出率明显高于在对照组标本中的检出率(P<0.05结果表2)。

表3.1 EBV-VCA-IgM抗体检测结果
2.2 EBV-VCA-IgA抗体检测结果
比较IM组与对照组中EBV-VCA-IgA阳性检出率:50例IM患儿中3例患者的VCA-IgA阳性(6%),50例对照组中1例阳性(2%)。结果表明:VCA-IgA在IM患者标本中的检出率与在对照组标本中的检出率区别并无统计学意义(P>0.05),结果见表3。

表3 EBV-VCA-IgA抗体检测结果
2.3 EBV-VCA-IgG抗体检测结果
比较IM组与对照组中EBV-VCA-IgG 阳性检出率:50例IM患儿中29例患者的VCA-IgG阳性(58%),50例对照组中11例阳性 (22%)。结果表明:VCA-IgG在IM组患者标本中的检出率明显高于在对照组标本中的检出率,(P<0.05)结果见表4。

表4 EBV-VCA-IgG抗体检测结果
3 讨论
EBV是一种普遍存在、主要侵犯人类B淋巴细胞的疱疹病毒群,是IM的病原,且与淋巴细胞增殖性疾病如Burkitt淋巴瘤、鼻咽癌密切相关[8]。在儿童,EBV感染除典型的IM症状外,尚有部分表现为无症状或不典型重症,如侵犯中枢神经系统和肝脏病变等,现已引起人们的广泛关注。另外,其它病毒如巨细胞病毒、肝炎病毒、HIV病毒等也可导致类似于IM的临床表现,故IM需有病原学诊断方可确定。
既往诊断IM主要依靠嗜异性凝集试验,但在成人中有10%~20%患者呈假阴性,在儿童中则更高[9],需要有更特异及灵敏的检测方法。
近年研究发现,病毒特异性抗体是诊断IM的可靠依据。EB病毒感染B淋巴细胞后出现多种抗原,并可使机体产生相应的抗体。通常测定的EB病毒抗体主要是VCA-IgM、IgG、IgA抗体,人群中EB病毒感染主要以VCA-IgG最为一致。IM急性期时较早期就出较高滴度的抗EB-IgM,健康人及小儿中抗EB-IgM的阳性率很低,由于IgM反应时间不长,故取血时间可影响阳性结果。抗EB-IgM的存在表示初次感染。
本研究在观察了50例患儿标本中,检出VCAIgM阳性者46例(92%);对照组中检出阳性者2例(4%),结果表明VCA-IgM在IM患者标本中的检出率显著高于对照组(P<0.05)。VCA-IgM抗体阳性与传染性单核细胞增多证之间有良好的相关性。它一般出现在IM的急性期2周内,但患者检测一般在病程的4~10天内进行,如果在发病期的第4~5天内采血,可能出现假阴性,故应根据病程适时复检。临床症状似IM的病例中虽有90%以上是EB病毒感染所致,但另有5%~10%可能由CMV、腺病毒、HIV等其它病毒感染引起。
对照组中出现VCA-IgM阳性2例(4%),可能为EBV感染者但不一定引起咽峡炎,淋巴结及肝脾肿大等典型临床表现。
本结果显示,在50例IM患者标本中,检出VCA-IgA阳性者3例(6%),50例对照组中给出阳性者1例(2%)。结果表明VCA-IgA抗体阳性与传染性单核细胞增多证之间并无统计学相关性 (P>0.05)。有资料显示,VCA-IgA只在一部分当前原发感染患者中出现,在近期原发感染、既往感染中均不出现,故对传染性单核细胞增多证诊断价值意义并不高。但大量文献报导,VCA-IgA滴度≥1:20或滴度持续升高者,对鼻咽癌有重要辅助诊断意义,应于密切关注。
结果显示,50例IM患者标本,检出VCA-IgG阳性者29例,50例对照组中阳性者11例,经统计其敏感度 (58.0%),特异度 (78.0%),阳性预测值(72.5%),阴性预测值(65.0%),二者虽在统计学上有显著性差异,但其阴性预测值有待商榷。故EBVVCA-IgG抗体在由EBV感染引起的传染性单核细胞增多症诊断中价值不大。它的出现可为当前原发感染,近期原发感染,既往感染或复发等,其虽不能作为近期感染指标,但可用于流行病学调查研究等[10]。
EBV-VCA-IgM出现早,阳性率高,敏感度(92.0%),特异度(96.0%),阳性预测值(95.8%),阴性预测值(92.3%)均较佳,恢复期消失,其存在示EBV初次感染,是IM急性期的重要指标,有助于临床诊断及指导临床治疗,由于方法快速,简便易行,在基层医院可以推广应用。EBV-VCA-IgA滴度升高在鼻咽癌中有重要诊断意义,对传染性单核细胞增多症诊断意义不大。EBV-VCA-IgG在特异度、阳性预测值都有较满意结果。但阴性预测值较低,易造成假阳性。
[1]周正任,主编.医学微生物学[M].第6版.北京:人民卫生出版社,2005,317-320.
[2]张卓然,主编.临床微生物学和微生物学检验[M].第6版,北京:人民卫生出版社,2006.442-445.
[3]朱易萍,高举,杜惠容,等.196例传染性单核细胞增多症的并发症和实验室检查[J].实用儿科临床杂志,2003,18(11):902.
[4]张雅欧,罗春华,马廉.传染性单核细胞增多症与白血病、恶性组织增生症及机体免疫状况的关系[J].实用儿科临床杂志,1995,10(5):265.
[5]赵林清,钱渊.EB病毒感染及其相关性疾病[J].中华儿科杂志,2003,41(10):797-799.
[6]Stevens S J,Verluijlen S A,Brule A J,et al.Comparison of quancitatice competive PCR with Lightcycler-based PCR for measuring Epstein-Barr virus DNA load in clinical specimens[J].J Clin Microbiol,2002,40(11):3986-3992.
[7]Behrman RE.Tecxbook of pediatries,12.72 Infections mononucleosis[M].14 edition.WB saunders company.1992.805-808.
[8]郭迪,刘湘云,齐家仪.儿科基础与临床[M].上海:上海科技出版社,1988,1042.
[9]Momso PG,Pou FJ,Infectious Mononucleasis in childhood[J].An Esp Pediarr,1992,36(3):219.
[10]Lang D,Vomhangen R,Rothe M,et al.cross-reactivity of Epstein-Barr virus-specific immumog;obulin antibodies with cytomeg alovirus antigens containing glycine homoplymers[J].Clin Diagh Labimmunol,2001,8(4):747-756.
