高龋患者变形链球菌葡糖基转移酶基因B-1923位点多态性
2010-06-20刘学军
刘学军,薛 晶
郑州大学口腔医学院口腔内科郑州450052
葡糖基转移酶(glucosyltransferase,GTF)是变形链球菌自发合成的固有酶,可特异地利用蔗糖合成胞外多糖[1-2],与变形链球菌致龋性密切相关,被认为是龋病发生的重要因素[3],对其基因遗传多态性的研究对龋病的防治更具有不可低估的作用。该研究以不同龋敏感人群的变形链球菌gtfB-1923这一多态位点为研究对象,分析不同基因型致龋菌在不同龋敏感人群中分布的差异,以期发现其与龋易感性的关系。
1 材料与方法
1.1 实验菌株 变形链球菌国际参考株GS5(武汉大学口腔医学院惠赠);153株血清C型变形链球菌临床分离株,94株来自高龋人群[龋、失及补牙数(decayed,missing,filled teeth,DMFT)≥6],59 株来自无龋人群(DMFT=0),均为2006年9月至2008年1月郑州大学第四附属医院口腔内科收治病例。
1.2 引物的设计与合成 变形链球菌GS5 gtfB基因的全序列参见GenBank,序列号M17361。根据引物设计原则[4],采用引物设计软件Primer 5.0自行设计引物,上游引物 5’-AGCGACATCTAAGCAAG-3’,下游引物 5’-AAGGAATAAGAAGGGACT-3’,扩增1 470 bp的基因片段,由上海捷瑞生物技术公司合成。
1.3 主要试剂 细菌基因组DNA提取试剂盒、PCR Master Mix及D2000 Marker(北京天根生物科技有限公司),限制性内切酶EcoRⅠ(美国Promega公司),荧光染料GeneFinder(美国Sigma公司)。
1.4 实验菌株基因组DNA的提取 取在胰化蛋白胨多价蛋白胨酵母提取物(TPY)培养液中过夜培养的菌液3 mL,按细菌基因组DNA提取试剂盒说明书操作提取全菌DNA,然后在10 g/L琼脂糖凝胶中120 V 20 min电泳检测,置于GDS8000凝胶自动分析仪中观察,用UV-240紫外分光光度自动记录仪测定DNA样品在260和280 nm处的吸光度(A)值,计算A(260 nm)/A(280 nm)的比值,判断DNA的纯度。
1.5 gtfB片段的PCR扩增 以各实验菌株的全菌基因组DNA为模板,采用PCR方法扩增目的基因片段。总反应体积25 μL,组成如下:2×Taq PCR Master Mix 12.5 μL,上、下游引物各 0.5 μL,DNA模板2 μL,ddH2O 9.5 μL。循环参数:94 ℃预变性5 min,94 ℃变性50 s,52 ℃ 退火 50 s,72 ℃ 延伸2 min,共30个循环,72℃总延伸10 min。
1.6 PCR扩增产物的检测 取5 μL PCR产物,加2 μL核酸染料,以D2000 Marker为相对分子质量参照标准,在15 g/L的琼脂糖凝胶及TBE缓冲液中电泳30 min,电压为110 V,采用 Gene Genius凝胶成像分析系统观察并记录电泳条带。
1.7 限制性片段长度多态性(restriction fragmentlength polymorphism,RFLP)分析 内切酶EcoRⅠ的反应体系:EcoRⅠ酶0.5 μL,PCR 产物 1 μL,Buffer 2 μL,BSA 缓冲液 0.2 μL,ddH2O 16.3 μL,总反应体积20 μL。按照说明书控制酶切条件和时间,37℃水浴4 h终止酶切反应。取5 μL酶切产物加1 μL核酸染料,以D2000 Marker为相对分子质量参照标准,在20 g/L的琼脂糖凝胶及TBE缓冲液中电泳30 min,电压为110 V,采用Gene Genius凝胶成像分析系统观察并记录电泳条带。与标准菌GS5的PCR-RFLP酶谱相同菌株的基因型称为A型,不同的称为B型。
1.8 统计学处理 采用SPSS 13.0对不同龋易感人群gtfB的基因型分布情况行χ2检验,并计算OR值和95%CI,检验水准 α =0.05。
2 结果
2.1 实验菌株基因组DNA的提取结果 所有实验菌株的DNA抽提产物的A(260 nm)/A(280 nm)的比值均在1.6~2.0之间,表明抽提的DNA无污染。
2.2 PCR扩增结果 153株临床菌株及标准菌株GS5全部可扩增出目的基因片段,电泳后在1 470 bp处出现单一强带,与预计相同(图1)。
图1 变形链球菌临床
2.3 RFLP分析结果 GS5经EcoRⅠ酶切后可观察到的2条片段约为1 000和450 bp。临床菌株经EcoRⅠ酶切后则出现2种图谱:一种与GS5的酶切图谱一致;另一种只有1个条带(1 470 bp),见图2。
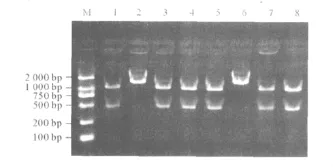
图2 变形链球菌临床分离株
2.4 不同龋敏感人群gtfB基因型变形链球菌分布情况 结果见表1。可见,携带A型基因的人群高龋患病的风险增加。
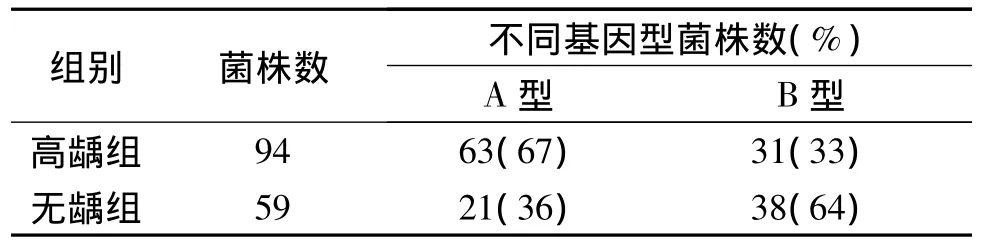
表1 不同龋易感人群gtfB基因型变形链球菌分布情况
3 讨论
变形链球菌的致龋性主要在于它能够牢固地黏附于牙面并代谢食物中的碳水化合物产酸[5],其GTF通过合成水不溶性和水溶性葡聚糖而在这一过程中发挥重要作用[6]。变形链球菌的GTF有3种不同类型,即GTF-I、GTF-SI和GTF-S。gtfB是与变形链球菌致龋性关系较密切的GTF相关基因,它所编码的GTF-I利用蔗糖作为底物合成的水不溶性葡聚糖参与了细菌之间及细菌与牙体之间的蔗糖依赖性黏附。有研究[7]发现龋病的发生与特定基因型高致龋性变形链球菌的定植有关。高龋个体通常携带有GTFs合成能力高的菌株[8]。作者采用PCRRFLP技术对高龋和无龋者口腔中的变形链球菌进行检测,定性分析gtfB-1923位点不同基因型的检出率与龋病的关系,为今后筛选龋高危人群,有针对性地开展预防工作提供实验依据。
变形链球菌的gtf基因存在广泛的遗传多态性[9-10]。目前发现gtf有2种情况可形成多态性:一种是由于gtfB或gtfC的5’端编码区基因产生点突变而形成;另一种是由于gtfB与gtfC之间发生同源重组而导致。关于点突变与龋易感性关系的研究,国内少有报道。作者选择gtfB-1923位点进行研究。gtfB-1923位点位于催化活性区内,催化活性区是GTFs的主要功能区,负责蔗糖的水解、催化,与其致龋性密切相关。突变位点明确 A→G致使5’-GAATTC-3’变为 5’-GAGTTC-3’,避免了实验设计中因内切酶等试剂的选择不当而影响实验结果。限制性内切酶EcoRⅠ的酶切位点与突变位点相一致,符合使用内切酶技术进行单核苷酸多态性研究的条件。作者发现经EcoRⅠ对特异扩增的gtfB片段消化后,获得2种酶切图谱,一种与GS5相同,EcoRⅠ位点存在(称为A型),在琼脂糖凝胶上电泳后可观察到2个条带,分别为1 000和450 bp;另一种与GS5不同,只有1个条带1 470 bp(称为B型)。变形链球菌国际参考株GS5(血清C型)是公认致龋性较强的毒力株,其GTF合成细胞外葡聚糖尤其是合成水不溶性葡聚糖的能力较强[11]。统计分析显示:2种基因型在龋蚀状态不同的人群中检出率存在差异,在分离出的变形链球菌菌株中A型菌株在高龋人群中的比例高于无龋人群;而B型菌株在无龋人群中的比例高于高龋人群;高龋组和无龋组检出A和B基因型菌株的OR值为3.677,95%CI为1.854~7.293,提示龋的发生与变形链球菌的基因类别有一定的关系,携带A型基因的人群高龋患病的风险增加。结果提示:gtfB-1923位点A→G的互换可能影响GTF-I酶的活性及功能,这一位点的突变可能与其致龋性相关。gtfB-1923位点A→G的互换可能下调酶的活性,从而降低菌株的黏附能力或者合成胞外多糖的能力,进而影响菌株的致龋性,临床上表现为个体对龋的低易感性。
[1]岳松龄.现代龋病学[M].北京:北京医科大学·中国协和医科大学联合出版社,1993:72
[2]Tamesada M,Kawabata S,Fujiwara T,et al.Synergistic effects of streptococcal glucosyltransferases on adhesive biofilm formation [J].J Dent Res,2004,83(11):874
[3]Taubman MA,Nash DA.The scientific and public-health imperative for a vaccine against dental caries [J].Nat Rev Immunol,2006,6(7):555
[4]Dieffenbach CW,Lowe TM,Dveksler GS.General concepts for PCR primer design [J].PCR Methods Appl,1993,3(3):S30
[5]Idone V,Brendtro S,Gillespie R,et al.Effect of an orphan response regulator on Streptococcus mutans sucrosedependent adherence and cariogenesis[J].Infect Immun,2003,71(8):4 351
[6]Devulapalle KS,Mooser G.Glucosyltransferase inactivation reduces dental caries[J].J Dent Res,2001,80(2):466
[7]Mattos-Graner RO,Smith DJ,King WF,et al.Water-insoluble glucan synthesis by mutans streptococcal strains correlates with caries incidence in 12-to 30-month-old children[J].J Dent Res,2000,79(6):1 371
[8]黄晓晶,刘天佳,杨锦波,等.高龋及无龋者变形链球菌临床分离株致龋性研究:Ⅱ合成细胞外多糖能力的实验研究[J].华西口腔医学杂志,2000,18(6):419
[9]Yamashita Y,Bowen WH,Kuramitsu HK.Molecular analysis of a Streptococcus mutans strain exhibiting polymorphism in the tandem gtfB and gtfC genes[J].Infect Immun,1992,60(4):1 618
[10]Chia JS,Lin SW,Hsu TY,et al.Analysis of a DNA polymorphic region in the gtfB and gtfC genes of Streptococcus mutans[J].Infect Immun,1993,61(4):1 563
[11]Kuramitsu HK.Characterization of extracellular glucosyltransferase activity of Steptococcus mutans[J].Infect Immun,1975,12(4):738
