HPV16 E6E7与C3d3融合基因真核表达质粒的构建及表达*
2010-06-15郑秀惠郭建新郑英如李军果陈竹钦
郑秀惠,李 力,郭建新,郑英如,李军果,林 爽,陈竹钦
(第三军医大学大坪医院野战外科研究所妇产科,重庆400042)
宫颈癌是最常见的妇科恶性肿瘤之一,严重威胁着女性健康。已有研究证明,高危型人乳头瘤病毒(human papillomavirus,HPV)持续感染是宫颈癌主要致病原因,而高危型HPV E6、E7蛋白为转化基因,在宫颈癌组织和细胞系内呈构成性持续表达,与细胞转化和病毒复制的调控有关,在转化组织恶性表型的维持中具有至关重要的作用,并具有一定抗原性。因此,利用E6和(或)E7作为靶抗原进行疫苗研究具有重要意义[1]。目前以E6和(或)E7为靶抗原的宫颈癌疫苗的研究取得了一定进展,但仍面临诱导免疫应答弱,难以产生令人满意的免疫保护效应等问题。因此,需通过一定途径增强其免疫原性,激发更有效的免疫应答,进一步提高其免疫保护效应和抗肿瘤作用[2-3]。近年研究发现,2~3个串联的补体C3裂解片段C3d具有强烈的免疫佐剂效应,可大大提高抗原的免疫原性,而且补体分子为人体自身成分,不良反应小[4-5]。因此,本研究引入C3d作为分子内佐剂,制备了含有HPV16E6E7和串联的3个C3d(C3d3)融合基因的真核表达质粒,以期制成一种高效、安全的宫颈癌DNA疫苗。
1 材料与方法
1.1 菌种、质粒及细胞 含HPV16全基因序列的重组质粒pBR322/HPV16由德国癌症研究中心(DKFZ)Emde Villiers教授惠赠。真核表达质粒pSG.SS.YL及含有串联的3个拷贝C3d的 pSG.SS.C3d3.YL由英国Fearon教授惠赠。T载体pM DT-18购自Promega公司。大肠杆菌E.coli DH5α为本室保存。COS-7细胞购自中科院上海细胞库。
1.2 主要试剂 PCR试剂盒购自上海生工生物有限公司,DNA琼脂糖凝胶回收试剂盒和质粒提取试剂盒购自美国OM EGA BIO-TEK公司,T4 DNA连接酶及限制性内切酶BamHⅠ、BglⅡ等均购自美国MBI公司,质粒转染试剂盒 Lipofectamine 2000购自美国Invitrogen公司,HPV16E7鼠单克隆抗体由本室保存,BM Chemiluminescence Western Blotting试剂盒为Roche公司产品,辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠IgG及DAB试剂盒为北京中杉生物有限公司产品。
1.3 DNA疫苗质粒的构建 根据HPV16 E6E7 cDNA序列,并在两端分别添加BglⅡ和BamHⅠ酶切位点,设计引物后交由上海生工生物公司合成。上、下游引物分别为5′-GAA GAT CTG CCT CTG TGG GT T TGC CTG GCG A TT T TC-3′,5′-CGG GAT CCT TCC AAG TTG GTC TT T TCC TGG GCA CC-3′。以 pBR322/HPV16为模板进行 PCR扩增(95℃预变性 5min,94℃、15s,58℃、30s,72℃、40s,完成 30个循环后于体系中加rTaq 5u,68℃保温20min加A尾)。扩增产物进行1.2%的琼脂糖凝胶电泳,判断扩增片段的大小及扩增质量后,利用试剂盒常规回收约770bp的片段,连入中间载体pMDT-18得到pMDT-18-E6E7,将其与真核表达载体质粒pSG.SS.C3d3.YL及pSG.SS.YL进行 BglⅡ和BamHⅠ双酶切,获得770bp左右的目的片段和线性化的骨架质粒,相连后获得重组质粒pSG.SS.E6E7.C3d3.YL和 pSG.SS.E6E7.YL,再进行酶切及DNA序列测定鉴定。
1.4 重组质粒转染真核细胞 采用Lipofectamine 2000(Invitrogen,USA)试剂盒,将重组质粒瞬时转染真核细胞COS-7,依照说明书进行操作,简要步骤如下:(1)孔培养板内铺盖玻片后接种COS-7细胞,接种量为1×106细胞/孔;(2)取4μ g质粒DNA及10uL Lipofectamine,均使用250μ L无血清 DMEM 培养基进行稀释后混合;(3)在6孔板中加入DNA-Lipofectamine混合物,轻摇混匀,于37℃、50mL/L CO2培养箱中培养48h。
1.5 重组质粒转染真核细胞后表达产物的鉴定 采用Western blot技术,首先收集转染细胞培养上清液,经离心(10 000r/min,4℃,10min)并浓缩后,按常规进行蛋白定量,并用上样缓冲液稀释至 2 500μ g/mL后进行 SDS-PAGE电泳和Western blot分析。一抗和二抗分别为HPV16E7鼠单克隆抗体(1∶100)、HRP标记的羊抗鼠IgG(1∶1 000)。取6孔板内铺有细胞的盖玻片,经PBS洗涤、冷丙酮固定、0.3%H2O2甲醇溶液封闭以及T riton-X 100通透等步骤,依次加入一抗和二抗(同前),再经DAB显色后,光镜下观察照相。
2 结 果
2.1 目的片段HPV16E6E7的获取 通过PCR技术成功获得了大小约770 bp的片段,与E6E7理论值相符(图1)。
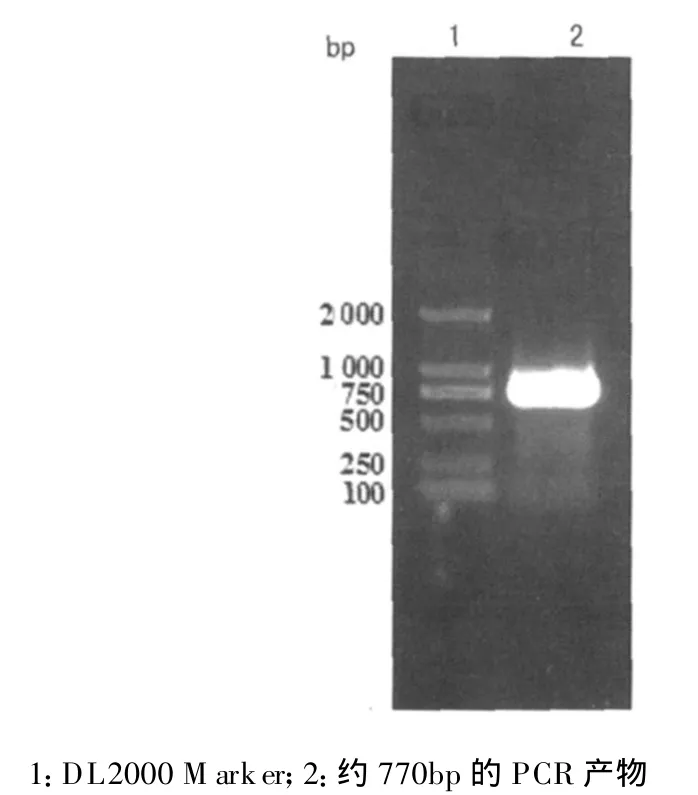
图1 PCR扩增E6E7片段凝胶电泳图
2.2 重组质粒的构建 将pMDT-18-E6E7、pSG.SS.C3d3.YL、pSG.SS.YL均进行BglⅡ和 BamHⅠ双酶切,可分别获得大小约770bp的片段和线性化的质粒(图2)。
将上述约 770bp片段和线性化的 pSG.SS.C3d3.YL、pSG.SS.YL骨架质粒进行连接反应后,转入DH5α菌中进行扩增,并筛选出重组质粒pSG.SS.E6E7.C3d3.YL和pSG.SS.E6E7.YL,再次用BamH Ⅰ、BglⅡ双酶切,均可获得两个片段,其中小片段大小均为 770bp(图 3),同 E6E7预期理论值相符。
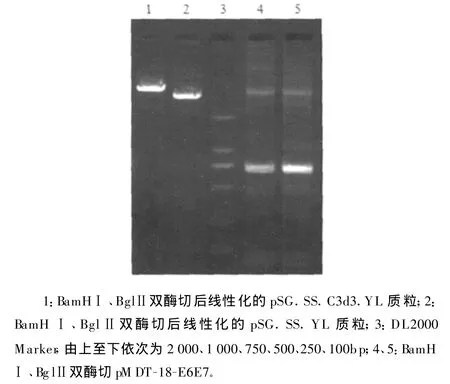
图2 重组质粒的构建
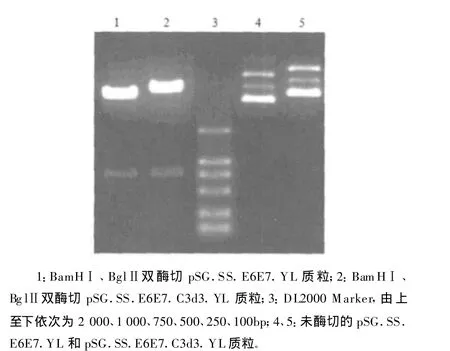
图3 重组质粒pSG.SS.E6E7.C3d3.YL和pSG.SS.E6E7.YL酶切电泳图
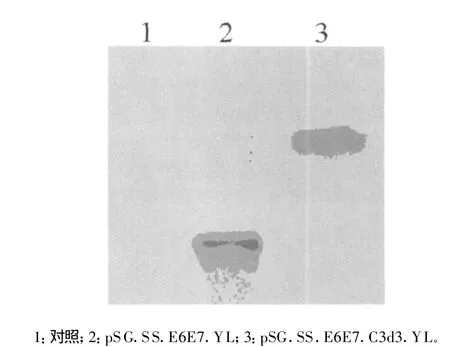
图4 pSG.SS.E6E7.C3d3.YL和pSG.SS.E6E7.YL转染COS-7细胞后培养上清液中蛋白产物的Western Blot检测结果
2.3 重组质粒转染真核细胞后表达产物的鉴定 经SDSPAGE和Western blot分析可见两条带(图 4),分别对应于pSG.SS.E6E7.C3d3.YL和pSG.SS.E6E7.YL转染COS-7细胞后培养上清液中的蛋白产物,Mr大小与E6E7-C3d3融合蛋白(约为146×103)及 E6E7蛋白(约为36×103)的理论值相近。免疫细胞化学分析显示转染细胞胞浆和胞膜呈阳性反应,表明目的片段能够正确表达。
3 讨 论
宫颈癌是常见的妇科恶性肿瘤之一,严重威胁着女性身体健康。HPV感染和子宫颈癌有着密切的关系,90%以上的宫颈癌组织中含有HPV DNA[6]。目前已发现有100多种基因型HPV,80%的宫颈癌与其中4个高危型HPV感染有关,分别是16、18、31和45型,而50%的宫颈癌与 HPV16型感染有关[7]。目前虽然早期宫颈癌患者放疗及手术治疗效果较好,但中晚期患者则多采用放、化疗为主的综合性治疗方法。由于放疗有较大不良反应及宫颈癌对化疗的不敏感性,且费用大,复发率高,有约35%的患者出现目前尚无法治疗的严重合并症,因此研究开发以HPV为靶点的宫颈癌预防性和治疗性疫苗很有必要。
有研究证实,在大多数HPV16相关宫颈癌及其癌前病变中,HPV E6和E7蛋白的持续表达在肿瘤发生发展中起重要作用。E6对肿瘤恶性转化的机制主要有两种:(1)结合并降解p53;(2)激活端粒酶使正常细胞永生化。E7则是与视网膜母细胞癌蛋白(Rb)反应发挥转化活性。因此,E6和(或)E7两种蛋白可作为发展HPV16相关宫颈癌及癌前病变治疗性疫苗的理想靶抗原。
与单独E6或 E7基因免疫相比,利用E6E7两段基因为靶基因构建DNA疫苗,可涵盖较多的抗原表位(包括Th表位、CTL表位),诱发机体产生针对靶细胞可能呈递的多个抗原表位的杀伤性T细胞克隆,从而表现出较高的杀伤活性,获得免疫活性加强的效果[8]。目前,以 HPVE6和(或)E7蛋白为靶抗原的治疗性疫苗有重组蛋白疫苗、多肽疫苗、嵌合疫苗、核酸疫苗等,已经完成了动物实验。结果证明,这些疫苗均可诱导动物产生特异性细胞免疫反应,但Ⅰ/Ⅱ临床实验并未取得良好的免疫效果,其主要原因是患者机体处于免疫抑制状态,应用疫苗后并没有诱导机体产生足够强的特异性细胞免疫反应。因此,如何选择恰当的佐剂以进一步提高免疫效果,是开发HPV16治疗性疫苗的关键。
近年补体研究领域有一个重要发现,即补体C3裂解片段C3d具有促进免疫应答的佐剂效应,为解决上述问题提供了一条有效途径。目前,C3d的佐剂效应已在HIV、流感病毒和牛腹泻病毒等传染病的疫苗研制中得到了充分的实验证实[4-5,9]。此外,由于补体分子为人体自身成分,不良反应小,本研究设想,如果将补体分子C3d作为分子内佐剂与E6E7分子相连,则有可能制成安全、有效的抗HPV疫苗。基于以上分析,本研究设计并制备了含有E6E7和串联的3个C3d融合基因的真核表达质粒,以期获得一种高效、安全的HPV疫苗,为宫颈癌治疗提供一种新的思路。本实验证实质粒完全符合设计要求,能够在真核细胞中良好表达,为其作为DNA疫苗接种实验动物后免疫效应的研究奠定了实验基础。
[1]Jung WW,Chun T,Sul D,et al.Strategies against human papillomavirus infection and cervical cancer[J].J Microbiol,2004,42(4):255.
[2]Steller MA.Cervical cancer vaccines:progress and prospects[J].Soc Gynecol Investig,2002,9(5):254.
[3]Rocha Z,avaleta L,Alejandre JE,et al.Parentera and oralimmunization with aplasmid DNA expressing the human papillomavirus16-L1gene induces systemic and mucosal antibodies and cytotoxic Tlymphocyteresponses[J].J Med Virol,2002,66(1):86.
[4]Watanabe I,Ross TM,Tamura S,et al.Protection against influenza virus infection by intranasal administration of C3d fused hemagglutinin[J].Vaccine,2003,21(31):4532.
[5]Wang L,Sunyer JO,Bello LJ.Fusion to C3d enhances the immunogenicity of the E2 glycoprotein of type 2 bovine viral diarrhea virus[J].J Virol,2004,78(4):1616.
[6]Subramanya D,Grivas PD.HPV and cervical cancer:updates on an established relationship[J].Postgrad Med,2008,120(4):7.
[7]Schiffman M,Khan M J,Solomon D,et al.A study of the impact of adding Human papillomaviruses types to cervical cancer screening and triage tests[J].J Natl cancer Inst,2005,97(2):147.
[8]Velders MP,Weijzen S,Eiben GL,et al.Defined flanking spacers and enhanced proteolysis is essential for eradication of established tumors by an epitope string DNA vaccine[J].J Immunol,2001,166(9):5366.
[9]Green TD,Montefiori DC,Ross TM.Enhancement of antibodies to the human immunodeficiency virus type 1 envelope by using the molecular adjuvant C3d[J].J Virol,2003,77(3):2046.
